За счет чего совершается максимальная полезная работа живым организмом
Максимальная и максимально полезная работа



Изменение энтропии определяет направление и предел течения самопроизвольных процессов для изолированных систем, то есть для систем, внутренняя энергия и объем которых постоянны, или для систем, в которых постоянны энтальпия и давление.
Рассмотрим изотермические процессы.
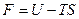
где U – внутренняя энергия системы, S – энтропия системы, T – абсолютная температура.
Изохорно-изотермический потенциал является функцией состояния, его изменение при переходе системы из состояния 1 в состояние 2 определяется разностью значений в конечном и начальном состояниях 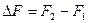
При переходе из состояния 1 в состояние 2 термодинамическая система выполнит максимальную работу, если этот переход является обратимым процессом.
Согласно первому закону термодинамики 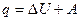
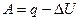
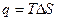
Следовательно, при переходе из состояния 1 в состояние 2 система совершит работу
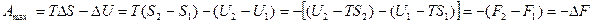
Функцию Fназывают свободной энергией при постоянном объеме. Свободная энергия – это та часть внутренней энергии процесса, которая может быть полностью превращена в работу. Эту работу ( 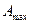
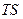
Таким образом, в системах, находящихся при постоянных температуре и объеме (T=const. и V=const.), самопроизвольно могут протекать только те процессы, которые сопровождаются уменьшением изохорно-изотермического потенциала F.
Причем, пределом их протекания, то есть условием равновесия, является достижение некоторого минимального для данных условий значения функции F, то есть условие
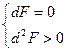
2 Направление и предел самопроизвольного протекания процесса для систем, находящихся при постоянных давлении и температуре (p=const.и T=const.), определяет изобарно-изотермический потенциал (изобарный потенциал) или энергия Гиббса:
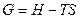
где Н – внутренняя энергия системы, S – энтропия системы, T – абсолютная температура.
Так как 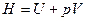
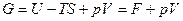
Изменение изобарно-изотермического потенциала для любого процесса
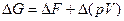
для изобарного процесса (p=const.)
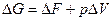
для всякого изотермического процесса (T=const.)
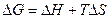
Максимально полезной работой 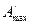
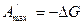
Так как 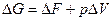
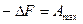
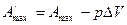
то есть максимальная полезная работа 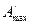
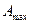
Таким образом, в системах, находящихся при постоянных температуре и давлении (T=const. и р=const.), самопроизвольно могут протекать только те процессы, которые сопровождаются уменьшением изобарно-изотермического потенциала G.
Причем, пределом их протекания, то есть условием равновесия, является достижение некоторого минимального для данных условий значения функции G, то есть условие
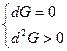
Таким образом, для оценки хода любого термодинамического процесса существует определенная характеристическая функция (G, F, U, H, S), изменение которой определяет характер течения данного процесса.
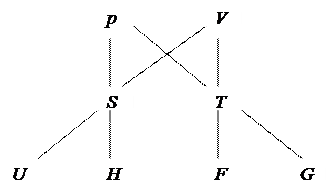
Выбрать функцию, которая является характеристической для процесса, протекающего при двух постоянных термодинамических параметрах, можно из рисунка 5.
Рис. 5. Схема выбора характеристической функции процесса
При T=const.и V=const. характеристической функцией является изохорно-изотермический потенциал F.
При T=const. и р=const. – изобарно-изотермический потенциал G.
Изобарные процессы (р=const.) характеризует энтальпия Н.
Изохорные (V=const.) – внутренняя энергия U.
Термодинамические процессы (химические реакции) будут протекать в прямом направлении, соответствующем записи уравнения реакции (слева направо), если изменение соответствующей характеристической функции является отрицательным.
Свободная энергия живого организма и виды работ, совершаемых им. Биологическое окисление питательных веществ. Энергия АТФ и виды ее изменения



Работа A – мера превращения энергии из одной формы в другую. Численно работа равна энергии, превращенной из одной формы в другую в процессе совершения работы.
Свободная и связанная энергия.
Внутренняя энергия любой системы состоит из двух разных частей:
1. Свободная энергия G – это та часть внутренней энергии, которую в принципе можно полностью использовать для совершения работы.
2. Связанная энергия WСВЯЗ, которую в данных условиях вообще нельзя превратить в работу.
U = G + WСВЯЗ
В живых организмах свободная энергия, получаемая при усвоении пищи, почти целиком выделяется в ходе биологического окисления, происходящего на внутренних мембранах митохондрий.
Примерно 50%этой энергии выделяется в виде тепла, которое целиком уходит в окружающую среду.
Остальные 50% тратятся на синтезтак называемых макроэргов (важнейщий АТФ) – веществ, обеспечивающих энергией все клетки организма.
Ф + Н2О → А-Ф-Ф + Н3 РО4 + энергия
| (АТФ) (АДФ) (около30 кДж/моль) |
Работа в живом организме производится за счёт энергии, выделяющейся
при отщеплении от АТФ концевой фосфатной группы НРО3 и переносе этой группы на какое-то другое вещество, чаще всего – на воду:
На совершение работы используется около 40% энергии АТФ, или 20% от исходной энергии пищи.
Остальная энергия опять-таки превращается в теплои уходит из организма.
Таким образом, КПД организма составляет около 20%.
Синтез макроэргов происходит, и основном, за счёт окисления мономеров, на которые расщепляются в кишечнике пищевые продукты.
Важнейшим из этих мономеров является глюкоза.
За счёт энергии, выделяющейся при окислении 1 моля глюкозы, может синтезироваться 36 молей АТФ. Это так называемый аэробный синтез; он требует расхода кислорода.
Кроме того, 2 моля АТФ могут синтезироваться без участия кислорода при других реакциях (анаэробный синтез).
Таким образом, за счёт энергии 1 моля глюкозы всего может синтезироваться 38 молей АТФ.
Основные виды работы, совершаемой в живых организмах:
1. Механическая работа;
2. Химический синтез (особенно сложных биомолекул);
3. Поддержание физико-химических градиентов на мембранах;
4. Перенос электрических зарядов.
Теплоотдача человека. Виды обмена тепла с окружающей средой и их доля в теплообмене.
Количество теплоты Q – мера передачи энергии в процессе теплообмена.
Свободную энергию Гиббса
При нагревании растет, при конденсации уменьшается;
2) при нагревании уменьшается, при конденсации растет;
3) не происходит изменение T-S;
4) при нагревании и конденсации растет.
48. Какие параметры системы необходимо поддерживать постоянными, чтобы по знаку изменения энтропии можно было судить о направлении самопроизвольного протекания процесса?
1) давление и температуру;
2) объем и температуру;
3) внутреннюю энергию и объем;
4) только температуру.
49. В изолированной системе все самопроизвольные процессы протекают в сторону увеличения беспорядка. Как при этом изменяется энтропия?
2) увеличивается;
4) сначала увеличивается, а затем уменьшается.
50. Энтропия возрастает на величину Q/T для:
1) обратимого процесса;
2) необратимого процесса;
51 Как изменяется энтропия системы за счет прямой и обратной реакции при синтезе аммиака?
1) прямая реакция идет с уменьшением энтропии, обратная — с увеличением;
2) прямая реакция идет с увеличением энтропии, обрат-лая __с уменьшением;
3) энтропия не изменяется в ходе реакции;
4) энтропия увеличивается для прямой и обратной реакции.
52. Какими одновременно действующими факторами определяется направленность химического процесса?
1) энтальпийным и температурным;
2) энтальпийным и энтропийным;
3) энтропийным и температурным;
4) изменением энергии Гиббса и температуры.
53.В изобарно-изотермических условиях максимальная работа, осуществляемая системой:
1) равна убыли энергии Гиббса;
2) больше убыли энергии Гиббса;
3) меньше убыли энергии Гиббса;
4) равна убыли энтальпии.
54. Какие условия необходимо соблюдать, чтобы максимальная работа в системе совершалась за счет убыли энергии Гиббса?
1) необходимо поддерживать постоянными V и t;
2) необходимо поддерживать постоянными Р и t;
3) необходимо поддерживать постоянными АН и AS;
4) необходимо поддерживать постоянными PиV
55. За счет чего совершается максимальная полезная работа химической реакции при постоянных давлении и температуре?
1) за счет убыли энергии Гиббса;
2) за счет увеличения энтропии;
3) за счет увеличения энтальпии;
4) за счет уменьшения энтропии.
56.За счет чего совершается маскимальная полезная работа живым организмом в изобарно-изотермических условиях?
1) за счет убыли энтальпии;
2) за счет увеличения энтропии;
3) за счет убыли энергии Гиббса;
4) за счет увеличения энергии Гиббса.
57. Какие процессы называют эндэргоническими?
4) AG > 0.
58.Какие процессы называют экзэргоническими?
59.Самопроизвольный характер процесса лучше определять путем оценки:
2) свободной энергии Гиббса;
60. Какую термодинамическую функцию можно использовать для предсказания возможности самопроизвольного протекания процессов в живом организме?
2) внутреннюю энергию;
61. Для обратимых процессов изменение свободной энергии Гиббса.
1) всегда равно нулю;
2) всегда отрицательно;
3) всегда положительно;
4) положительно или отрицательно в зависимости от обстоятельств.
62. Для необратимых процессов изменение свободной энергии:
1) всегда равно нулю;
2) всегда отрицательно;
3) всегда положительно;
4) положительно или отрицательно в зависимости от обстоятельств.
63.В изобарно-изотермических условиях в системе самопроизвольно могут осуществляться только такие процессы, в результате которых энергия Гиббса:
3) уменьшается;
4) достигает максиального значения.
64. Для некоторой химической реакции в газовой фазе при постоянных Р и TAG > 0. В каком направлении самопроизвольно протекает эта реакция?
Г) в прямом направлении;
2) не может протекать при данных условиях;
3) в обратном направлении;
4) находится в состоянии равновесия.
65. Каков знак AG процесса таяния льда при 263 К?
1) AG > 0;
3) AG 0;AS>0; 2)AH>0;AH 0; 2)AH 0; AS > 0; 4)AH = 0;AS = 0.
68. Если АН [T4AS];
2) при любых соотношениях АН и TAS; 3)
2) АН 0;
71. При каких постоянных термодинамических параметрах изменение энтальпии может служить критерием направления самопроизвольного процесса? Какой знак DH в этих условиях указывает на самопроизвольный процесс?
1) при постоянных S и Р, АН 0; 4) при постоянных Vn t, АН > 0.
72. Можно ли и в каких случаях по знаку изменения энтальпии в ходе химической реакции судить о возможности ее протекания при постоянных Ти Р1
1) можно, если ЛЯ » T-AS;
2) при данных условиях нельзя;
3) можно, если АН « T-AS;
4) можно, если АН = T-AS.
4) масса.
74. Какие из следующих утверждений верны для реакций, протекающих в стандартных условиях?
1) эндотермические реакции не могут протекать самопроизвольно;
2) эндотермические реакции могут протекать при достаточно низких температурах;
3) эндотермические реакции могут протекать при высоких температурах, если AS > 0;
4) эндотермические реакции могут протекать при высоких температурах, если AS 0;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
«основы химической термодинамики, химической кинетики и равновесия» Основы химической термодинамики
Главная > Документ
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
«ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ, ХИМИЧЕСКОЙ КИНЕТИКИ И РАВНОВЕСИЯ»
Основы химической термодинамики
1) скорости протекания химических превращений и механизмы этих превращений;
2) энергетические характеристики физических и химических процессов и способность химических систем выполнять полезную работу;
3) условия смещения химического равновесия;
4) влияние катализаторов на скорость биохимических процессов.
2. Открытой системой называют такую систему, которая:
1) не обменивается с окружающей средой ни веществом, ни энергией;
2) обменивается с окружающей средой и веществом, и энергией;
3) обменивается с окружающей средой энергией, но не обменивается веществом;
4) обменивается с окружающей средой веществом, но не обменивается энергией.
3. Закрытой системой называют такую систему, которая:
1) не обменивается с окружающей средой ни веществом, ни энергией;
2) обменивается с окружающей средой и веществом, и энергией;
3) обменивается с окружающей средой энергией, но не обменивается веществом;
4) обменивается с окружающей средой веществом, но не обменивается энергией.
4. Изолированной системой называют такую систему, которая:
1) не обменивается с окружающей средой ни веществом, ни энергией;
2) обменивается с окружающей средой и веществом, и энергией;
3) обменивается с окружающей средой энергией, но не обменивается веществом;
4) обменивается с окружающей средой веществом, но не обменивается энергией.
5. К какому типу термодинамических систем принадлежит раствор, находящийся в запаянной ампуле, помещен ной в термостат?
6. К какому типу термодинамических систем принадле жит раствор, находящийся в запаянной ампуле?
7. К какому типу термодинамических систем принадле жит живая клетка?
1) величина которых не зависит от числа частиц в системе;
2) величина которых зависит от числа частиц в системе;
3) величина которых зависит от агрегатного состояния системы;
4) величина которых зависит от времени.
9. Какие параметры термодинамической системы называют интенсивными?
!) величина которых не зависит от числа частиц в системе;
2) величина которых зависит от числа частиц в системе;
3) величина которых зависит от агрегатного состояния;
4) величина которых зависит от времени.
1) зависят только от начального и конечного состояния системы;
2) зависят от пути процесса;
3) зависят только от начального состояния системы;
4) зависят только от конечного состояния системы.
13. Какие из следующих свойств являются экстенсивными: а) плотность; б) давление; в) масса; г) температура; д) энтальпия; е) объем?
15. Процессы, протекающие при постоянной температуре, называются:
2) весь запас энергии системы;
3) весь запас энергии системы, кроме потенциальной энергии ее положения;
4) величина, характеризующая меру неупорядоченности расположения частиц системы.
1) второй закон термодинамики;
3) первый закон термодинамики;
1) работой, теплотой и внутренней энергией;
2) свободной энергией Гиббса, энтальпией и энтропией системы;
3) работой и теплотой системы;
4) работой и внутренней энергией.
l)AU=0 2)AU=Q-p-AV 3)AG = AH-TAS
1) внутренняя энергия не изменится, энтальпия изменится;
2) внутренняя энергия изменится, энтальпия не изменится;
3) внутренняя энергия не изменится, энтальпия не изменится;
4) внутренняя энергия изменится, энтальпия изменится.
1) при постоянном объеме;
2) при постоянной температуре;
3) при постоянном давлении;
2) внутренней энергии;
4) свободной энергии Гиббса.
1) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изобарно-изотер-мических условиях;
2) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изохорно-изотер-мических условиях;
3) величина, характеризующая возможность самопроизвольного протекания процесса;
4) величина, характеризующая меру неупорядоченности расположения и движения частиц системы.
28. Химические процессы, при протекании которых происходит уменьшение энтальпии системы и во внешнюю среду выделяется теплота, называются:
1) при постоянном объеме;
2) при постоянной температуре;
3) при постоянном давлении;
1) внутренней энергии;
2) ни одно из предыдущих определений неверно;
31. Какие процессы называют эндотермическими?
1) для которых АН отрицательно;
2) для которых AG отрицательно;
3) для которых АН положительно;
4) для которых AG положительно.
1) для которых АН отрицательно;
2) для которых AG отрицательно;
3) для которых АН положительно;
4) для которых AG положительно.
1) тепловой эффект реакции зависит только от начального и конечного состояния системы и не зависит от пути реакции;
2) теплота, поглощаемая системой при постоянном объеме, равна изменению внутренней энергии системы;
3) теплота, поглощаемая системой при постоянном давлении, равна изменению энтальпии системы;
4) тепловой эффект реакции не зависит от начального и конечного состояния системы, а зависит от пути реакции.
34. Какой закон лежит в основе расчетов калорийности продуктов питания?
35. При окислении каких веществ в условиях организма выделяется большее количество энергии?
4) углеводов и белков.
1) осуществляется без помощи катализатора;
2) сопровождается выделением теплоты;
3) осуществляется без затраты энергии извне;
4 ) протекает быстро.
1) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изобарно-изотер-мических условиях;
2) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изохорно-изотер-мических условиях;
3) величина, характеризующая возможность самопроизвольного протекания процесса;
4) величина, характеризующая меру неупорядоченности расположения и движения частиц системы.
4) внутренней энергией.
I) S (г) > S (ж) > S (тв); 2)S(тв)>S(ж)>S(г); 3)S(ж)>S(г)>S(TB); 4) агрегатное состояние не влияет на значение энтропии.
1) повышении давления;
2) переходе от жидкого к твердому агрегатному состоянию
3) повышении температуры;
4) переходе от газообразного к жидкому состоянию.
42. Какую термодинамическую функцию можно использовать, чтобы предсказать возможность самопроизвольного протекания реакции в изолированной системе?
2) внутреннюю энергию;
4) потенциальную энергию системы.
2) возрастает на величину Q/T;
3) возрастает на величину, большую Q/T;
4) возрастает на величину, меньшую Q/T.
4) достигает минимального значения
1) в изобарных, при постоянных Р и Т;
2) в изохорных, при постоянных V и Т;
1) при нагревании растет, при конденсации уменьшается;
2) при нагревании уменьшается, при конденсации растет;
3) не происходит изменение T-S;
4) при нагревании и конденсации растет.
1) давление и температуру;
2) объем и температуру;
3) внутреннюю энергию и объем;
4) только температуру.
4) сначала увеличивается, а затем уменьшается.
1) обратимого процесса;
2) необратимого процесса;
51 Как изменяется энтропия системы за счет прямой и обратной реакции при синтезе аммиака?
1) прямая реакция идет с уменьшением энтропии, обратная — с увеличением;
2) прямая реакция идет с увеличением энтропии, обрат-лая __с уменьшением;
3) энтропия не изменяется в ходе реакции;
4) энтропия увеличивается для прямой и обратной реакции.
1) энтальпийным и температурным;
2) энтальпийным и энтропийным;
3) энтропийным и температурным;
4) изменением энергии Гиббса и температуры.
53. В изобарно-изотермических условиях максимальная работа, осуществляемая системой:
1) равна убыли энергии Гиббса;
2) больше убыли энергии Гиббса;
3) меньше убыли энергии Гиббса;
4) равна убыли энтальпии.
1) необходимо поддерживать постоянными V и t;
2) необходимо поддерживать постоянными Р и t;
3) необходимо поддерживать постоянными АН и AS;
4) необходимо поддерживать постоянными PиV
1) за счет убыли энергии Гиббса;
2) за счет увеличения энтропии;
3) за счет увеличения энтальпии;
4) за счет уменьшения энтропии.
56. За счет чего совершается маскимальная полезная работа живым организмом в изобарно-изотермических условиях?
1) за счет убыли энтальпии;
2) за счет увеличения энтропии;
3) за счет убыли энергии Гиббса;
4) за счет увеличения энергии Гиббса.
58. Какие процессы называют экзэргоническими?
59. Самопроизвольный характер процесса лучше определять путем оценки:
2) свободной энергии Гиббса;
2) внутреннюю энергию;
4) свободную энергию Гиббса.
1) всегда равно нулю;
2) всегда отрицательно;
3) всегда положительно;
4) положительно или отрицательно в зависимости от обстоятельств.
1) всегда равно нулю;
2) всегда отрицательно;
3) всегда положительно;
4) положительно или отрицательно в зависимости от обстоятельств.
63. В изобарно-изотермических условиях в системе самопроизвольно могут осуществляться только такие процессы, в результате которых энергия Гиббса:
4) достигает максиального значения.
Г) в прямом направлении;
2) не может протекать при данных условиях;
3) в обратном направлении;
4) находится в состоянии равновесия.
1)AH>0;AS>0; 2)AH>0;AH 67. В каком из следующих случаев реакция возможна при любых температурах?
1)ДH 0; 2)AH 0; AS > 0; 4)AH = 0;AS = 0.
3) AH# 0, AS 70. При каких соотношениях АН и T* AS химический процесс направлен в сторону эндотермической реакции:
1) при постоянных S и Р, АН 0; 4) при постоянных Vn t, АН > 0.
1) можно, если ЛЯ » T-AS;
2) при данных условиях нельзя;
3) можно, если АН « T-AS;
4) можно, если АН = T-AS.
1) эндотермические реакции не могут протекать самопроизвольно;
2) эндотермические реакции могут протекать при достаточно низких температурах;
3) эндотермические реакции могут протекать при высоких температурах, если AS > 0;
1) будет, так как AG > 0;
3) не будет, так как AG > 0;
1) выделяемая при полном окислении 1 г питательных веществ;
2) выделяемая при полном окислении 1 моль питательных веществ;
3) необходимая для полного окислении 1 г питательных веществ;
4) необходимая для полного окислении 1 моль питательных веществ.
1) может при высоких температурах, так как \T-AS\ > |АД];
2) может при низких температурах, так как \T-AS\ |AH];