Блокаторы раас что это
Артериальная гипертензия: обзор препаратов
Тонкости консультирования клиентов аптеки с рецептами на ингибиторы АПФ и сартаны
Артериальная гипертензия — самая распространенная сердечно-сосудистая патология, которой страдает около 40 % взрослого населения Европы [1]. Разумеется, это приводит и высокому спросу на антигипертензивные препараты независимо от сезона. И хотя в задачу первостольника прежде всего входит предложить несколько вариантов ЛС согласно выписанному в рецепте МНН, ему также предстоит разъяснять побочные эффекты, дозировку, а иногда и отвечать на вопросы об особенностях механизма действия. Поэтому мы решили предложить нашим читателям цикл статей о группе антигипертензивных препаратов и особенностях работы с запросами на них. Начнем с блокаторов ренин-ангиотензин-альдостероновой системы.
РААС: основа основ
Прежде чем приступить к описанию препаратов, ненадолго погрузимся в тонкости фармакологии и еще раз вспомним, каков механизм действия ренин-ангиотензин-альдостероновой системы, или РААС.
РААС — сложная гормонально-ферментативная система, в которую вовлечены практически все органы и ткани организма, но ключевые роли в ней принадлежат печени, почкам, надпочечникам и легким.
В печени постоянно синтезируется альфа-2‑глобулин ангиотензиноген. В то же время в почках вырабатывается фермент ренин в ответ на снижение внутрипочечного давления, снижение доставки натрия и хлора, а также на гипоксию. Он поступает, так же как и ангиотензиноген, в системный кровоток, где и связывается с ним с образованием ангиотензина I.
Ангиотензин I — вещество практически инертное. Он не действует на сосуды и является лишь предшественником активного компонента ангиотензина II. В образовании последнего наряду с ангиотензином I участвует ангиотензинпревращающий фермент (АПФ), который вырабатывается в легких.
Ангиотензин II — главное звено схемы РААС. Он проявляет мощный сосудосуживающий эффект и воздействует на органы-мишени, в которых расположены рецепторы к нему. Прежде всего речь идёт об эндотелии, сердце и почках. Вот почему высокий уровень ангиотензина II связан не только с повышением давления, но и с поражением сосудистой стенки, миокарда, почек и с развитием хронической сердечной и почечной недостаточности.
Кроме того, ангиотензин II вызывает усиление синтеза гормона надпочечников альдостерона. Последний участвует в контроле артериального давления (АД), регулируя гомеостаз калия, натрия и объема внутриклеточной жидкости. Под его влиянием повышается давление, увеличивается чувствительность гладких мышц сосудов к сосудосуживающим веществам, в том числе ангиотензину II.
Таким образом, РААС напрямую вовлечена в драму под названием «артериальная гипертензия», играя в ней одну из главных ролей. К счастью, существует возможность заблокировать эту систему. Сделать это позволяют препараты двух фармакологических групп — ингибиторы ангиотензинпревращающего фермента (иАПФ) и блокаторы рецепторов ангиотензина II (БРА, они же сартаны).
Первый класс препаратов — ингибиторы АПФ
Препараты этой группы стали одним из первых классов ЛС, которые эффективно снижают активность РААС, — их разработка началась еще в 60‑х годах прошлого века [2]. Сегодня они входят в категорию так называемых «лекарств, спасающих жизни» (life-saving drugs), в связи с доказанной способностью улучшать прогноз при ряде сердечно-сосудистых и почечных заболеваний [2].
Ингибиторы АПФ: механизм действия и эффект
Ингибиторы АПФ снижают уровень циркулирующего ангиотензина II за счет блокады ангиотензинпревращающего фермента, что обусловливает комплексный фармакологический эффект:
При приеме препаратов группы ингибиторы АПФ также улучшается углеводный обмен: повышается чувствительность тканей к инсулину и улучшается метаболизм глюкозы.
Показания и свойства
Спектр активности иАПФ позволяет использовать их при артериальной гипертензии, ишемической болезни сердца, хронической сердечной недостаточности, нефропатиях и остром инфаркте миокарда [3].
Ингибиторы АПФ относятся к группе антигипертензивных препаратов, которые определенно снижают АД и замедляют прогрессирование сердечной недостаточности, что определяет их широкое применение в кардиологии. Данные обзора с участием 158 998 пациентов с АГ показали, что прием иАПФ позволяет снизить смертность от всех вышеперечисленных причин. Это — существенное преимущество препаратов иАПФ, в том числе и по сравнению с блокаторами ангиотензина II [4].
Однако иАПФ все‑таки не способны полностью предотвратить превращение ангиотензина I в ангиотензин II, поскольку существует ряд других ферментов, которые успешно «заменяют» АПФ. Именно так работают, к примеру, ферменты химаза, эластаза и катепсин G [5]. При применении иАПФ эти вещества компенсаторно активируются, и блокада РААС становится неполной. Это — существенный недостаток иАПФ.
О чем предупредить клиента?
Важно! Во время консультации уместно подчеркнуть, что препараты, блокирующие активность РААС — иАПФ и БРА, — при постоянном применении наряду с антигипертензивным эффектом защищают сердце и сосуды, достоверно снижая частоту сердечно-сосудистых катастроф. Это маленькое замечание может послужить убедительным аргументом в пользу регулярного и дисциплинированного употребления таких ЛС, согласно инструкции и рекомендациям врача.
Ингибиторы АПФ: вспомним поименно
Рассмотрим особенности некоторых препаратов — представителей группы иАПФ.
Переносимость иАПФ
Предмет особого внимания первостольников, как специалистов, отпускающих препарат, — побочные эффекты иАПФ. Несмотря на в целом благоприятный профиль безопасности, неблагоприятные реакции — слабое звено препаратов этой группы.
О чем предупредить клиента?
Второй класс препаратов — блокаторы рецепторов ангиотензина II
Исследования, которые были сконцентрированы на изучении возможностей блокады РААС, привели к открытию группы препаратов, лишенных классического недостатка иАПФ — побочного эффекта в виде кашля. БРА, или сартаны, более полно блокируют РААС, за счет чего обеспечивают лучшую переносимость, чем их предшественники. Несмотря на относительно недавнее введение в клиническую практику — сартаны начали использоваться для длительного лечения АГ только в 1999 году, — представители этой группы сегодня стали одними из наиболее популярных антигипертензивных ЛС [12].
Сартаны: механизм действия и эффект
Фармакологический эффект сартанов идентичен эффекту иАПФ. За счет конкурентной блокады рецепторов ангиотензина II они подавляют вазоконстрикцию, секрецию альдостерона, уменьшают гипертрофию миокарда, а также улучшают функцию эндотелия.
Механизм действия БРА заключается не в блокаде ангиотензинпревращающего фермента, как в случае с иАПФ, а в блокаде рецепторов ангиотензина АТ1, через которые и реализуется подавляющее большинство физиологических эффектов ангиотензина II (вазоконстрикция и так далее). АТ1‑рецепторы расположены преимущественно в гладкой мускулатуре сосудов, сердце, печени, коре надпочечников, почках, легких и мозге.
За последние 10 лет появились препараты, которые некоторые специалисты предлагают выделить в отдельное, второе поколение БРА. Они не только блокируют АТ1‑рецепторы, но и способствуют нормализации обмена углеводов и липидов.
Показания и свойства
Сартаны, так же как и иАПФ, назначают при целом ряде заболеваний, в том числе при артериальной гипертензии, хронической сердечной недостаточности, перенесенном инфаркте миокарда, диабетической нефропатии, фибрилляции предсердий и метаболическом синдроме. Кроме того, БРА становятся препаратами выбора в ситуациях, когда на фоне приема иАПФ развивается кашель [13].
Доказана эффективность сартанов выраженно снижать артериальное давление и оказывать кардиопротективное действие [13, 14], а также:
Кроме того, некоторые БРА, так же как и иАПФ, снижают вероятность развития диабета и проявляют нефропротективный эффект.
Отдельные представители сартанов
Большинство сартанов имеет схожие свойства и мало чем отличается друг от друга как по фармакокинетическим показателям, так и по гипотензивной и кардиопротективной активности. Но всё же некоторые БРА имеют особенности:
Переносимость сартанов
БРА отличаются хорошей переносимостью, в том числе и по сравнению с иАПФ, поскольку не вызывают кашель. Высокий профиль безопасности препаратов этой группы — залог приверженности больных лечению и успешного результата. Побочные эффекты, которые могут возникать при приеме сартанов, обычно мало выражены. Как правило, они носят преходящий характер и редко становятся основанием для отмены лечения.
О чем предупредить клиента?
В заключение еще раз подчеркнем: иАПФ и БРА доказали и гипотензивный, и кардиопротективный эффект. Подавляющее большинство препаратов этих групп (за исключением фимасартана) сегодня применяется для лечения широкого спектра сердечно-сосудистых заболеваний. Единственное важное условие их эффективности — регулярный, длительный прием и соблюдение всех рекомендаций врача. Напомнив об этом посетителю с рецептом на иАПФ и БРА в конце консультации, первостольник выполнит свой профессиональный долг, приобретет лояльного клиента, а заодно внесет свой вклад в борьбу с одним из самых распространенных заболеваний в мире.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Блокаторы раас что это
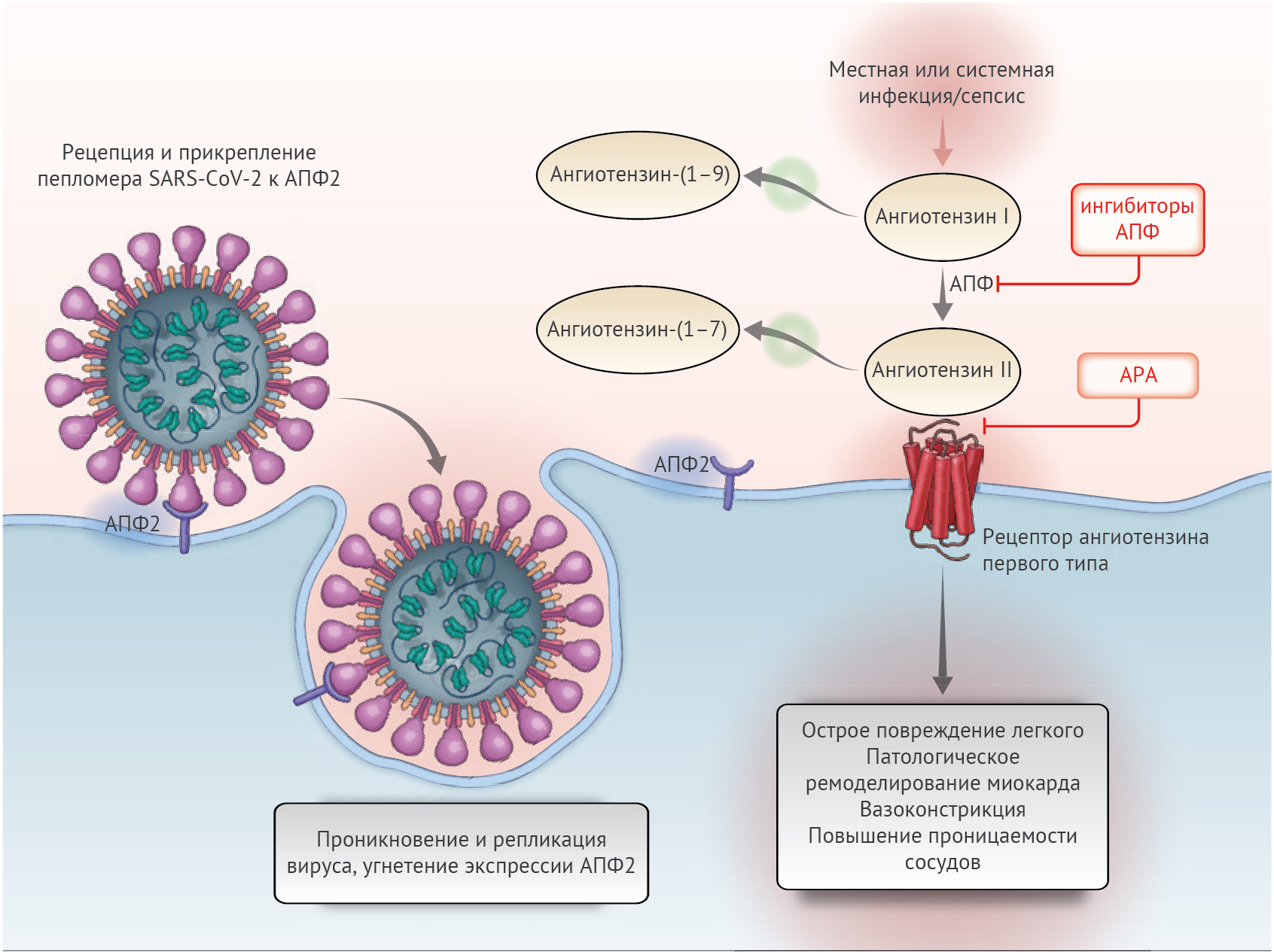
Ренин-ангиотензин-альдостероновая система (РААС) — это элегантный каскад вазоактивных пептидов, организующий ключевые физиологические процессы в теле человека. Коронавирусы тяжелого острого респираторного синдрома SARS-CoV-1 и SARS-CoV-2 стали причиной эпидемии тяжелого острого респираторного синдрома в 2002–2004 годах и текущей пандемии коронавирусной инфекции (COVID-19). Эти вирусы взаимодействуют с РААС через ангиотензин-превращающий фермент 2 (ACE2, АПФ2) — белок, физиологической функцией которого является угнетение активации РААС, но который также служит рецептором для обоих типов вирусов SARS. Эта связь между вирусами SARS и АПФ2 рассматривается как потенциальный фактор инфективности, соответственно, высказываются опасения относительно применения ингибиторов РААС, которые изменяют активность АПФ2, и влияния различий в экспрессии АПФ2 на степень вирулентности вируса в текущей пандемии COVID-19. Действительно, недавно некоторые СМИ и системы здравоохранения призвали к отказу от ингибиторов АПФ и антагонистов рецепторов ангиотензина (АРА) как с профилактической целью, так и в контексте подозрения на COVID-19.
Принимая во внимание обширное применение ингибиторов АПФ и АРА во всем мире, существует срочная потребность в рекомендациях по использованию этих лекарств в терапии пациентов с COVID-19. Здесь мы подчеркиваем, что собранные данные на человеческих выборках весьма скудны и не могут быть применены для подтверждения или опровержения высказываемых гипотез и опасений. В особенности мы обсуждаем неопределенные эффекты блокаторов РААС на уровень и активность АПФ2 у людей и выдвигаем альтернативную гипотезу о том, что изменения АПФ2 могут быть полезны, а не вредны для пациентов с поражениями легких. Также мы недвусмысленно хотим выразить озабоченность касаемо отказа от применения ингибиторов РААС, так как считаем, что это может быть опасным для некоторых пациентов из групп высокого риска с выявленным или подозреваемым COVID-19.
COVID-19 и пожилые пациенты с сопутствующей патологией
Первые доклады обращали внимание на потенциально высокую встречаемость гипертензии среди пациентов с COVID-19 по сравнению с общей популяцией. В самой большой серии случаев из Китая, собранных во время пандемии, гипертензия была самой часто встречаемой сопутствующей патологией у 1099 пациентов, что составляло примерно 15 % от выборки, однако эти значения оказываются ниже, чем встречаемость гипертензии у пациентов с другими вирусными инфекциям, и ниже, чем частота гипертензии в популяции Китая.
По данным докладов, сопутствующие патологии, включая гипертензию, встречались гораздо чаще у пациентов с тяжелым течением COVID-19, требующих перемещения в отделения интенсивной терапии и назначения ИВЛ, или у погибших пациентов в сравнении с пациентами с более мягким течением. Высказываются опасения, что терапия сопутствующих патологий, в том числе применение ингибиторов РААС, могла внести вклад в исход основного заболевания. Однако эти исходы наблюдались также в тесной связи с пожилым возрастом, который в настоящее время считается самым значимым предиктором COVID-19-ассоциированной смерти. К сожалению, на сегодняшний день в докладах недостаточное внимание уделяется возрасту или иным важным факторам, которые могут выступать в качестве потенциальных предикторов риска. Для других инфекционных заболеваний сопутствующие патологии, такие как гипертензия, являются ключевыми прогностическими факторами, что, скорее всего, верно и в отношении COVID-19.
Важно отметить, что, несмотря на заключения о применении ингибиторов РААС, в этих работах отсутствуют конкретные данные. Согласно популяционным исследованиям, доля получающих антигипертензивную терапию от общего числа больных гипертензией в Китае составляет всего от 30 до 40 %. Ингибиторы РААС как базовую терапию или в составе комбинированной терапии получают только 25–30 %пациентов, проходящих лечение. Представленные данные позволяют оценить, что лишь незначительная часть пациентов с COVID-19 получала терапию ингибиторами РААС, по крайней мере в Китае. Необходимо получить информацию о связи терапии ингибиторами РААС и соответствующими исходами основного заболевания со строгим учетом показаний к терапии и тяжести сопутствующего заболевания у пациентов с COVID-19.
Неопределенные эффекты ингибиторов РААС на АПФ2 у людей
Тканеспецифичные и системные компоненты РААС составляют сложную переплетающуюся сеть активирующих и ингибирующих пептидов (рис. 1). АПФ2 — важнейший ингибирующий белок, ответственный за распад ангиотензина II до ангиотензина-(1–7), который таким образом ослабляет его эффекты на вазоконстрикцию, задержку натрия и процессы фиброзирования. Хотя ангиотензин II и является главным субстратом АПФ2, этот фермент также может превращать ангиотензин I в ангиотензин-(1–9) и участвовать в гидролизе иных пептидов. В исследованиях на людях была показана обширная экспрессия АПФ2 в образцах ткани, полученных из 15 органов, в числе которых были сердце и почки, а также в основных клетках-мишенях SARS-CoV-2 (c манифестными признаками поражения) — альвеолярном эпителии легких. Определенный интерес вызывает низкий уровень растворимых форм АПФ2 в системном кровотоке вместе с относительно низкой функциональной ролью АПФ2 в легочной ткани в нормальных условиях. Однако существуют клинические состояния, способствующие активации этого звена.
Можно ожидать, что ингибиторы АПФ и АРА оказывают разное влияние на уровень АПФ2, так как их эффекты на ангиотензин II (основной субстрат АПФ2) различаются. Несмотря на существенную структурную гомологию между АПФ и АПФ2, их активные центры различны. В результате этого ингибиторы АПФ не влияют на активность АПФ2 напрямую. Экспериментальные животные модели позволили обнаружить смешанное воздействие ингибиторов АПФ на уровни АПФ2 и его активность в тканях. Подобные противоречивые результаты в исследованиях на животных моделях наблюдались и в отношении влияния АРА на АПФ2. В одних исследованиях была обнаружена усиленная экспрессия матричной РНК АПФ2 или же увеличенные концентрации самого АПФ2, другие же работы не нашли никаких эффектов.
В отличие от работ на животных моделях, существует мало исследований эффектов ингибиторов РААС на экспрессию АПФ2 на людях. В одной работе описано, что внутривенное введение ингибиторов АПФ пациентам с коронарной недостаточностью никак не повлияло на продукцию ангиотензина-(1–7), что ставит под вопрос влияние ингибиторов АПФ на АПФ2-опосредованный метаболизм ангиотензина II вообще. Аналогично, в другом исследовании среди пациентов с гипертензией уровни ангиотензина-(1–7) остались неизменными после назначения ингибитора АПФ каптоприла. Однако если монотерапия каптоприлом продолжалась 6 месяцев, уровень ангиотензина-(1–7) увеличился. Кроме того, в нескольких исследованиях изучалась активность АПФ2 в плазме или концентрация АПФ2 в моче у пациентов на длительной терапии ингибиторами РААС. В кросс-секционных исследованиях пациентов с сердечной недостаточностью, фибрилляцией предсердий, аортальным стенозом и коронарной недостаточностью, принимающих ингибиторы АПФ или АРА, активность АПФ2 в плазме не отличалась от пациентов с такими же заболеваниями, не получавших терапии. В лонгитюдном когортном исследовании японских пациентов с гипертензией уровень АПФ2 в моче пациентов, получавших длительное лечение АРА олмесартаном, был выше, чем в контрольной группе, не получавшей терапии, но такого эффекта не наблюдалось в отношении ингибитора АПФ эналаприла или других АРА (лозартан, кандесартан, валсартан, и телмисартан). Предшествующая терапия ингибиторами АПФ связывалась с ростом уровня матричной РНК АПФ2 в тканях кишки, но никакой связи между терапией АРА и количеством РНК АПФ2 выявлено не было; влияние ингибиторов РААС на экспрессию АПФ2 в легочной ткани неизвестно.
Эти противоречивые данные указывают на всю сложность устройства ответов РААС на модуляторы и подтверждают предположение о том, что выводы доклинических исследований на модельных организмах нельзя однозначно переносить на человеческую физиологию. Это наводит на мысль, что воздействие ингибиторов РААС на АПФ2 может принимать различные формы в зависимости от конкретного препарата данного класса. Важно отметить, что уровни АПФ2 в плазме могут быть не показательны в отношении полноразмерной мембраносвязанной формы, частично из-за того, что процесс отделения АПФ2 от мембраны отдельно регулируется эндогенным ингибитором. Помимо степени экспрессии, значимость роли АПФ2 может различаться в зависимости от конкретной ткани или клинического состояния. К сожалению, отсутствуют данные о влиянии ингибиторов АПФ, АРА и других ингибиторов РААС на экспрессию АПФ2 в легочной ткани. Более того, даже если ингибиторы РААС и влияют на уровень и/или активность АПФ2 в тканях-мишенях, нет клинических данных о том, что это влияет на процесс связывания и проникновения пепломеров SARS-CoV-2 в клетку. Необходимо дальнейшее изучение взаимного влияния SARS-CoV-2 и РААС на людях.
Потенциальная польза ингибиторов РААС при COVID-19
SARS-CoV-2 не только использует АПФ2 для проникновения в клетку, он также угнетает его дальнейшую экспрессию, что приводит к прекращению его органопротективного действия. В настоящее время предполагается, хоть и без каких-либо доказательств, что непрерывное действие ангиотензина II может частично влиять на степень повреждения органа при COVID-19. Сразу после рецепции и прикрепления пепломера вируса начинается процесс последовательного снижения концентрации АПФ2 на поверхности мембраны. Продолжительно персистирующая вирусная инфекция и репликация вирионов также вносят вклад в снижение экспрессии АПФ2, во всяком случае на клеточных культурах in vitro. Угнетение активности АПФ2 в легких обусловливает первичную инфильтрацию нейтрофилов в ответ на бактериальные эндотоксины и может вести к чрезмерному накоплению освободившегося от ингибирования ангиотензина II и местной активации РААС. Действительно, в экспериментальных моделях на мышах воздействие пепломеров SARS-CoV-1 вызывало острое поражение легких, которое ограничивалось блокадой РААС. В экспериментах с другими мышиными моделями авторы пришли к выводу, что дисрегуляция АПФ2 может способствовать вторичному острому поражению легких при первичном поражении вирулентными штаммами вируса гриппа и респираторно-синцитиального вируса человека. В небольшом исследовании проследили корреляцию между повышенным уровнем плазменного ангиотензина II с общей вирусной нагрузкой и степенью тяжести поражения легких у пациентов с COVID-19. Восстановление уровня АПФ2 посредством введения рекомбинантного препарата АПФ2 позволило обратить разрушительные процессы в легочной ткани на доклинических моделях иных острых вирусных инфекций, а в испытаниях второй фазы у людей с острым респираторным дистресс синдромом безопасно снизить уровень ангиотензина II.
Дисрегуляция АПФ2 при COVID-19 в теории может привести к снижению его кардиопротективного эффекта при вовлечении миокарда и аномальной легочной гемодинамики. Уровни маркеров повреждения миокарда повышались во время развития COVID-19 и продолжали нарастать при ухудшении течения заболевания и перед смертью. Многие вирусы кардиотропны, и многие вирусемии сопровождаются субклиническим вирусным миокардитом. Роль АПФ2 в ответе миокарда на повреждения и его восстановлении хорошо известна. Так, в одном исследовании на животных с нокаутированным геном АПФ2 у них развивались крайне неблагоприятные процессы ремоделирования левого желудочка в ответ на острое повреждение в связи с накоплением ангиотензина II. При аутопсии пациентов, погибших от SARS, в 35 % образов сердец было обнаружено присутствие вирусной РНК, которое, в свою очередь, было ассоциировано со сниженной экспрессией АПФ2. Введение рекомбинантного АПФ2 нормализовало уровень ангиотензина II в изолированных сердцах человека, пораженных дилатационной кардиомиопатией. Данные гипотезы легли в основу испытаний рекомбинантного препарата АПФ2 для восстановления баланса РААС и потенциального предотвращения органного повреждения. В дополнении к этому, на текущий момент проводятся парные исследования лозартана для лечения COVID-19 на пациентах, не получавших ранее терапию блокаторами РААС, которые были госпитализированы, и на пациентах, не имевших госпитализаций в анамнезе.
Продолжение применения блокаторов РААС у пациентов с выявленным или подозреваемым COVID-19
Несмотря на приведенные теоретические противоречия относительно влияния фармакологический регуляции АПФ2 на инфективность SARS-CoV-2, существует явный риск здоровью при отмене терапии блокаторами РААС у пациентов, которые в остальном находятся в стабильном состоянии. COVID-19 протекает особенно тяжело у пациентов с сопутствующими кардиоваскулярными патологиями, что ведет к активному поражению миокарда, миокардиальному стрессу, и кардиомиопатии. Блокаторы РААС показали клиническую эффективность в отношении протективного действия на сердце и почки, их отмена может привести к клинической декомпенсации у пациентов в группах высокого риска.
Несмотря на то, что данные по сердечной недостаточности нечасто встречаются в эпидемиологических докладах из Китая, встречаемость сердечной недостаточности среди пациентов в критическом состоянии в США может быть велика (> 40 %). В клинических испытаниях квинаприла для лечения сердечной недостаточности было продемонстрировано серьезное прогрессирующее ухудшение состояния пациентов с хронической симптоматической сердечной недостаточностью. В исследовании TRED-HF среди пациентов с асимптоматической сердечной недостаточностью и восстановленной фракции выброса левого желудочка был продемонстрирован стремительный рецидив дилатационной кардиомиопатии сразу после прекращения терапии (в том числе терапии блокаторами РААС). Более того, блокаторы РААС являются базисной терапией после инфаркта миокарда: продолжительная терапия на протяжении нескольких дней или недель после указанного события показала снижение ранней смертности. Инфаркт миокарда, ассоциированный с COVID-19, может быть более опасным среди клинически нестабильных пациентов в случае отмены блокаторов РААС.
Отмена блокаторов РААС, назначенных для контроля гипертензии, может нести меньшие риски, нежели их отмена при состояниях, для которых они показаны множеством клинических рекомендаций как базисный метод терапии, однако в этом случае она может быть сопряжена с иными трудностями. Отмена блокаторов РААС для перехода на другую антигипертензивную терапию у стабильных амбулаторных пациентов должна проводиться осторожно во избежание эффекта рикошета. Более того, подбор эквивалентной дозы иной антигипертензивной терапии может быть проблематичным на практике и зависеть от индивидуальных особенностей каждого пациента. Даже малые и непродолжительные скачки АД после смены терапевтической тактики связаны с избыточным кардиоваскулярным риском. Это может быть особенно важно у пациентов с COVID-19 — инфекцией, влекущей за собой активацию РААС, в странах, где не достигнут адекватный контроль артериального давления в популяции (например, в Китае).
Эффекты при отмене блокаторов РААС или при переходе на другие схемы терапии у пациентов с хронической болезнью почек (ХБП) остаются неопределенными. Хотя в Китае частота встречаемости ХБП, госпитализированных по поводу COVID-19, достаточно низка (1–3 %), в других странах и у пациентов в критическом состоянии встречаемость ХБП может быть выше. Многие пациенты испытывают острую почечную недостаточность разной степени в течении болезни. Для этих групп высокого риска рекомендуется принимать индивидуальные решения по терапевтической тактике в отношении блокаторов РААС, руководствуясь гемодинамическим статусом, функцией почек и клинической стабильностью.
На основе доступных данных мы считаем, что несмотря на теоретические опасения и неопределенность в отношении эффектов блокаторов РААС на АПФ2 и потенциального влияния этих препаратов на течение COVID-19, терапия блокаторами РААС должна быть продолжена у пациентов в стабильном состоянии, имеющих риск заражения или уже болеющих COVID-19 (см. сноску). Данную позицию сейчас поддерживает множество профессиональных ассоциаций (Таблица S2). Несмотря на то, что дополнительные данные могут влиять на принятие решений о терапии пациентов с COVID-19 из групп высокого риска, врачи должны осознавать нежелательные последствия преждевременного прекращения доказанной терапии из-за гипотетических опасений, основанных на неполных экспериментальных данных.
Ключевые положения взаимодействия между COVID-19 и ренин-ангиотензин-альдостероновой системой