Бета глюкуронидаза что это
β-глюкуронидаза
Смотреть что такое «β-глюкуронидаза» в других словарях:
глюкуронидаза — фермент класса гидролаз (КФ 3.2.1.31), катализирующий гидролитическое расщепление глюкуронида с образованием глюкуроновой кислоты и спирта; содержится в большинстве тканей у млекопитающих; отсутствие в организме Г. обусловливает развитие… … Большой медицинский словарь
бета-d-глюкуронидаза — Фермент, продуцируется в E.coli и вызывает окрашивание в результате расщепления 5 бром 4 хлор 3 индол бета D глюкуроновой кислоты [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN beta d glucuronidase … Справочник технического переводчика
бета-глюкуронидаза — Фермент, катализирующий гидролиз различных протеогликанов [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN beta glucuronidase … Справочник технического переводчика
β-глюкуронидаза — * β глюкуранідаза * β glucuronidase or gUS бактериальный фермент, катализирующий гидролиз различных β глюкуронидов, среди которых имеются синтетические субстраты, как, напр., нитрофенил глюкуронид (), 4 метилумбеллиферил глюкуронид (), 5 бром 4… … Генетика. Энциклопедический словарь
Гликозил-гидролазы — Модель молекулы гликозидазы с пространственной структурой в виде (β/α)8 бочонка … Википедия
Карбогидраза — Модель молекулы гликозидазы с пространственной структурой в виде (β/α)8 бочонка Модель молекулы гликозидазы с пространственной структурой в виде шести лопастного β пропеллера Гликозил гидролазы (или гликозидазы) катализируют гидролиз гликозидных… … Википедия
Карбогидразы — Модель молекулы гликозидазы с пространственной структурой в виде (β/α)8 бочонка Модель молекулы гликозидазы с пространственной структурой в виде шести лопастного β пропеллера Гликозил гидролазы (или гликозидазы) катализируют гидролиз гликозидных… … Википедия
Муциназа — Гиалуронидазы общее название группы ферментов различного происхождения, способных расщеплять кислые мукополисахариды (в т. ч. гиалуроновую кислоту). Содержание 1 Общая классификация и источники гиалуронидаз … Википедия
Гиалуронидаза — Гиалуронидазы общее название группы ферментов различного происхождения, способных расщеплять кислые мукополисахариды (в т. ч. гиалуроновую кислоту). Содержание 1 История открытия 2 Общая классификация и исто … Википедия
Глюкуроновая кислота — (от Глюкоза и греч. üron моча) одна из уроновых кислот (См. Уроновые кислоты), COH (CHOH)4COOH; в организме образуется из глюкозы при окислении её первичной спиртовой группы. Оптически активна, хорошо растворима в воде, tпл 167 172°С. D Г … Большая советская энциклопедия
Нефроти́ческий синдро́м — (syndromum nephroticum; греч. nephros почка) неспецифический симптомокомплекс, характеризующийся массивной протеинурией (5 г и более в сутки) и нарушениями белково липидного и водно солевого обмена, проявляющимися гипоальбуминемией,… … Медицинская энциклопедия
β-глюкуронидаза
Гнотобиоз * гнотабіёз * gnotobiosis — содержание лабораторных животных в стерильных условиях или при наличии микро организмов, которые идентифицированы и хорошо известны исследователю.
Гнотобиология * гнотабіялогія * gnotobiology — изучение животных в условиях отсутствия вредных микроорганизмов. Безмикробных животных получают путем естественного воспроизведения обычных животных в стерильных условиях или посредством размножения безмикробных животных, гнотофоров — путем искусственного заражения безмикробных животных культурой одного или нескольких точно идентифицированных видов. Их используют для изучения разных видов инфекций, иммунитета, обмена веществ, экологии, в частности, роли нормальных микроорганизмов существовании высших животных. В практике их применяют для апробации фармакологических препаратов (напр., антибиотиков), производства высокоспецифичных диагностических сывороток. Принципы Г. нашли широкое применение в клинической медицине (хирургии, трансплантологии, онкологии, инфекционной патологии и др.). Большое значение придается Г. при изучении космоса, условий жизни человека и животных в полете.
Гнотобиота * гнотабіёта * gnotobiota — известная исследователю микрофауна и микрофлора, являющиеся лабораторными объектами при гнотобиозе (см.).
Гобо-элемент * гоба-элемент * hobo element — класс транспозибельных (способных к перемещению; см. Транспозон) элементов у Drosophila melanogaster, вызывающих внутрихромосомные перестройки и нестабильность. Длина Г.-э. составляет 3 кб. Г.-э. содержит инвертированные концевые повторы (12 п. о.) и фланкируется в сайте интеграции 8 п. о.
Голобластическое дробление * галабластычнае драбленне * holoblastic cleavage — тип равномерного дробления клетки, при котором образуются дочерние клетки почти одинакового размера.
Гологамия, хологамия, макрогамия * галагамія, халагамія, макрагамія * hologamy — простейший тип полового процесса у одноклеточных (зеленые водоросли, низшие грибы), при котором сливаются целые особи.
Голометаболическое развитие * галаметабалічнае развіццё * holometabolic development or holometabolic d. — полный цикл превращений: яйцо → зародыш → личинка → взрослая особь (имаго), происходящих у насекомых в процессе онтогенеза (см.). Г. р. характерно для эволюционно более молодых отрядов насекомых, таких как чешуекрылые и двукрылые.
Голорепрессор * галарэпрэсар * holorepressor — см. Апорепрессор.
Голотип * галатып * holotype — единый образец, отобранный для описания вида.
Голофермент, голоэнзим, полный фермент * галафермент, галаэнзім, поўны фермент * holoenzyme — белковая молекула фермента, состоящая из двух или более субъединиц. Проявляет активность толь ко тогда, когда собраны в одну структуру все субъединицы, напр., функциональная форма батериальной ДНК-зависимой РНКполимеразы, содержащей коровый фермент плюс сигма-фактор (см.).
Голофилетическая родословная* галафілетычная радаслоўная * holophyletic lineage — эволюционная родословная всего вида.
Голоцентрическая хромосома, голокинетическая х., плевромитотическая х. * галацэнтрычная храмасома, галакінетычная х., плеўрамітатычная х. * holocentric chromosome or holokinetic ch. or pleuromitotic ch. — хромосома с диффузной центромерой (см.), в которой нити веретена (см.) прикрепляются по всей длине Г. х. (это приводит к равномерному перемещению всех ее частей в анафазе) либо лишь к некоторым ее участкам (известна у некоторых клопов).
Гольджи аппарат, г. комплекс * гольджы апарат, г. комплекс * golgi apparatus or g. complex or g. body — органелла эукариотической клетки, выявляемая при электронной микроскопии как комплекс, состоящий из плотно упакованных широких полостей и малых пузырьков. Г. а. в отличие от эндоплазматического ретикулума (см. Эндоплазматическая сеть) лишен рибосом (см.). Функции Г. а. заключаются в сборе (грануляции) продуктов секреции, модификации белков (гликозилирование, фосфорилирование и т. д.), образовании лизосом (см.), синтезе некоторых полисахаридов и в формировании клеточной мембраны. Органелла описана К. Гольджи в 1899 г.
Гомеобокса гены * гамеабокса гены * homeobox genes — см. Гомеотические гены. гомеодомен * гомеадамен * homeodomain — белковый домен размером около 60 аминокислот, транслируемый из гомеобокса (см.). Г. относятся к семье крайне консервативных белков, которые выявлены в большом количестве среди факторов транскрипции. Они образуют структуру «спираль-поворот-спираль» и специфично связываются с ДНК.
Гомеозис * гамеозіс * homeosis — резкое изменение строения органа (придаточный Г.) или развитие у особи частей тела или образований, которые в норме должны были быть расположены в др. сегменте тела (замещающий Г.). Г., или гетероморфоз (см.), может представлять собой либо чисто модификационное явление (фенокопию), либо быть наследственно обусловленным, т. е. результатом гомеозисной мутации (см.), напр. формирование антенны вместо ноги у дрозофилы.
Гомеозисные мутации * гамеозісныя мутацыі * homeosic mutations — мутации в гомеозисных генах, проявляющиеся в изменении характера морфогенеза, напр., в замещении одних структур на другие (гомологичные) в процессе индивидуального развития. У дрозофил наиболее известны Г. м. Bithorax (развитие двух брюшных отделов) и Antennapedia (развитиие ног вместо антенн), а также Proboscipedia, и др.
Гомеология * гамеалогія * homeology — частичная гомология, остаточная гомология (см. Гомеология хромосом).
Гомеология хромосом * гамеалогія храмасом * chromosome homeology — частичная гомология (см. Гомология) хромосом, у которых одинаковая последовательность локусов нарушена внутрихромосомной или межхромосомной перестройкой, вследствие чего их конъюгация осуществляется лишь частично.
Гомеоморфизм * гомеамарфізм * homeomorphism — 1. Значительное морфофизиологическое сходство особей двух или нескольких изначально родственных групп организмов, развивающихся параллельно в близких условиях жизни, но уже давно потерявших непосредственное родство и изолированных друг от друга (напр., медведи Старого и Нового света). Г. — результат конвергенции (см.), в ходе которой вторичное сходство, или аналогия, накладывается на первичное сходство, т. е. гомологию. 2. Сходство структуры организмов, эволюционно возникших независимо друг от друга, их Г. обусловлен обитанием в сходных условиях.
Гомеостаз(ис) * гамеастаз(іс) * homeostasis — состояние динамического подвижного равновесия всех элементов природной системы, которое поддерживается сложными приспособительными реакциями, а также постоянной функциональной саморегуляцией во всех ее звеньях. Реализация способности живой природы как системы противостоять воздействиям внешней и внутренней среды, сохранять относительное постоянство ее структуры и свойств/ функций (напр., постоянство температуры тела). Термин Г. употребляется в основном для характеристики состояния всех элементов на организменном и популяционном уровнях биологической организации (см. Гомеостаз генетический. Гомеостаз развития), а для экосистем чаще используют термин «динамическое (или экологическое) равновесие».
Гомеостаз генетический, г. популяционный * гамеастаз генетычны, г. папуляцыйны * genetic homeostasis or population h. — поддержание в популяции (см.) равновесной генетической структуры (ее стабильности и целостности), сопротивление нарушающим ее факторам при изменении условий окружающей среды.
Гомеостаз развития, г. индивидуального р. * гамеастаз развіцця, г. індывідуальнага р. * developmental homeostasis — устойчивость к внешним воздействиям на правленности, заданной в раннем онтогенезе (см. Развитие канализированное), на формирование определенного фенотипа в соответствии с имеющимся генотипом. Г. р. может нарушаться гомеозисными и др. мутациями (см. Канализация).
Гомеотические гены * гамеатычныя гены * homeotic genes — гены, определяющие программу развития органов и структур в организме.
Гомеотические мутации, гомеозисные м. * гамеатычныя мутацыі, гамеозісныя м. * homeotic mutations — мутации, в результате которых часть тканей развивающегося организма перемещается в др. место и на месте одного органа развивается другой. Наиболее полно Г. м. изучены у Drosophila melanogaster: aristapedia — вместо аристы на голове развивается нога; bithorax — галтеры развиваются в крыловидные образования.
Гоминиды * гамініды * hominids — члены семьи Гоминиды, которая включает в себя только род современного человека и его предков с того момента, как произошло отщепление рода «люди» от человекообразных обезьян.
Гомо * гома * homo — род людей, в который входит семейство Гоминид (см.). Семейство Гоминид включает в себя виды Гомо эректус (см.), Гомо хабилис (см.), Гомо неандерталис (см.) и Гомо сапиенс (см.).
Гомо неандерталис * гома неандэрталіс * homo neanderthalensis — вид из семейства Гоминид, который жил во временном промежутке 150-300 тыс. лет назад в Европе и Азии.
Гомо сапиенс * гома сапіенс * homo Sapiens — человек современный. Вид сформировался примерно 100 тыс. лет назад.
Гомо хабилис * гома хабіліс * homo habilis — вид из семьи Гоминид, который жил во временном промежутке 1,9-1,8 млн лет назад. Первый вид в роду Гомо и первый из гоминид, для которого доказано, что они производили и использовали орудия труда и охоты.
Гомо эректус * гома эрэктус * homo erectus — вид из семьи Гоминид, который жил во врменном промежутке 1,8 млн — 300 тыс. лет назад. Это первый вид Гомо, мигрировавший за пределы Африки.
Гомоаллельный, гомоаллели * гомаалельны, гомаалелі * homoallelic or homoalleles — определение, используемое для аллельных мутантных генов, имеющих мутации в одном и том же сайте (см.). Внутригенная рекомбинация между гомоаллелями невозможна, и функциональный цистрон (см.) не может быть образован.
Гомобрахеальная инверсия * гомабрахеальная інверсія * homobrachial inversion — парацентрическая инверсия (см.).
Гомогаметное скрещивание * гомагаметнае скрыжаванне * homogametic mating — скрещивание между особями одной популяции или вида.
Гомогаметный * гомагаметны * homogametic — см. Гомогаметный пол.
Гомогамия * гомагамія * homogamy or adichogamy or synacmy — 1. Одновременное созревание мужских и женских органов цветов. Г. является необходимым условием самоопыления (см.). 2. Передача особями мужского и женского пола одинаковых комбинаций генов.
Гомогенетическая конъюгация * гомагенетычная кан’югацыя * homogenetic pairing or h. conjuction — конъюгация гомологичных хромосом.
Бета-глюкуронидаза
| Поиск | |
|---|---|
| ЧВК | статьи |
| PubMed | статьи |
| NCBI | белки |
| глюкуронидаза, бета | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Идентификаторы | |||||||
| Символ | GUSB | ||||||
| Ген NCBI | 2990 | ||||||
| HGNC | 4696 | ||||||
| OMIM | 611499 | ||||||
| RefSeq | NM_000181 | ||||||
| UniProt | P08236 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 3.2.1.31 | ||||||
| Locus | Chr. 7 q11.21 | ||||||
| |||||||
СОДЕРЖАНИЕ
Структура [ править ]
Механизм катализа [ править ]
Специфическая активность Tyr504 в каталитическом механизме неясна. [14] При сравнении со структурными данными гомологичного фермента ксиланазы было высказано предположение, что Tyr504 β-глюкуронидазы может стабилизировать уходящий нуклеофил (Glu540) или модулировать его активность. [16]
В дополнение к этим остаткам, консервативный остаток аспарагина (Asn450) был предложен для стабилизации субстрата за счет действия водородной связи в 2-гидроксильной группе сахарного субстрата. [11] [17]
Повторяющаяся единица гепарансульфатного субстрата β-глюкуронидазы
Поверхностное изображение кармана активного центра β-глюкуронидазы с каталитическими остатками показано [1]
Изображен механизм гидролиза β-глюкуронидазой сахарного субстрата с высокоэнергетическими переходными состояниями, показывающими характер ионов оксокарбения [15]
Возможная стабилизация нуклеофильного остатка Glu540 с помощью Tyr504 в β-глюкуронидазе [16]
Прогнозируемая активность консервативного остатка Asn450 в стабилизации сахарного субстрата β-глюкуронидазы [11] [17]
Возможный солевой мостик между Glu352 и Arg216 в бета-глюкуронидазе человека [1] [18]
Синдром Хитрости [ править ]
Молекулярные приложения: использование в качестве репортерного гена [ править ]
В молекулярной биологии β-глюкуронидаза используется в качестве репортерного гена для мониторинга экспрессии генов в клетках млекопитающих и растений. Мониторинг активности β-глюкуронидазы с помощью анализа GUS позволяет определить пространственную и временную экспрессию рассматриваемого гена. [21]
См. Также [ править ]
Ссылки [ править ]
Дальнейшее чтение [ править ]
1bhg : БЕТА-ГЛЮКУРОНИДАЗА ЧЕЛОВЕКА В РАЗРЕШЕНИИ 2,6 А
Кишечная микрофлора: третий нелишний в иммунотерапии рака
Автор
Редактор
В онкологии наступает эра иммунотерапии. У иммунной системы есть мощный потенциал для борьбы со злокачественными опухолями, и науке становится известно все больше способов его реализовать. Однако в противостоянии между иммунитетом и раком есть еще один игрок, с которым приходится считаться, — кишечная микрофлора. В то время как одни микроорганизмы «партизанят» против иммунопрепаратов, другие могут стать ценным источником новых терапевтических подходов.
Более полувека назад двое ученых — Льюис Томас и Фрэнк Макфарлейн Бёрнет — выдвинули гипотезу о роли иммунной системы в контроле развития новообразований [1–3]. Ее суть Бёрнет сформулировал следующим образом:
«У крупных долгоживущих животных, в частности, большинства теплокровных позвоночных, в соматических клетках происходят генетические изменения, и часть этих изменений представляет собой шаг на пути к злокачественности. Существует эволюционная необходимость в каком-либо механизме для устранения или инактивации таких потенциально опасных мутантных клеток, и этот механизм имеет иммунологический характер».
У гипотезы было немало противников, но в последние десятилетия она получила многочисленные подтверждения. Иммунитет защищает человека от рака, и в этих защитных механизмах принимают участие T- и B-лимфоциты, макрофаги и натуральные киллеры (NK-клетки).
T- и B-лимфоциты умеют распознавать мутантные белки раковых клеток, а γδ-Т-клетки (особая популяция T-лимфоцитов, у которых T-клеточный рецептор состоит из γ и δ субъединиц) и NK-клетки «выслеживают» лиганды своего поверхностного белка NKG2D [3].
Вопрос состоит в том, почему иммунитет не всегда справляется со своей функцией? Почему одни мутировавшие клетки ликвидируются, «не успев пикнуть», а другие успешно выживают и дают начало злокачественным опухолям?
В процессе развития иммунологической толерантности по отношению к опухолевым клеткам участвуют разные механизмы [4], [5]. Они не до конца изучены, и все же в последние десятилетия, во многом благодаря достижениям молекулярной биологии и молекулярной генетики, многое стало известно. Полученные знания легли в основу относительного нового направления в лечении онкологических заболеваний — иммунотерапии. Сегодня многие ученые и врачи-онкологи возлагают на нее большие надежды [6].
Существует несколько направлений современной иммунотерапии [7–9]. Для борьбы с раком используют моноклональные антитела [10], цитокины (интерфероны, интерлейкины), противораковые вакцины, онколитические вирусы, перепрограммированные T-клетки (здесь большие перспективы открывает технология редактирования генов CRISPR-Cas9 [11–14]) и даже микобактерии туберкулеза [15–17].
Контрольные точки и их ингибиторы
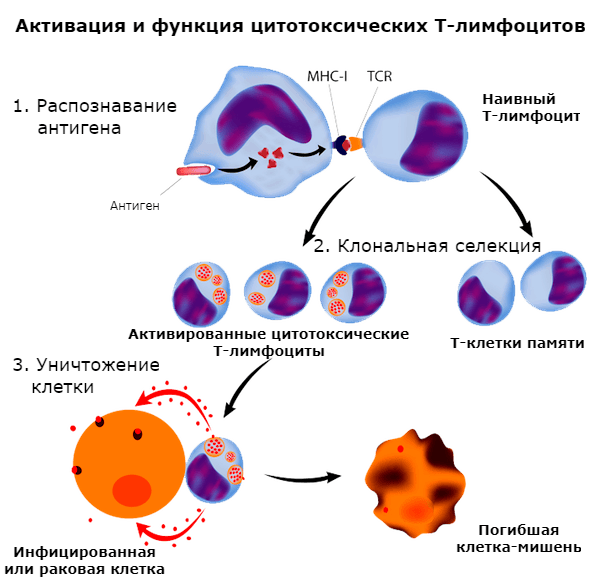
Важную роль в противоопухолевом иммунитете играет клеточно-опосредованный иммунный ответ. Опухолевые клетки производят антигены, которые могут быть переработаны и представлены примитивным (наивным) T-лимфоцитам антигенпредставляющими клетками (APC) в виде соединений с молекулами главного комплекса гистосовместимости (MHC). В результате наивный T-лимфоцит превращается в эффекторный и запускает цепочку событий, которая в конечном счете приводит к уничтожению опухолевой клетки (рис. 1) [6], [18].
Рисунок 1. Активация T-лимфоцита с участием MHC-I. Наибольшее значение в качестве антигенпрезентирующих клеток имеют специализированные именно на этом дендритные клетки (но также эту функцию могут выполнять и макрофаги и B-клетки). После представления опухолевого антигена наивный T-лимфоцит трансформируется в цитотоксический CD8+ и вызывает гибель опухолевой клетки за счет продукции перфоринов, фрагментинов и индукции апоптоза через Fas-лиганды.
Некоторые опухолевые клетки защищаются от иммунной агрессии еще на стадии этого первичного иммунного ответа. Так, мутационные изменения структуры человеческих лейкоцитарных антигенов (молекул на поверхности клеток, которые извлекают из цитоплазмы куски неправильных или чужеродных, например, вирусных, белков и привлекают ими к себе Т-киллеров) приводят к нарушению их функций и мешает процессу активации иммунных клеток [6], [19].
Помимо механизма распознавания и представления антигенов с участием MHC, в противоопухолевом клеточно-опосредованном иммунном ответе важную роль играют дополнительные мембранные корецепторы. Они обеспечивают положительную и отрицательную модуляции иммунного ответа. В онкологических процессах особое значение имеют два таких корецептора: цитотоксический T-лимфоцитарный антиген-4 (CTLA-4, также известный как CD152) и мембранный белок PD-1 (а также его лиганд PD-L1, или CD274). [6]
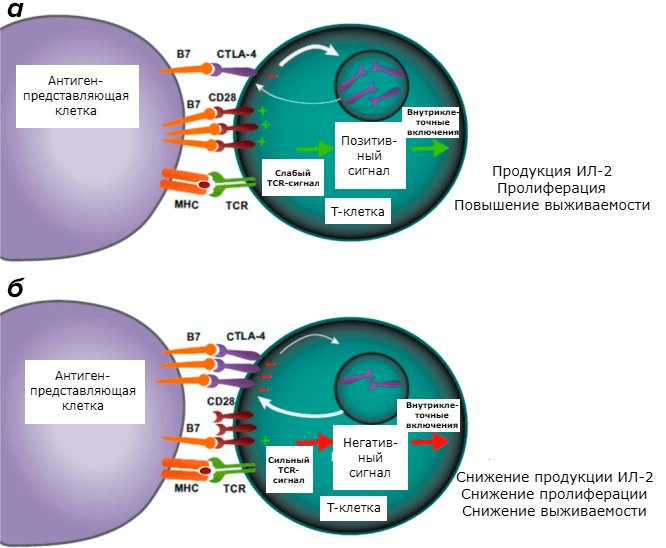
CTLA-4 — белок, который в основном экспрессируют CD4+ и CD8+ T-лимфоциты (но также его экспрессия обнаружена и в B-лимфоцитах). В экспериментах in vitro и in vivo доказано его ингибирующее воздействие на первичный иммунный ответ [20]. Для начала пролиферации T-лимфоцитов необходимо, чтобы молекула B7-1 (CD80) или B7-2 (CD86) на поверхности APC связалась с CD28 на Т-клетке. При этом происходит передача сигнала. CTLA-4 — гомолог CD28, обладающий более высокой афинностью по отношению к B7. Однако при связывании CTLA-4 с B7 передачи сигнала не происходит. От соотношения количества связей CD28:B7 и CTLA-4:B7 зависит, будет ли T-клетка находиться в состоянии активации или анергии (рис. 2). Кроме того, CTLA-4, по-видимому, оказывает прямое ингибирующее влияние на иммунный синапс TCR, ингибирует CD28 и его сигнальный путь, а также повышает подвижность T-клеток, что снижает их способность к взаимодействию с APC [21].
Рисунок 2. CTLA-4-опосредованное ингибирование T-клеток. а — Благодаря связыванию MHC:TCR и CD28:B7 T-лимфоциты продуцируют интерлейкин-2 (ИЛ-2), активируется их пролиферация, повышается выживаемость. б — CTLA-4 конкурирует с CD28 за связывание с B7. Клетка получает негативный сигнал, снижается продукция ИЛ-2, ингибируется пролиферация Т-лимфоцитов и их выживаемость.
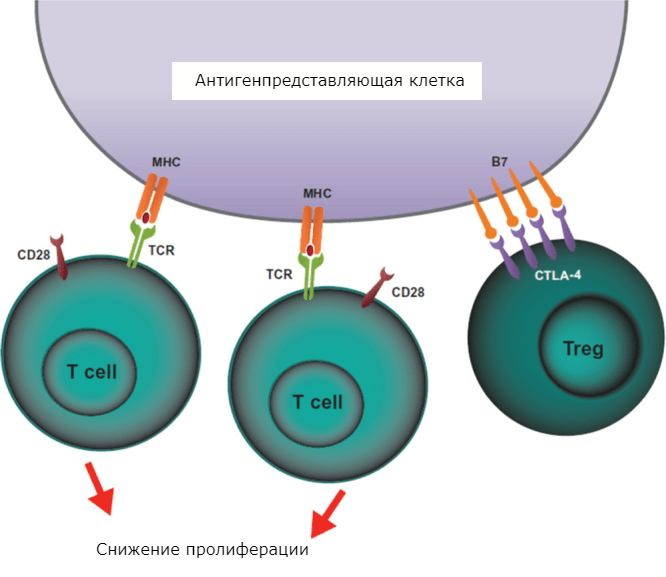
В норме в иммунной системе работает обратная связь. Поначалу молекулы CTLA-4 находятся в везикулах внутри клетки в неактивном состоянии. Сигналом к выходу на поверхность служит возникновение связей MHC:TCR и CD28:B7. Кроме того, CTLA-4 содержатся на поверхности регуляторных Т-клеток (Tregs) (рис. 3) [21].
Рисунок 3. CTLA-4-опосредованное ингибирование T-клеток с участием Tregs. Согласно гипотезе, CTLA-4 на поверхности Tregs вступают в связь с B7 на поверхности APC. В итоге CD28 на поверхности T-лимфоцитов не могут вступить в связь с B7, что нарушает активацию клеток.
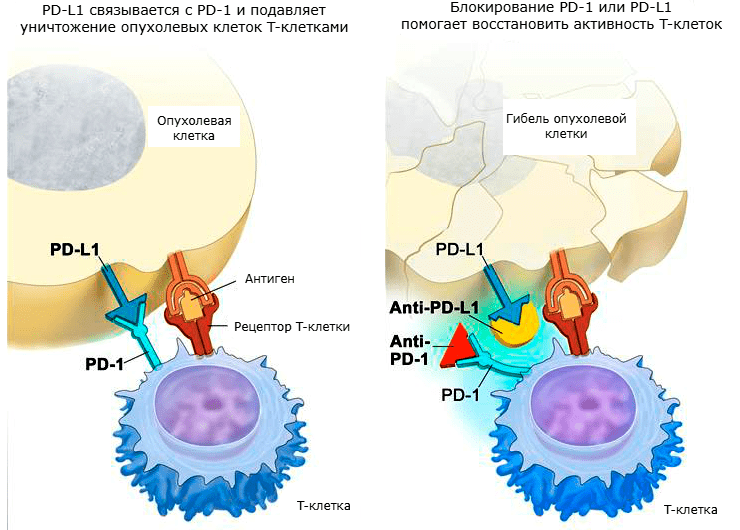
PD-1 представляет собой мембранный белок семейства костимуляторных рецепторов B7/CD28. Он имеет два лиганда: PD-L1 и PD-L2 (лиганды запрограммированной смерти 1 и 2), которые находятся на поверхности антигенпредставляющих клеток. Как и в случае с CTLA-4, связь PD-1 с лигандом приводит к подавлению пролиферации T-клеток, снижению выживаемости и производства цитокинов. Обычно PD-1 активируется при «истощении» эффекторных T-лимфоцитов, получивших слишком большую стимуляцию, либо при отсутствии поддержки со стороны CD4+ T-лимфоцитов. Как правило, такая ситуация характерна для хронических инфекций и онкологических заболеваний [21].
Контрольные точки важны для сохранения гомеостаза и предотвращения излишней активации иммунных клеток. По сути, они защищают организм от тяжелых аутоиммунных реакций и саморазрушения. Можно немного перефразировать: иммунная система использует контрольные точки для того, чтобы сдерживать себя, не атаковать нормальные, «родные» ткани. Однако при онкологических заболеваниях излишняя толерантность иммунитета начинает мешать.
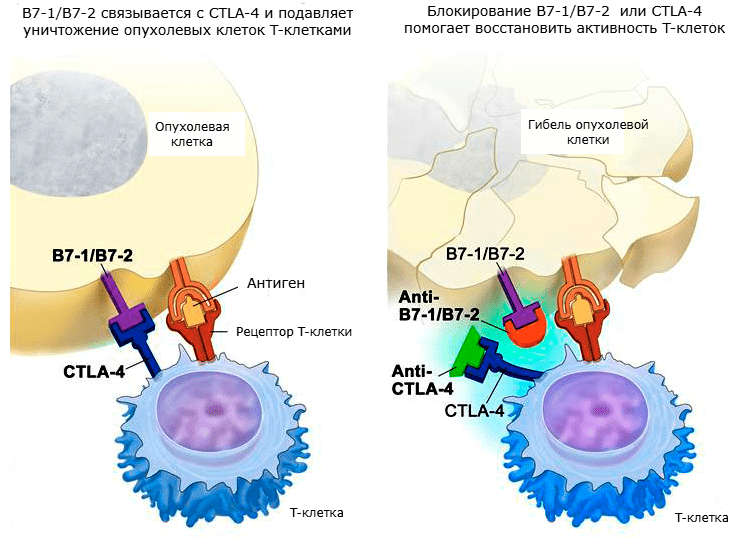
Рисунок 4. Механизм действия ингибиторов CTLA-4 и B7-1/B7-2.
Рисунок 5. Механизм действия ингибиторов PD-1 и PD-L1.
По природе ингибиторы контрольных точек являются человеческими моноклональными антителами. Одновременно их можно отнести к группе таргетных препаратов, так как они прицельно связываются с определенными молекулами-мишенями.
Ингибиторы контрольных точек показали высокую эффективность у многих онкологических пациентов, но не обошлось и без проблем. Главная из них состоит в том, что не все пациенты одинаково хорошо отвечают на лечение.
Полезные бактерии, вредные бактерии
Считается, что резистентность к иммунотерапии при онкологических заболеваниях возникает главным образом из-за слабой инфильтрации опухолевой ткани иммунными клетками и иммуносупрессивных эффектов микроокружения опухоли [23], [24]. На иммунный ответ оказывают влияние в том числе и микроорганизмы, населяющие кишечник [25].
Накоплено немало данных, подтверждающих влияние кишечной микрофлоры на обменные процессы и иммунные реакции. Так, известно, что нарушение взаимодействия между хозяином и микробиотой связано с такими патологиями, как сахарный диабет, цирроз печени, воспалительные заболевания кишечника, колоректальный рак [25], [26].
Состав кишечной микрофлоры влияет на эффективность химиотерапии. Так, циклофосфамид (химиопрепарат из группы алкилирующих агентов) изменяет состав микрофлоры тонкого кишечника, заставляет отдельные грамположительные бактерии мигрировать во вторичные лимфоидные органы и стимулировать пролиферацию «патогенных» T-хелперов (pTh17), которые играют важную роль в развитии аутоиммунных процессов [27]. Это усиливает иммунную реакцию на опухолевую ткань. Когда подопытным животным вводили антибактериальные препараты (в частности, ванкомицин), уничтожающие грамположительных бактерий, реакции, связанные с pTh17, ослабевали, и эффективность циклофосфамида снижалась [28].
У животных, которые получают антибиотики или искусственно лишены кишечной микробиоты, развивается резистентность к препаратам платины: снижается цитотоксичность, образование активных форм кислорода [29]. Состав кишечной микрофлоры оказывает влияние на фармакологические эффекты таких препаратов, как 5-фторурацил, иринотекан, оксалиплатин, гемцитабин, метотрексат [30].
Модуляция ответа на химиопрепараты и иммунопрепараты микробиотой кишечника сводится к одному из трех клинических эффектов:
Представители микрофлоры используют разные механизмы ответа на препараты. Известные на данный момент объединяет аббревиатура TIMER (табл. 1) [30].
| Механизм ответа | Препараты, активирующие механизм | Бактерии, изпользующие механизм | Эффект взаимодействия бактерий с препаратом |
|---|---|---|---|
| Транслокация (Translocation) | Циклофосфамид Доксорубицин | Грамположительные микроорганизмы (Lactobacillus johnsonii, L. murinus, Enterococcus hirae) | Бактерии пересекают кишечный барьер и мигрируют во вторичные лимфоидные органы. |
| Иммуномодуляция (Immunomodulation) | Циклофосфамид | Lactobacillus | Грамположительные бактерии стимулируют иммунный ответ с участием клеток Th17 и Th1. |
| Метотрексат | Неизвестно | Бактерии регулируют повреждение кишечника химиопрепаратом через сигнализацию TLR2 и белок множественной лекарственной устойчивости. | |
| Блокаторы CTLA-4 | Bacteroidales | Подавление активации селезеночных эффекторных CD4+ Т-клеток и опухоль-инфильтрирующих лимфоцитов. | |
| Блокаторы PD-L1 | Bifidobacterium | Стимуляция опухолеспецифических Т-клеток и увеличение количества Т-лимфоцитов в микроокружении опухоли. | |
| Метаболизм (Metabolism) | Иринотекан | Неизвестно | Точная роль бактерий не известна, но лечение стрептомицином ингибирует поглощение иринотекана и снижает активность эпителиальной карбоксилэстеразы. |
| Ипилимумаб | Bacteroidetes | Бактериально опосредованная продукция витамина B и дефицит транспорта полиамина, связанные с повышенным рискоминдуцированного блоком CTLA-4 колита. | |
| Ферментная деградация (Enzymatic degradation) | Гемцитабин | Mycoplasma | Микоплазменные нуклеозидные фосфорилазы ограничивают цитостатическую активность. |
| Иринотекан | β-глюкуронидаза-экспрессирующая кишечная бактерия | Бактериальная β-глюкуронидаза расщепляет глюкуронид неактивного иринотекана (SN-38G), высвобождая активный метаболит (SN-38) в кишечнике. | |
| Сокращение разнообразия и функций экологической сети (Reduced diversity and ecological network function) | Комбинации кармустина, этопозида, цитарабина и мелфалана | Firmicutes Actinobacteria Proteobacteria | Уменьшается количество бактерий, которые подавляют воспаление, и увеличивается число бактерий, которые приводят к колиту. |
| Метотрексат | Анаэробы Стрептококки Bacteroides | Уменьшается разнообразие микроорганизмов, и сдвиги в составе кишечной микробиоты приводят к диарее. |
Свежие данные
Начало 2018 года ознаменовалось сразу тремя научными работами, посвященными влиянию микрофлоры кишечника на эффективность ингибиторов контрольных точек.
Работа Виары Мэтсон с соавторами посвящена метастатической меланоме. Ученые отобрали 42 пациента, страдавших этим заболеванием, и провели анализ их стула тремя различными методами. В дальнейшем бóльшая часть пациентов (38 человек) получала блокаторы PD-1 (ниволумаб, пембролизумаб), а четверо — блокатор CTLA-4 (ипилимумаб) [31].
Оказалось, что в составе кишечной микрофлоры пациентов, которые хорошо отвечали на терапию ингибиторами контрольных точек, было повышено количество восьми видов бактерий: Enterococcus faecium, Collinsella aerofaciens, Bifidobacterium adolescentis, Klebsiella pneumoniae, Veillonella parvula, Parabacteroides merdae, Lactobacillus sp. и Bifidobacterium longum. В кишечной микробиоте испытуемых, не ответивших на терапию, были многочисленны два микроорганизма: Ruminococcus obeum и Roseburia intestinalis.
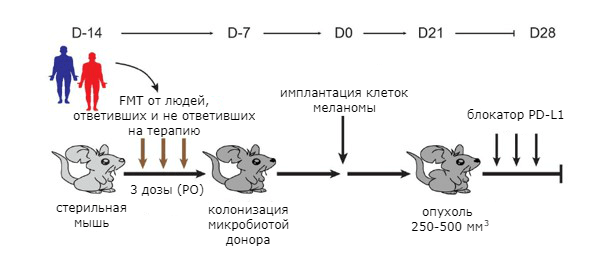
Затем представителей кишечной микрофлоры пациентов с помощью метода трансплантации фекальной микробиоты (fecal microbiota transplantation, FMT) пересадили в кишечник стерильных (безмикробных) мышей [32]. Спустя некоторое время животным имплантировали клетки меланомы. Опухоли в теле мышей, которым пересадили бактерий от людей, ответивших на иммунотерапию, в целом росли медленнее. У них оказались более эффективны блокаторы PD-1 [31], [33].
Ванчесваран Гопалакришнан с коллегами также изучил микрофлору пациентов, страдающих распространенной меланомой, причем, не только в кишечнике, но и в полости рта [34]. Участники исследования получали лечение ингибиторами PD-1. Наилучший ответ наблюдался среди людей, у которых в стуле преобладали микроорганизмы рода Faecalibacterium. Преобладание группы Bacteroidales, напротив, оказалось связано с более низкой активностью препаратов. Ученые не обнаружили корреляции между составом микрофлоры полости рта и ответом пациентов на иммунотерапию.
Затем провели фекотрансплантацию микрофлоры пациентов стерильным мышам, после чего животным имплантировали опухолевые клетки и начали вводить блокаторы PD-1 (рис. 6). У мышей, получивших микробиоту людей, хорошо ответивших на терапию, отмечалось более существенное сокращение роста опухолей. В их стуле также преобладали бактерии рода Faecalibacterium [33], [34].
Рисунок 6. Эксперимент с трансплантацией фекальной микробиоты мышам от пациентов, по-разному ответивших на лечение блокаторами PD-1.
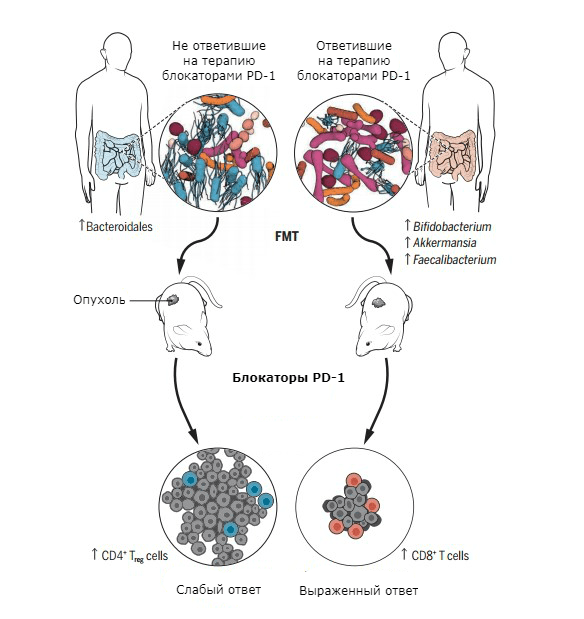
Работа Бертрана Роути с соавторами посвящена взаимосвязи состава кишечной микрофлоры и эффективности блокаторов PD-1 при немелкоклеточном раке легких, карциноме почек и уротелиальной карциноме [35]. Исследователи отметили, что прием антибактериальных препаратов для лечения инфекции во время онкологического заболевания ухудшает ответ на введение ингибиторов контрольных точек. Причем, в стуле у людей, хорошо отвечавших на терапию, авторы обнаружили повышенное количество микроорганизмов Akkermansia muciniphila.
Кишечную микрофлору пациентов при помощи FMT перенесли в кишечник стерильных мышей, затем имплантировали животным опухолевые клетки (рис. 7). Как и в экспериментах Мэтсон и Гопалакришнана, животные, получившие «благополучную» микрофлору, демонстрировали более выраженный ответ на лечение блокаторами PD-1 [33], [35].
Рисунок 7. FMT и имплантация опухолевых клеток в тело лабораторных мышей. Слева — пациент, не ответивший на лечение блокаторами PD-1. Справа — пациент, хорошо ответивший на иммунотерапию.
Проблемы
Авторы всех трех исследований сходятся на том, что кишечная микрофлора — важный фактор, влияющий на эффективность ингибиторов контрольных точек, и с ним однозначно нужно считаться. Тем не менее результаты расходятся: в качестве предикторов названы разные группы микроорганизмов. Возможно, это зависит от типа злокачественной опухоли или индивидуальных особенностей пациентов. Вероятно, в этом загадочном треугольнике — микрофлора—хозяин—иммунопрепарат — существуют общие механизмы и закономерности, но ученым они пока неизвестны. Главная проблема состоит в том, что знания в этой сфере пока немногочисленны и фрагментарны [33].
Перспективы
Есть надежда, что дальнейшее изучение влияния микрофлоры на эффективность противоопухолевых препаратов поможет решить две проблемы:
Эти подходы могут открыть новые возможности для персонализированной терапии онкологических заболеваний.
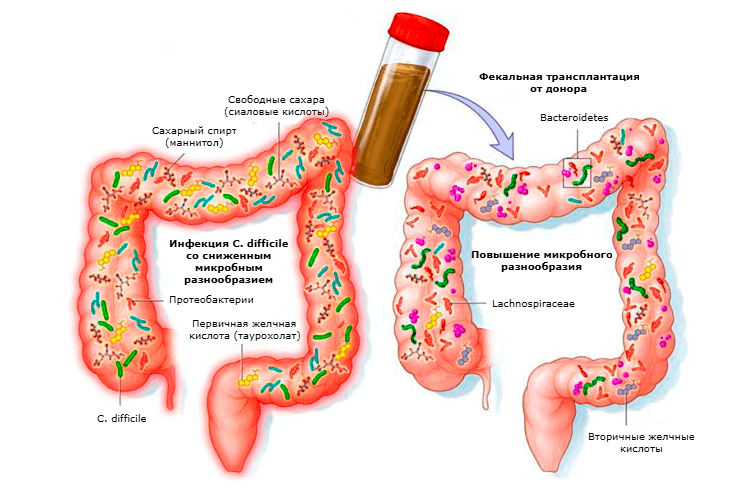
В других сферах медицины с помощью FMT уже достигнуты определенные успехи. В частности, в лечении рецидивирующей инфекции Clostridium difficile (CDI) [32]. Это одна из ведущих причин диареи, вызванной антибактериальными препаратами. В последнее время отмечается тревожный рост заболеваемости в Европе, Америке и Азии. «Трансплантация кала» от здоровых доноров помогла добиться выраженного клинического ответа у 90% пациентов (рис. 8) [36].
Рисунок 8. Схема FMT-терапии при рецидивирующей инфекции Clostridium difficile.
Но FMT — неспецифический метод. Дальнейшее изучение запутанных взаимосвязей в системе «хозяин—микроорганизм» может привести к появлению более «прицельных» подходов к лечению онкологических и других заболеваний. И в этом смысле кишечная микрофлора — самый настоящий «остров сокровищ». Вопрос в том, кому и как скоро удастся раскопать очередной клад [33].