За счет чего передвигаются лейкоциты
Лейкоциты
Лейкоциты, или белые кровяные тельца, представляют собой бесцветные клетки разной величины (от 6 до 20 микрон), округлой или неправильной формы. Эти клетки имеют ядро и способны самостоятельно передвигаться подобно одноклеточному организму — амебе. Количество этих клеток в крови значительно меньше, чем эритроцитов и у здорового человека составляет 4,0-8,8 х 109/л.
Лейкоциты — главный защитный фактор в борьбе организма человека с различными болезнями. Эти клетки «вооружены» специальными ферментами, способными «переваривать» микроорганизмы, связывать и расщеплять чужеродные белковые вещества и продукты распада, образующиеся в организме в процессе жизнедеятельности. Кроме того, некоторые формы лейкоцитов вырабатывают антитела — белковые частицы, поражающие любые чужеродные микроорганизмы, попавшие в кровь, на слизистые оболочки и другие органы и ткани организма человека.
Существуют два основных типа лейкоцитов. В клетках одного типа цитоплазма имеет зернистость, и они получили название зернистых лейкоцитов — гранулоцитов. Различают 3 формы гранулоцитов: нейтрофилы, которые в зависимости от внешнего вида ядра подразделяются на палочкоядерные и сегментоядерные, а также базофилы и эозинофилы.
В клетках других лейкоцитов цитоплазма не содержит гранул, и среди них выделяют две формы — лимфоциты и моноциты. Указанные типы лейкоцитов имеют специфические функции и по-разному изменяются при различных заболеваниях (см. ниже), поэтому их количественный анализ — серьезное подспорье врача при выяснения причин развития различных форм патологии. Увеличение количества лейкоцитов в крови называется лейкоцитозом, а уменьшение — лейкопенией.
Лейкоцитоз бывает физиологическим, т. е. возникает у здоровых людей при некоторых вполне обычных ситуациях, и патологическим, когда он свидетельствует о какой-либо болезни.
Физиологический лейкоцитоз наблюдается в следующих случаях:
По этой причине количество лейкоцитов исследуют утром натощак в спокойном состоянии обследуемого, без предшествующих физических нагрузок, стрессовых ситуаций, водных процедур.
К наиболее частым причинам патологического лейкоцитоза относят следующие:
Необходимо помнить, что у больных с ослабленным иммунитетом (лица старческого возраста, истощенные люди, алкоголики и наркоманы) при указанных процессах лейкоцитоз может и не наблюдаться. Отсутствие лейкоцитоза при инфекционных и воспалительных процессах говорит о слабости иммунитета и является неблагоприятным признаком.
Лейкопения — снижение количества лейкоцитов в крови ниже 4,0 Ч 109/л в большинстве случаев свидетельствует об угнетении образования лейкоцитов в костном мозге. Более редкими механизмами развития лейкопении являются повышенное разрушение лейкоцитов в сосудистом русле и перераспределение лейкоцитов с их задержкой в органах-депо, например, при шоке и коллапсе.
Наиболее часто лейкопения наблюдается вследствие следующих болезней и патологических состояний:
Лейкоцитарная формула — это соотношение в крови различных форм лейкоцитов, выраженное в процентах. Нормативные значения лейкоцитарной формулы представлены в табл. 1.
Таблица 1 Лейкоцитарная формула крови и содержание различных типов лейкоцитов у здоровых людей
Формы лейкоцитов
Содержание лейкоцитов
Абсолютные значения (Ч1 09ул)
Название состояния, при котором выявляется увеличение процентного содержания того или иного вида лейкоцитов, образуется прибавлением окончания «-ия», «-оз» или «-ез» к названию данного вида лейкоцитов (нейтрофилез, моноцитоз, эозинофилия, базофилия, лимфоцитоз).
Снижение процентного содержания различных типов лейкоцитов обозначается прибавлением окончания «пения» к названию данного вида лейкоцитов (нейтропения, моноцитопения, эозинопения, базопения, лимфопения).

По этой причине различают абсолютные и относительные изменения в содержании той или иной формы лейкоцитов. Случаи, когда наблюдается процентное увеличение или снижение различных типов лейкоцитов при нормальном их абсолютном содержании в крови, обозначают как абсолютный нейтрофилез (нейтропению), лимфоцитоз (лимфопению) и т. д.
Различные типы лейкоцитов «специализируются» на разных защитных реакциях организма, в связи с чем анализ изменений лейкоцитарной формулы может очень многое рассказать о характере патологического процесса, развившегося в организме больного человека, и помочь врачу правильно поставить диагноз.
Нейтрофилез, как правило, свидетельствует об остром воспалительном процессе и бывает наиболее выраженным при гнойных заболеваниях. Так как воспаление того или иного органа в медицинских терминах обозначается присоединением окончания «-ит» к латинскому или греческому названию органа, то нейтрофилез появляется при плеврите, менингите, аппендиците, перитоните, панкреатите, холецистите, отите и т. д., а также острой пневмонии, флегмонах и абсцессах различного местоположения, рожистом воспалении.
Кроме того, увеличение количества нейтрофилов в крови выявляется при многих инфекционных болезнях, инфаркте миокарда, инсульте, диабетической коме и тяжелой почечной недостаточности, после кровотечений.
Следует помнить, что нейтрофилез может вызывать прием глюкокортикоидных гормональных препаратов (дексаметазон, преднизолон, триамцинолон, кортизон и др.).
Более всего на острое воспаление и гнойный процесс реагируют палочкоядерные лейкоциты. Состояние, при котором увеличивается количество в крови лейкоцитов этого типа, называют палочкоядерным сдвигом, или сдвигом лейкоцитарной формулы влево. Палочкоядерный сдвиг всегда сопровождает выраженные острые воспалительные (особенно нагноительные) процессы.
Нейтропения отмечается при некоторых инфекционных (брюшной тиф, малярия) и вирусных заболеваниях (грипп, полиомиелит, вирусный гепатит А). Низкий уровень нейтрофилов часто сопровождает тяжелое течение воспалительных и гнойных процессов (например, при остром или хроническом сепсисе — тяжелом заболевании, когда патогенные микроорганизмы попадают в кровь и беспрепятственно расселяются во внутренних органах и тканях, образуя многочисленные гнойные очаги) и является признаком, ухудшающим прогноз тяжелых больных.
Нейтропения может развиваться при подавлении функции костного мозга (апластические и гипопластические процессы), при В12-дефицитной анемии, облучении ионизирующей радиацией, в результате целого ряда интоксикаций, в том числе при приеме таких препаратов, как амидопирин, анальгин, бутадион, реопирин, сульфодиметоксин, бисептол, левомицетин, цефазолин, глибенкламид, мерказолил, цитостатики и др.
Если вы обратили внимание, то факторы, приводящие к развитию лейкопении, одновременно снижают и количество нейтрофилов в крови.
Лимфоцитоз характерен для ряда инфекций: бруцеллеза, брюшного и возвратного эндемического тифа, туберкулеза.
У больных туберкулезом лимфоцитоз является положительным признаком и свидетельствует о благоприятном течении болезни и последующем выздоровлении, а лимфопения — ухудшает прогноз у этой категории больных.
Кроме того, увеличение количества лимфоцитов часто выявляется у больных со сниженной функцией щитовидной железы — гипотиреозом, при подостром тиреоидите, хронической лучевой болезни, бронхиальной астме, В12-дефицитной анемии, при голодании. Описано увеличение количества лимфоцитов при приеме некоторых наркотиков.
Лимфопения указывает на иммунодефицит и наиболее часто выявляется у лиц с тяжело и длительно 
Моноцитоз является наиболее характерным признаком инфекционного мононуклеоза, а также может встречаться при некоторых вирусных заболеваниях — инфекционном паротите, краснухе. Повышение количества моноцитов в крови является одним из лабораторных признаков тяжело протекающих инфекционных процессов — сепсиса, туберкулеза, подострого эндокардита, некоторых форм лейкозов (острый моноцитарный лейкоз), а также злокачественных заболеваний лимфатической системы — лимфогранулематоза, лимфомы.
Моноцитопения выявляется при поражении костного мозга — апластической анемии и волосатоклеточном лейкозе.
Эозинофилия наиболее часто встречается при различных аллергических заболеваниях и синдромах (бронхиальная астма, отек Квинке, крапивница и др.), при паразитарных заболеваниях (описторхоз, аскаридоз, лямблиоз, трихинеллез и др.), некоторых кожных болезнях (псориаз, экзема), коллагенозах (ревматизм, лерматомиозит, системная красная волчанка), некоторых тяжелых заболеваниях крови (хронический миелолейкоз, лимфогранулематоз), ряде инфекционных заболеваний (скарлатина, сифилис, туберкулез), при применении некоторых лекарственных препаратов ( антибиотики, сульфаниламиды и др.), описаны также наследственные формы эозинофилии.
Эозинопения может наблюдаться на высоте развития инфекционных заболеваний, В12-дефицитной анемии и поражении костного мозга со снижением его функции (апластические процессы).
Базофилия обычно выявляется при хроническом миелолейкозе, понижении функции щитовидной железы (гипотиреозе), а также описано физиологическое повышение базофилов в предменструальном периоде у женщин.
Базопения развивается при повышении функции щитовидной железы (тиреотоксикоз), беременности, стрессовых воздействиях, синдроме Иценко-Кушинга — заболевании гипофиза или надпочечников, при котором в крови повышен уровень гормонов коры надпочечников — глюкокортикоидов.
За счет чего передвигаются лейкоциты
Лейкоциты. Общая характеристика элементов белой крови
Лейкоциты (греческое leukos – белый, kytos – вместилище) – одна из трех разновидностей форменных элементов крови позвоночных животных и человека.
Представление о лейкоцитах сформировалось более 100 лет назад одновременно с возникновением учения о крови и кроветворении, получило развитие в трудах Р. Вирхова (1955), И.И. Мечникова (1883), А.А. Максимова (1902), А.А. Заварзина (1945) и других отечественных и зарубежных исследователей.
Лейкоциты, в отличие от эритроцитов, это ядросодержащие клетки, структурная организация которых идентична другим клеткам нашего организма. Лейкоцитарная клетка ограничена цитоплазматической мембраной, в цитоплазме содержатся митохондрии, лизосомы с набором гидролитических ферментов и биологическиактивных соединений, имеется аппарат Гольджи, система эндоплазматического ретикулума, белоксинтезирующая система, представленная рибосомами и полирибосомами, и другие органоиды. Размеры лейкоцитов варьируют от 4 до 20 мкм. Продолжительность жизни также весьма вариабельна и составляет от 4–5 дней до 20 дней для элементов гранулоцито-моноцитарного ряда, а для лимфоцитов 100–200 дней. Количество лейкоцитов в периферической крови здорового взрослого человека колеблется от 4×10 9 /л до 9×10 9 /л.
Количество лейкоцитов у новорожденных уже в течение первых суток достигает 10×10 9 /л – 30×10 9 /л, а затем несколько уменьшается и со второй недели жизни составляет в среднем 10×10 9 /л – 12×10 9 /л. Однако следует отметить, что согласно данным многочисленных авторов содержание лейкоцитов в периферической крови в течение первых лет жизни, а по некоторым данным и до 10–15 лет, может быть значительно выше аналогичного показателя крови здорового взрослого человека (таблица).
Прежде чем остановиться на морфофункциональных особенностях отдельных видов лейкоцитов, необходимо рассмотреть гистогенез элементов белой крови в костном мозге, поскольку именно четкие представления о гистогенезе позволят не только хорошо усвоить вопросы физиологии белой крови, но и современные принципы классификации лейкозов, их гематологическую характеристику.
Как известно, лейкоциты позвоночных животных и человека образуются в специальных кроветворных органах: в период эмбрионального развития такими органами являются желточный мешок, печень, селезенка и костный мозг. Во взрослом организме лейкоциты образуются в костном мозге, а лимфоциты, кроме того, в селезенке, вилочковой железе и лимфатических узлах.
В костном мозге имеется две неравнозначные группы клеток: клетки ретикулярной стромы и клетки кроветворной ткани костного мозга с их производными – зрелыми клетками крови. К клеточным элементам ретиулярной стромы относят фибробласты, остеобласты, жировые клетки, эндотелиальные клетки. Указанные клетки объединяют собирательным названием «ретикулярные клетки».
Возрастная динамика количества лейкоцитов и лейкоцитарной формулы у детей
В настоящее время четко определена гистогенетическая независимость системы кроветворной стромы и кроветворных клеток. Ретикулярные клетки имеют самостоятельные стволовые клетки, способные дифференцироваться во все клеточные элементы.
Классификация лейкоцитов. Морфологические и функциональные особенности отдельных видов лейкоцитов
Существующая в настоящее время классификация лейкоцитарных элементов является морфофункциональной и отражает уровень современных знаний по физиологии лейкоцитов.
Все морфологически идентифицируемые лейкоцитарные элементы можно разделить на две группы с учетом одной из основных функциональных характеристик клеток – способности к делению. Так, различают две подгруппы клеток – пролиферирующих и утративших способность к пролиферации (сюда входят и лейкоциты, покинувшие органы кроветворения – циркулирующие в крови и перешедшие в ткани). Циркулирующие в кровотоке лейкоциты подразделяютя на два функциональных пула: а) свободно циркулирующие в крови, б) клетки, занимающие краевое положение в сосудах и не участвующие в циркуляции, – секвестрированные, или депонированные, лейкоциты.
С учетом морфологических особенностей (наличие зернистости и гранул) все лейкоцитарные элементы делятся на две большие группы: гранулоциты и агранулоциты.
Свойства лейкоцитов
1. Все виды лейкоцитов в большей или меньшей степени обладают способностью к амебовидному движению, что обеспечивает миграцию лейкоцитов в ткани через сосудистую стенку. Этот процесс называется диапедезом. Он определяет защитную функцию лейкоитов. 50 % лейкоцитов за пределами сосудистого русла находятся в межклеточном пространстве, а 30 % – в костном мозге.
2. Лейкоциты обладают положительным хемотаксисом по отношению к бактериальным токсинам, продуктам распада бактерий и дегенерирующим клеткам организма, комплексам антиген – антитело.
3. Одним из важных свойств лейкоцитов является способность к фагоцитозу и пиноциозу.
4. Лейкоциты обеспечивают механизмы резистентности за счет лизосомальных ферментов, в частности протеаз, пептидаз, диастазы, дезоксирибонуклеазы, липаз, поступающих в окружающие ткани при жировой дегенерации лейкоцитов. Бактерицидные свойства лейкоцитов обеспечиваются и освобождением лизоцима, катионных белков, лактоферрина, активных форм кислорода.
5. Лейкоциты являются регуляторами коагуляционного потенциала крови. Это свойство лейкоцитов обусловлено содержанием в них активаторов и проактиваторов плазминогена, а также наличием в лизосомах фибринолитическиактивных протеаз, которые могут расщеплять фибрин без участия плазминогена. Вышеуказанные факторы обеспечивают создание альтернативного механизма фибринолиза наряду с плазминовой фибринолитической системой, что играет важную роль в деблокировании сосудистого русла при ДВС-синдроме.
6. Лейкоциты участвуют в развитии синдрома системного воспалительного ответа, лихорадки, регуляции лейкопоэза за счет образования цитокинов с дистантным действием.
7. Лейкоциты обеспечивают индукцию и развитие специфических иммунологических механизмов защиты, а также аллергических реакций гуморального и клеточного типов.
Гемопоэз и его регуляция
Кровь является исключительнореактогенной системой, характеризующейся разнообразными изменениями клеточного состава, а также растворимых компонентов в ответ на действие патогенных факторов.
Система крови представляет собой производное мезенхимы и включает следующие основные компоненты: кровь и лимфу, органы кроветворения и иммунопоэза, а также клетки крови, эмигрирующие в соединительную ткань, и эпителиальные ткани. Естественно, чрезвычайно важная роль в регуляции гомеостаза периферической крови отводится органам кроветворения, в частности костному мозгу, где в условиях нормы имеют место сохранение динамического равновесия между процессами гемопоэза и распада клеток, а также определенная стадийность дифференцировки элементов миелоидного, лимфоидного, эритроцитарного и мегакариоцитарного рядов.
В процессе раннего эмбрионального периода жизни (около 2-х недель очаги системы гемостаза формируются в желточном мешке, где пролифирируют и дифференцируются участки мезенхимы, мезодермальных клеток).
Основными местами гемопоэза, начиная с 11-й недели гестации и прежде всего второго триместра, являются печень и селезенка. Гемопоэз смещается из печени и селезенки в мозговые полости костей лишь с 3-го триместра гестации и остается в этих структурах к моменту рождения ребенка. В течение юности и зрелого возраста места гемопоэза постепенно смещаются из трубчатых костей скелета в плоские кости (череп, позвонки, грудина, ребра, таз), которые становятся основными местами гемопоэза у взрослых людей.
Основные гемопоэтические факторы роста включают группы гормонов и цитокинов, продуцируемых в значительной мере стромальными клетками микроокружения.
В последние годы достигнуты определенные успехи в унификации представлений о характере и механизмах процессов гемопоэза в костном мозге, роли цитокинов в гистогенезе элементов крови.
Ежедневно у человека обновляется около 100 млрд форменных элементов периферической крови. В гемопоэтической ткани костного мозга гранулоциты и их предшественники составляют около 60 %, эритроидные предшественники – 20 %, лимфо- и моноциты – около 10 %, а недифференцированные и разрушающиеся клетки – также около 10 %.
Согласно унитарной теории кроветворения, сформулированной А.А. Максимовым, источником всех линий кроветворения в костном мозге являются «родоначальные клетки». Длительное время не существовало единой терминологии для их обозначения. В настоящее время используют термин «плюрипотентные стволовые клетки» (ППСК), трансформирующиеся в костном мозге в мультипотентные стволовые клетки.
Современная схема гемопоэза была разработана А.И. Воробьевым совместно с И.Л. Чертковым (1973), которая в основном используется в настоящее время с различными дополнениями и модификациями.
Кроветворная ткань является динамичной, постоянно обновляющейся системой, в связи с этим знание кинетики гемопоэза необходимо для понимания патогенеза заболеваний различной этиологии. Гемопоэтические клетки отличаются большим разнообразием структуры и функции, обеспечивающим в процессе их созревания самые различные биологические процессы, такие, как транспорт О2, гемостаз, фагоцитоз, иммунитет.
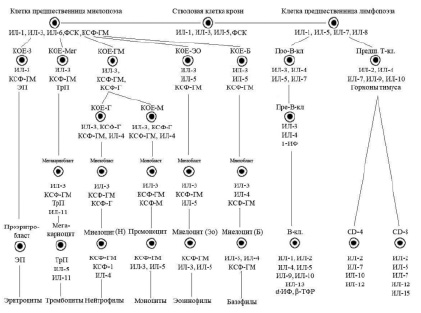
В настоящее время очевидно наличие шести классов дифференцировки клеток периферической крови (схема), причем первые два класса клеток включают плюрипотентные и мультипотентные клетки костного мозга, морфологически не распознаваемые элементы. К III классу относят коммитированные унипотентные клетки-предшественницы, к IV классу относятся бласты – ядросодержащие клетки эритроцитарного, лимфоидного, миелоидного и мегакариоцитарного рядов, V класс – это созревающие клетки. Часть клеток миелоидного ряда (юные и палочкоядерные) уже содержатся в периферической крови, а VI класс – это зрелые клетки крови и костного мозга.
Касаясь более детальной характеристики гемопоэтических клеток костного мозга, следует отметить, что ППСК, являющиеся источником образования клеток крови, составляют 0,01 % от всех ядросодержащих клеток костного мозга. Однако этого количества достаточно для восстановления гемопоэза в случаях аплазии и гипоплазии костного мозга. Ранее считалось, что клетки крови происходят из гемоцитобласта – производного гемогистиобласта.
ППСК – морфологически не распознаваемая клетка, условно относится к I классу кроветворения, маркерной молекулой этих клеток является CD34, экспрессируемая и эндотелиоцитами сосудов. ППСК относится к категории самоподдерживающихся клеток, способных к митотическому делению до 100 раз в течение своей жизни. Всего у человека примерно 4–400×105 стволовых клеток крови, некоторые из них выходят из костного мозга и обнаруживаются в крови.
Упрощенная схема регуляции кроветворения (Алмазов В.А., 1999): ФСК – фактор стволовой клетки, КОЕ – колониеобразующая единица, ИЛ – интелейкин, КСФ – колониестимулирующий фактор, ИФ – интерферон, ТФР – трансформирующий фактор роста, ЭП – эритропоэтин, ТрП – тромбопоэтин
Миграция стволовых клеток усиливается при нарушениях гомеостаза, в частности при гипоксиях, радиации, химиотерапии и других стрессорных воздествиях, находится под контролем хемокина CXCL-12, синтезируемого остеокластами, эндотелиальными клетками, клетками стромы. Регуляторами миграции стволовых клеток являются также КСФ-Г и ИЛ-1. Стволовые клетки в покоящемся состоянии выполняют две основные функции: 1) самоподдержание за счет низкого уровня пролиферативной активности; 2) дифференцировку в сторону образования коммитированных предшественников.
Дальнейшая дифференцировка ППСК обеспечивается различными специфическими и неспецифическими механизмами. Различают локальные и длиннодистантные механизмы регуляции. Локальные механизмы регуляции обеспечиваются за счет тканевого, микрососудистого, нервного компонентов и распространяются преимущественно на I и II классы клеток кроветворения в костном мозге. Тканевый компонент регуляции гемопоэза включает межклеточное взаимодействие, а также продукцию клетками соединительной ткани, моноцитарно-макрофагальной, мегакариоцитарной линий, эндотелием различных цитокинов с ростстимулирующим действием. Микрососудистый и нервный компоненты обеспечивают соответственно оксигенацию и трофику стромы и паренхиматозных элементов, а также выход в кровоток форменных элементов.
Начиная с коммитированных клеток костного мозга, в регуляции гемопоэза доминируют длиннодистантные механизмы, обеспечиваемые различными цитокинами, системой «кейлоны – антикейлоны», гормонами.
Касаясь динамики гемопоэза в костном мозге, следует отметить, что вслед за классом ППСК возникает образование мультипотентной полустволовой клетки, или клетки – предшественницы лимфопоэза, под влиянием фактора стволовой клетки (ФСК), ИЛ-1, ИЛ-6. Параллельно происходит образование из полипотентной стволовой клетки мультипотентной полустволовой клетки – предшественницы миелопоэза под влиянием ряда цитокинов: ФСК, ИЛ-1, ИЛ-3, ИЛ-6, КСФ-Г.
Третьим классом недифференцированных клеток гемопоэза костного мозга являются коммитированные, или унипотентные, клетки. Для лимфоидного ряда – это про-Т- и про-В-лимфоциты, а для миелоидного ряда – это колониеобразующие клетки эозинофильного и базофильного рядов (КОЕ-Эо, КОЕ-Б), нейтрофильного ряда (КОЕ-Г), моноцитарного ряда (КОЕ-М), а также эритроцитарного (КОЕ-Э) и мегакариоцитарного (КОЕ-Мег) рядов.
Гемопоэтические клетки III класса – короткоживущие, интенсивно пролиферирующие, идентифицируемые клетки. Регуляторами их пролиферации и дифференцировки являются цитокины и «специфические» гемопоэтины.
Последними пролиферирующими клетками гемопоэтического ряда являются клетки IV класса – бласты – морфологически и гистохимически распознаваемые элементы (миелобласты, лимфобласты, монобласты, эритробласты). V класс дифференцировки включает созревающие клеточные элементы (для миелоидного ряда это промиелоцит, миелоцит, метамиелоцит, палочкоядерные лейкоциты; для лимфоидного ряда – пре- и про-В- и Т-лимфоциты, протоплазмоциты; для эритроцитарного ряда – пронормоцит, базофильный, полихроматофильный, оксифильный нормоцит, ретикулоцит.
VI класс включает в себя зрелые клетки костного мозга и периферической крови.
Касаясь кинетики гемопоэза, следует отметить, что для делящихся клеток-предшественниц митотический цикл, помимо митоза, включает фазу G1, во время которой происходит подготовка гемопоэтических клеток к синтезу ДНК, а далее S-фазу, характеризующуюся удвоением количества ДНК, и фазу G2, включающую период подготовки к митотическому делению. Продолжительность митотического цикла для морфологическинераспознаваемых клеток-предшественников составляет в среднем около 20 часов.
Относительно регуляции гемопоэза необходимо отметить по крайней мере два его варианта – конститутивный и индуцированный гемопоэз. Конститутивный гемопоэз регулируется цитокинами и межклеточным взаимодействием, а осуществляется в особых зонах скопления стволовых клеток. Часть стволовых клеток, медленно размножаясь, мигрирует в другие зоны костного мозга, где и дифференцируется.
Индуцированный гемопоэз возможен при нарушениях гомеостаза при различных стрессорных воздействиях (гипоксия, интоксикация, ионизирующая радиация) и регулируется в основном КСФ-Г, ИЛ-1, ФСК.
Согласно данным литературы, важнейшими стимуляторами пролиферации и дифференцировки клеток гранулоцитарного и моноцитарного рядов оказываются колониестимулирующие факторы (КСФ). Последние являются пептидами, продуцируемыми у человека моноцитарно-макрофагальными клетками крови различных тканей, в частности костного мозга, а также лимфоцитами, эндотелиальными клетками, фибробластами, тучными клетками на фоне антигенной стимуляции. Наиболее изучены мульти-КСФ (ИЛ-3), гранулоцитарно-макрофагальный КСФ (КСФ-ГМ), макрофагальный КСФ (КСФ-М), гранулоцитарный КСФ (КСФ-Г). Усиление лейкопоэза возникает под влиянием провоспалительных цитокинов: ИЛ-1, ИЛ-6, ИЛ-8, а также под влиянием ряда медиаторов воспаления, в частности лейкотриенов В4, С4, ФСК, вырабатываемого клетками микроокружения стволовых клеток. Универсальными стимуляторами гранулоцитарно-моноцитарного лейкопоэза являются гормоны адаптации: катехоламины, глюкокортикоиды, реализующие свои эффекты на костный мозг через усиление образования КСФ и интерлейкинов. К числу стимуляторов лейкопоэза относятся витамин В12, аскорбиновая кислота, фолиевая кислота, железо. Подавление костно-мозгового кроветворения возможно под влиянием ряда медиаторов воспаления, таких, как простагландины Е1, Е2, ИЛ-10, ИЛ-13, ФНО-α, трансформирующий фактор роста бета (ТФР-β), а также лактоферрина и кислого изоферритина.
Регуляция пролиферации и дифференцировки лимфоцитов находится под влиянием цитокинов, интенсивно образующихся на фоне воздействия различных антигенов инфекционной и неинфекционной природы лимфоцитами и моноцитами, в частности ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-7, бластогенного и митогенного факторов. Классическими ингибиторами лимфопоэза являются гормоны адаптации: АКТГ, глюкокортикоиды, индуцирующие развитие реакции апоптоза и цитолиза в лимфоидной ткани.
В настоящее время очевидна определяющая роль цитокинов в регуляции костно-мозгового кроветворения, в частности ФСК, КСФ-Г, КСФ-М, КСФ-ГМ, а также ИЛ-3 или мульти-КСФ, регулирующих дифференцировку и созревание практически всех ростков кроветворения. К настоящему моменту для многих цитокинов определены структура и биологические свойства.
Далее приведены особенности биологических эффектов некоторых из указанных цитокинов, влияющих на процессы роста и дифференцировки гемопоэтических клеток костного мозга.
Фактор стволовых клеток (ФСК). ФСК – ростовой фактор для гемопоэтических стволовых клеток, образование которого детерминируется геном 12-й хромосомы (q22-q24). Биологическая активность ФСК проявляется в виде растворимой и мембранно-связанной форм. Трансмембранный белок состоит из 273 аминокислотных остатков, растворимая форма представлена нековалентно-связанным димером.
Рецептор ФСК, c-kit, обозначается как CD117, его связывание с ФСК приводит через ряд промежуточных реакций к активации протеинкиназы С и yak2/STAT пути клеточной активации [20]. ФСК интенсивно синтезируется в разных тканях плода, а в постнатальном периоде в фибробластах, эндотелиоцитах, недифференцированных стромальных клетках.
В организме человека ФСК оказывает интенсивное стимулирующее влияние на тучные клетки, пролиферацию предшественников Т- и В-лимфоцитов, интраэпителиальных γδ-лимфоцитов.
ФСК стимулирует CD34+ стволовые клетки человека и в сочетании с ИЛ-3, КСФ-Г, КСФ-ГМ усиливает формирование гранулоцитарно-макрофогальных и эритроцитарных колоний, предшественников тучных клеток.
Fit-3-лиганд. Другим стимулятором гемопоэза в костном мозге является Fit-3-лиганд, взаимодействующий с тирозинкиназными рецепторами. Подобно ФСК и КСФ-М, Fit-3-лиганд продуцируется стромальными клетками, клетками эндотелия и Т-лимфоцитами, а его рецептор экспрессируется на ранних гемопоэтических клетках – предшественницах миеломоноцитарного ряда и на пре-В-лимфоцитах.
Эффекты fit-3-лиганда на костно-мозговые клетки усиливаются цитокинами ИЛ-3 и КСФ-ГМ. Комбинация ФСК и Fit-3-лиганда значительно усиливает пролиферацию костно-мозговых стволовых клеток. Рекомбинантный fit-3-лиганд стимулирует пролиферацию CD34+ стволовых клеток костного мозга человека, а также ранних гемопоэтических клеток-предшественниц. Однако его эффекты слабее, чем у ФСК-ГМ.
Гранулоцитарный колониестимулирующий фактор (КСФ-Г). Образование КСФ-Г детерминируется геном хромосомы 17 у человека (С17, q11-q21). Зрелый цитокин имеет глобулярную структуру с ММ 18,6 кДа, синтезируется моноцитами, фибробластами, эндотелием, стромальными клетками, а далее поступает в системный кровоток и в костный мозг. Рецепторы цитокина экспрессируются на клетках миеломоноцитарного ростка кроветворения от миелобластов до зрелых гранулоцитов, а также на некоторых клетках моноцитарного ростка. Продукция КСФ-Г стимулируется вовлечением провоспалительных цитокинов ИЛ-1, ФНО, бактериальных эндотоксинов. Биологическое действие КСФ-Г связано с ускорением пролиферации и созревания ранних предшественников гранулоцитов, усилением фагоцитарной активности нейтрофилов, их кислородзависимого киллинга и антителонезависимой цитотоксичности, продукцией зрелыми нейтрофилами ИЛ-8 и активацией хемотаксиса под влиянием ИЛ-8.
КСФ-Г после стимулирующего влияния на гемопоэз в условиях воспаления, инфекции, оказывает активирующее влияние на продукцию ИЛ-4, ИЛ-10, стимулирует Th2, усиливает гуморальное звено иммунитета, обеспечивает антибактериальную защиту организма.
Макрофагальный колониестимулирующий фактор (КСФ-М). Макрофагальный колониестимулирующий фактор КСФ-М продуцируется стромальными клетками костного мозга, фибробластами, моноцитами, макрофагами, гепатоцитами, эндотелием, гладкомышечными клетками. КСФ-М кодируется геном, расположенным на коротком плече первой хромосомы в зоне р13-р21, а также на 5-й хромосоме(CD q33). Мономер КСФ-М состоит из 256 аминокислот, существует в виде растворимой и мембранно-связанной формы. КСФ-М увеличивает экспрессию антигенов МНС II на макрофагах, усиливает их цитотоксичность.
Рецепторы M-CSF относятся к семейству рецепторов ростовых факторов, кодируются протоонкогеном c-fmg, экспрессируются на всех клетках моноцитарного ряда, гладкомышечных клетках и на трофобласте.
Ген КСФ-М во многих клетках экспрессируется конститутивно, усиление синтеза цитокина возникает под влиянием ИЛ-10, ФНО-α, КСФ-ГМ, прогестероном, ИЛ-4.
КСФ-М стимулирует пролиферацию, дифференцировку клеток – предшественниц моноцитарного ряда, вызывает развитие моноцитоза, тромбоцитопении, иногда нейтропении, повышает противоопухолевую антителозависимую цитотоксичность моноцитов и антибактериальную активность клеток моноцитарно-макрофагального ряда.
Гранулоцитарно-макрофагальный колониестимулирующий фактор (КСФ-ГМ). КСФ-ГМ – ростовой фактор, он синтезируется в условиях нормы в незначительных количествах, а при воспалении различного генеза интенсивность синтеза возрастает под влиянием бактериальных эндотоксинов, провоспалительных цитокинов.
Зрелый КСФ-ГМ имеет ММ 14,5 кДа, состоит из 127 аминокислотных остатков. Интенсивное гликозилирование КСФ-ГМ в процессе синтеза приводит к увеличению его ММ и синтетической биологической активности.
Рецепторы КСФ-ГМ обладают высокой аффинностью связывания лиганда.
После связывания КСФ-ГМ с рецепторами активируется МАР-киназа, Scr-киназа и фосфатидилинозитол-3-зависимая киназа, киназа Jak-2.
Биологическая активность КСФ-ГМ направлена на стимуляцию и дифференцировку миеломоноцитарных предшественников гемопоэза, колоний мегакариоцитов, а также на усиление функциональной активности нейтрофилов, эозинофилов, моноцитов за счет стимуляции хемотаксиса, адгезии, продукции активных форм кислорода.
КСФ-ГМ вызвает усиление антигенпрезентирующей функции моноцитов, цитотоксичности моноцитов в отношении опухолевых клеток.