увеличен надпочечник что делать
Образования надпочечников: тактика ведения
Частота выявления новообразований надпочечников постоянно возрастает, их распространенность составляет 1-10%. Хотя в каждом случае необходимо выявить гормональную активность и злокачественный потенциал, большая часть из них представлена гормонально неакти
Abstract. Detection of adrenal neoplasms frequency is increasing constantly, their estimated at 1 to10%. Although in each case it is necessary to identify hormonal activity and malignant potential, most of them are represented by hormone inactive and benign adenomas. Approximately a fifth of the adrenal formations after further verification are hormone-active or carcinomas that require surgical treatment. The main goal of imaging studies in adrenal incidentalomas is the timely detection of malignant tumors; to determine the characteristics of neoplasms, computed tomography, magnetic resonance imaging and, if necessary, a number of radioisotope studies are used. The size of the lesion detected on computed tomograms exceeding 4-6 cm, its uneven edge or heterogeneity of the structure, an attenuation coefficient of 10 Hounsfield units or higher with a non-contrast study, washout of the contrast agent after 10 or 15 minutes by less than 40%, calcification and invasion in the surrounding tissues suggest the malignancy of the adrenal gland lesion, the likelihood of this increases with a combination of these signs. The developed visualization methods and laboratory evaluation allow to assess their morphological structure and functionality with high confidence. The principles of monitoring the growth and hormonal activity of adrenal formations had been currently developed, but the aspects of the long-term dynamic monitoring remain poorly understood. For citation: Morgunov L. Yu. Аdrenal tumors: management tactics // Lechaschy Vrach. 2020; 12 (23): 18-23. DOI: 10.26295/OS.2020.98.90.004
Резюме. Частота выявления новообразований надпочечников постоянно возрастает, их распространенность составляет 1-10%. Хотя в каждом случае необходимо выявить гормональную активность и злокачественный потенциал, большая часть из них представлена гормонально неактивными и доброкачественными аденомами. Примерно пятая часть образований надпочечников после дальнейшей верификации представляет собой гормонально активные или карциномы, требующие оперативного лечения. Основная цель визуализирующих исследований при инциденталомах состоит в своевременном выявлении злокачественных опухолей; для определения характеристик новообразований используют компьютерную томографию, магнитно-резонансную томографию и при необходимости ряд радиоизотопных исследований. Размер выявленного на компьютерных томограммах образования, превышающий 4-6 см, его неровный край или неоднородность структуры, коэффициент ослабления 10 единиц Хаунсфилда или выше при неконтрастном исследовании, вымывание контрастного вещества через 10 или 15 минут менее чем на 40%, кальцификация и инвазия в окружающие ткани предполагают злокачественность поражения надпочечников, вероятность этого повышается при сочетании данных признаков. Разработанные методы визуализации и лабораторная оценка с большой достоверностью позволяют судить об их морфологической структуре и функциональности.
В настоящее время разработаны принципы наблюдения за ростом и гормональной активностью образований надпочечников, однако вопросы длительного динамического наблюдения за ними остаются малоизученными.
Образования надпочечников, случайно обнаруженные при визуальном исследовании, выполненном по причинам, не связанным с их патологией, носят название инциденталом (ИН). Как правило, образования менее 1 см не именуются ИН, и дополнительные диагностические тесты рекомендуются лишь для объемных процессов, превышающих данный размер, при отсутствии клинических симптомов гормональной активности. Быстрое развитие технологий визуализации в последние годы существенно повысило шансы на их обнаружение.
Распространенность ИН составляет от 1% до 8,7% [1] и увеличивается с возрастом, гендерные различия отсутствуют. Например, в стационары Италии ежегодно госпитализируются около 1 450 000 пациентов, у 58 000 из них выявляются ИН [2]. N. Unger (2019) полагает, что распространенность ИН несколько выше – около 3% и увеличивается до 10% у пожилых людей; у 15% пациентов с ИН выявляются признаки их гормональной активности [3]. Хотя данная патология встречается достаточно редко, ее клиническое и экономическое бремя представляется весомым, а вопросы длительного динамического наблюдения пока остаются без ответа.
11-20% выявляемых образований надпочечника являются гормонально активными; с самым высоким риском смертности ассоциированы феохромоцитомы, поэтому их наличие требуется исключить в первую очередь. В 80% случаев в надпочечниках выявляются гормонально неактивные и доброкачественные образования, в то время как распространенность феохромоцитомы составляет от 3,0% до 6,0% адренокортикальной карциномы – от 2,0% до 5,0%. Надпочечник – место метастазирования различных видов рака, встречающихся в 1-2% случаев [4, 5].
Если у пациента ранее выявлялись злокачественные опухоли иной локализации, вероятность того, что ИН окажется метастазом рака, составляет почти 50%. По данным J. T. Lenert с соавт. (2001), адренокортикальная карцинома встречается в 4-5% случаев, но прогноз неблагоприятен из-за частого ее выявления в далеко зашедшей стадии, а ее рецидив является достаточно распространенным явлением. В надпочечник часто метастазирует рак легких, почек, толстой кишки, молочной железы, пищевода, поджелудочной железы, печени или желудка, а сами метастазы нередко бывают двусторонними [6]. Метастатические поражения, как правило, неоднородны по структуре, имеют края неправильной формы и являются двусторонними в 10-15% случаев [7].
Национальное многоцентровое исследование, проведенное по инициативе министерства здравоохранения, труда и социального обеспечения Японии в период с 1999 по 2004 г., включало 3672 случая ИН у 1874 мужчин и 1738 женщин; средний возраст 58,1 ± 13,0 лет. Средний размер ИН составил 3,0 ± 2,0 см; диаметр образований оказался значимо большим у пациентов с верифицированными адренокортикальными карциномами, феохромоцитомами, развернутым синдромом Кушинга, миелолипомами, метастазами рака, кистами и ганглионевромами (p 10 ЕХ) (69%) выполнялась повторная визуализация. 105 врачам первичного звена, чьи пациенты включались в исследование, была разослана стандартизированная анкета, состоящая из 16 вопросов. Большинство специалистов первичного звена полагали, что подавляющей части пациентов с ИН и отсутствием клинической симптоматики не требуется гормональная оценка (71%) или последующее наблюдение (72%). Проведенное исследование демонстрирует необходимость междисциплинарного подхода к наблюдению пациентов с ИН путем взаимодействия между эндокринологами, хирургами и врачами общей практики [38].
Европейское общество эндокринологии (ESE) опубликовало рекомендации по ведению пациентов с ИН (2017), которые полагают возможным воздержаться от повторного гормонального исследования у пациентов с ИН с нормальным уровнем гормонов при первоначальной верификации образования. Рекомендации ESE также полагают нецелесообразным выполнять повторную визуализацию при размерах образования менее 4 см и явных признаках доброкачественности. Однако на сегодняшний день не существует достаточных доказательств, подтверждающих нецелесообразность динамического биохимического и морфологического наблюдения у пациентов с ИН даже при изначально выявленных доброкачественных и гормонально неактивных образованиях надпочечников, поэтому желательно оценивать структурные признаки и уровень гормонов по крайней мере в течение 5 лет [39].
Обобщая рекомендации, предложенные Американской ассоциацией клинических эндокринологов, Американской ассоциацией эндокринных хирургов, Национальным институтом здоровья США, J. M. Lee с соавт. (2017) свидетельствуют о том, что при наличии образования менее 4 см требуется КТ-визуализация через 6 месяцев, не превышающая в дальнейшем 2 лет, а также проведение гормональных тестов – ежегодно в течение 4-5 лет [40].
Клинические рекомендации Российской ассоциации эндокринологов ориентируют на нецелесообразность динамического наблюдения при низкоплотных гормонально неактивных опухолях по данным первичной КТ, в этих случаях также не показан мониторинг гормональной активности. Исключение составляют новые клинические проявления (появление или клиническое прогрессирование артериальной гипертензии, сахарного диабета, ожирения, остеопороза), о чем необходимо предупредить пациента. При неопределенном злокачественном потенциале образования требуется контроль размеров через 3-6 мес, а при увеличении максимального размера опухоли за короткий период на 5 мм или росте объема опухоли на 20% необходимо рассмотреть вопрос об оперативном лечении. При наличии ССК показан ежегодный контроль уровня кортизола и мониторинг коморбидных состояний (артериальной гипертензии, сахарного диабета, ожирения, остеопороза) [41].
Тем не менее круг заболеваний, могущих являться потенциальными предикторами появления гормональной активности ИН, настолько широк, что сводит на нет ограничения к проведению дополнительных визуализирующих и лабораторных исследований в динамике. Так, распространенность артериальной гипертензии среди населения РФ достигает 39,7% [42]. Реальная численность пациентов с СД в РФ составляет не менее 9 млн человек и во всем мире возросла более чем в 2 раза за последние 10 лет [43]. Распространенность ожирения среди россиян с возрастом линейно возрастает у мужчин с 14,3% до 36,3%, а у женщин – с 10,7% до 52,3% [44]. Остеопорозом в России страдают не менее 14 млн человек (10% населения страны), еще у 20 млн граждан России имеет место остеопения [45].
Таким образом, тактика в отношении диагностики, наблюдения и ведения пациентов с новообразованиями надпочечников у разных исследователей практически одинакова. Вопросы лечения пациентов со злокачественными и гормонально активными образованиями решены, но результаты длительного наблюдения за больными с доброкачественными ГНОН пока отсутствуют. Темой для дискуссий остается специальность врача, обеспечивающего дальнейшее наблюдение за пациентом (эндокринолог, врач общей практики, онколог, хирург). Вероятно, создание единого регистра больных с образованиями надпочечников даже в пределах крупного мегаполиса позволит определиться с периодом их наблюдения и тактикой дальнейшего ведения.
Литература/References
Л. Ю. Моргунов, доктор медицинских наук, профессор
ФГАОУ ВО РУДН, Москва, Россия
Образования надпочечников: тактика ведения/ Л. Ю. Моргунов
Для цитирования: Моргунов Л. Ю. Образования надпочечников: тактика ведения // Лечащий Врач. 2020; 12 (23): 18-23. DOI: 10.26295/OS.2020.98.90.004
Теги: новообразования, аденома, карцинома, злокачественная опухоль
СНГ или сказка о надпочечниках
Начинаю освещать одну из сложнейших тем в эндокринологии – заболевания надпочечников.
Надпочечники – небольшого размера парные эндокринные органы, расположенные, как и звучит в названии, над верхним полюсом обеих почек. Длина*ширина *толщина = 0,3 (0,7)*0,2 (0,3)*0,03 (0,1) см. Даже меньше 1 см в длине и 3 мм в толщине минимально. См. картинку.
Это такой маленький, но крайне важный орган и просто рассказать о нём не получится. Что-то уж очень мне приглянулась форма изложения информации в виде «сказочки». Вот очередную присказку про надпочечники я сейчас расскажу.
Итак … Глубоко в брюшной полости существует СНГ (содружественное надпочечниковое государство) ;). Сравнение с известным СНГ – приветствуется.
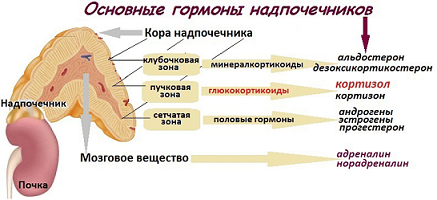
Корковый слой надпочечников состоит из 3-х государств: клубочковая, пучковая и сетчатая зона. Мозговой слой надпочечника расположен «в начинке» надпочечника.
Национальность: гормоны, вырабатываемые этой зоной: минералокортикоиды, представлены 3 гормонами: Альдостерон, Кортикостерон, Дезоксикортикостерон.
Руководителя у данного государства как такого нет, я бы сказала – это парламент. На выработку минералокортикоидов влияют и калий и ангиотензин II, и немного АКТГ).
Основная работа в этом государстве: регуляция водно–солевого обмена, обмена электролитов – калия и натрия, поддержание солевого гомеостаза и артериального давления.
Дефицит гормонов – это хроническая и острая надпочечниковая недостаточность, псевдогипоальдостеронизм. Избыток – синдром гиперальдостеронизма (синдром Кона, по автору).
Национальность: глюкокортикоиды, представлены 2 гормонами: Кортизол, Кортизон.
Руководитель: АКТГ (адренокортикотропный гормон), вырабатывается гипофизом.
Основная работа в государстве: это гормоны ответственны за реакцию организма на стресс и выживание. Регулируют все обменные процессы в организме (углеводов, белков и жиров). Снимают воспалительный и аллергический процессы.
Дефицит гормонов – это хроническая и острая надпочечниковая недостаточность.
Избыток – синдром Кушинга (гиперкортицизм).
Сетчатое государство.
Национальность: половые гормоны. Представлены: ДГА (дигидроэпиандростерон), ДГА-С (дигидроэпиандростерон сульфат), А4 (андростендион), 17-ОН прогестестерон, тестостерон общий.
Руководитель: АКТГ.
Основная работа: данные половые гормоны играют роль несколько иную, чем гормоны, выделяемые половыми железами. Они активны до полового созревания (инициируют пубертат) и после полового созревания (особенно ДГА, является прямым предшественником тестостерона и эстрадиола). В том числе они влияют на развитие вторичных половых признаков (рост усов, лобковое и подмышечное оволосение, наращивание мышечной массы и т.д.)
Дефицит – адренодефицит.
Избыток – адреногенитальный синдром, опухоли надпочечников.
Мозговое вещество (государство).
Национальность: катехоламины, представлены, наверно, самыми известными надпочечниковыми гормонами – адреналин и норадреналин, дофамин и их метаболиты – метанефрин, норметанефрин. А так же небольшими концентрациями: вещество Р, ВИП, соматостатин, в-энкефалин.
Руководитель (президент): симпатическая нервная система.
Основная работа: поддержание жизнедеятельности организма – стабильность АД, пульса, расширение бронхов, работа других внутренних желез.
Дефицит – не возможен (состояние не совместимое с жизнью)!
Избыток – феохромоцитома.
Вот и присказке конец, а кто прочёл – … переходит к научной части статьи :D.
Сегодня речь пойдёт о таком заболевании надпочечников как – надпочечниковая недостаточность.
Симптомы хронической надпочечниковой недостаточности выглядят так:
Первичная ХНН от вторичной отличается тем, что при первичной – страдает и клубочковая зона, где продуцируется альдостерон (начинает теряться соль (натрий) из организма), от этого и тяга к соли и жажда. При вторичной альдостероновая зона не страдает.
И при первичной, ярко меняется оттенок кожи – нарастает такая бронзовая пигментация! Это связано с тем что АКТГ и гормон мелатонин, отвечающий за пигментацию вырабатываются вместе, при первичной ХНН АКТГ начинает нарастать и мелатонин вместе с ним.
Получается, что по клиническому течению вторичная ХНН легче первичной ХНН.
Как диагностировать недостаточность надпочечников:
(слюна собирается дома в пробирки, взятые накануне в лаборатории). Это позволяет отследить все циркадные колебания суточного кортизола, особенно это удобно при подборе терапии гормонами и у детей.
Кроме того, с 2016 года в практику в нашем центре мы ввели пробу с синактеном –депо 1 мг (препаратом искусственного АКТГ продлённого действия), который в России не производится, к сожалению. Он позволяет со 100% вероятностью исключить ХНН. Проба минимальна по сложности:
Для лечения дефицита альдостерона – кортинеф, аналогов у него нет!
Диагностика и лечение заболеваний надпочечников
Надпочечники — это парный эндокринный орган, который представляет собой две железы, расположенные у верхнего полюса каждой из почек. Они состоят из двух структур: наружное корковое и внутреннее мозговое вещество.
Несмотря на то, что мозговое и корковое вещество анатомически объединены в один орган, каждое из них работает как самостоятельная железа. Нарушение функционирования надпочечников приводит к сбоям в работе организма и может стать причиной развития целого ряда тяжелых заболеваний.
В корковом веществе вырабатываются стероидные гормоны, которые управляют обменом энергии и метаболизмом. Есть три зоны коркового вещества, в каждой из которых синтезируются разные гормоны:
В мозговом веществе надпочечников синтезируются катехоламины (адреналин, дофамин, норадреналин). Они оказывают влияние на работу сердечно-сосудистой системы (меняют частоту сердечных сокращений, повышают артериальное давление), стимулируют расщепление жиров, повышают уровень глюкозы в крови.
Для здоровья всего организма крайне важно, чтобы надпочечники работали правильно. Любые нарушения их функции отрицательно сказываются на общем состоянии пациента.
Основные причины болезней надпочечников:
Наиболее распространенные заболевания
Это патология, при которой в корковом веществе синтезируется слишком много гормона альдостерона. Причиной первичного гиперальдостеронизма являются новообразования в самих надпочечниках. Вторичный гиперальдостеронизм возникает как осложнение других болезней (цирроз печени, сердечная недостаточность, хронический нефрит).
Недостаточность коры надпочечников
Проявляется пониженной секрецией гормонов коры надпочечников. Развивается либо вследствие аутоиммунного поражения органа, либо как осложнение других заболеваний (туберкулез, метастаз в надпочечник), а также при длительном приеме препаратов глюкокортикостероидов, при котором необратимо подавляется собственная секреция гормона кортизола. Симптомы:
Заболевание, при котором происходит автономная повышенная секреция гормона кортизола корой надпочечников.
Чаще всего заболевание диагностируют у женщин в возрасте 25-40 лет. Как правило, причиной является гормонпродуцирующая аденома, либо узелковая гиперплазия надпочечников.
Это опухоль, которая развивается из мозгового вещества надпочечников и приводит к увеличению синтеза катехоламинов. Основным симптомом данного заболевания является повышенное артериальное давление, трудно поддающееся медикаментозной коррекции.
На фоне артериальной гипертензии могут появиться такие симптомы, как головная боль, повышенная потливость, бледность кожи, судороги, тошнота, рвота, приступы беспричинного страха и ряд других.
Острая надпочечниковая недостаточность
Причинами развития данного патологического состояния организма являются хроническая надпочечниковая недостаточность, инфекционные заболевания, травмы, тяжелые физические нагрузки, сильный психологический стресс, резкая смена климата, сепсис, менингит, ожоговая болезнь, сильная потеря крови и ряд других.
Данное состояние требует срочной госпитализации пациента и оказания ему квалифицированной медицинской помощи в реанимации.
Диагностика
Основными методами диагностики заболеваний надпочечников являются:
Общий анализ крови. Дает общую информацию о здоровье и состоянии пациента.
Биохимический анализ крови. Наиболее важным здесь представляется исследование уровня электролитов крови (калий, натрий), а также оценка функции почек и печени.
Методы лечения болезней надпочечников
Терапию назначает лечащий врач в зависимости от конкретного заболевания и наличия сопутствующих заболеваний, а также индивидуальных особенностей организма пациента.
Чаще всего при выявлении гормональной гиперпродукции речь будет идти об оперативном лечении. Но прежде должен быть произведен большой диагностический поиск и тщательная подготовка пациента.
При надпочечниковой недостаточности:
Для нормализации гормонального баланса может проводиться заместительная гормональная терапия. При установлении инфекционных причин либо злокачественном поражении специалистами смежных специальностей проводится этиотропное лечение первопричины.
Операция может быть эндоскопической или полостной. В первом случае оперативный доступ осуществляется через небольшие разрезы или проколы. Это позволяет сделать процедуру менее травматичной, и период реабилитации, соответственно, будет более коротким.
При проведении полостной операции производится вскрытие всей брюшной полости пациента. Такая процедура переносится тяжелее, период восстановления после нее будет довольно продолжительным. Если во время операции были удалены оба органа, пациенту назначается пожизненная гормональная терапия.
Артериальная гипертензия при заболеваниях коры надпочечников
Большую роль в распространенности вторичных форм артериальной гипертензии играют различные заболевания коры надпочечников. К ним относятся первичный гиперальдостеронизм, синдром Иценко–Кушинга и гипертензивные формы врожденной дисфункции коры надпочечнико
The great role in the prevalence of secondary forms of arterial hypertension play different diseases of the adrenal cortex. They are primary hyperaldosteronism, Cushing’s syndrome and hypertensive forms of congenital dysfunction of the adrenal cortex. Timely detection of these diseases allows to choose the best treatment and to normalize arterial pressure in such patients.
В современном обществе наблюдается значительная распространенность артериальной гипертензии (АГ), составляя 30–45% среди взрослого населения по данным зарубежных исследований и около 40% по данным российских исследований [1]. Вторичные (симптоматические) АГ — заболевания, при которых причиной повышения артериального давления (АД) является поражение различных органов или систем, а АГ является лишь одним из симптомов заболевания. Вторичные АГ выявляются у 5–25% пациентов с АГ [1]. Своевременная диагностика симптоматических АГ позволяет подобрать патогенетические подходы к лечению и в ряде случаев полностью нормализовать артериальное давление. Большое значение в патогенезе эндокринных форм АГ имеет гиперфункция коркового слоя надпочечников на фоне различных клинико-морфологических форм заболеваний разной этиологии. В большинстве случаев развивается тяжелая АГ, часто резистентная к антигипертензивной терапии.
Первичный гиперальдостеронизм (ПГА) — одна из наиболее распространенных причин эндокринных АГ, приводящая в 5–10% случаев к неосложненной АГ и в 7–20% случаев к стойкой АГ [2]. Распространенность ПГА одинаковая среди мужчин и женщин, средний возраст дебюта заболевания составляет 40–50 лет. ПГА характеризуется автономной секрецией альдостерона надпочечниками, которая относительно независима от влияний ренин-ангиотензиновой системы. Секреция альдостерона осуществляется клубочковой зоной коры надпочечников и контролируется ренин-ангиотензиновой системой, ионами калия, адренокортикотропным гормоном (АКТГ), предсердным натрийуретическим гормоном и дофамином. В норме повышение уровня калия в крови вызывает усиление секреции альдостерона, что в свою очередь увеличивает экскрецию калия. При низком уровне калия секреция альдостерона тормозится, а экскреция калия уменьшается. Известно, что альдостерон повышает артериальное давление путем увеличения задержки натрия в почках. Последние исследования показали влияние альдостерона на центральную нервную систему за счет увеличения симпатической сосудосуживающей активности на периферическую циркуляцию. Альдостерон оказывает прямое действие на клетки сосудистой стенки, приводя к вазоконстрикции и гипертензии. Пациенты с ПГА имеют более высокий сердечно-сосудистый риск, нежели с эссенциальной АГ.
Среди причин ПГА выделяют аденому надпочечника, одно- или двустороннюю гиперплазию надпочечников, в редких случаях — семейный гиперальдостеронизм типа I, корригируемый глюкокортикостероидами (семейное заболевание, обусловленное дефицитом гена 18-гидроксилазы), типа II (семейная встречаемость аденомы или гиперплазии) и типа III (мутация К-каналов) [3]. Наиболее распространенная форма ПГА — идиопатическая билатеральная гиперплазия (ИГА), которая обнаруживается у 60–70% пациентов. На альдостерон-продуцирующую аденому (АПА) приходится 30–35% пациентов, менее 1% — на карциному надпочечников или семейные формы [2, 4]. По данным различных исследователей значительно увеличилась частота ИГА по сравнению с другими причинами гиперальдостеронизма. По данным скринингового исследования по распространенности ИГА и АПА у 1125 пациентов, распространенность заболевания ГА, вызванным как АПА, так и ИГА, значимо возросла (с 7,2% до 19,5% соответственно) при увеличении степени тяжести АГ [4, 8].
Основным симптомом первичного гиперальдостеронизма является стойкая артериальная гипертензия. Клиника ПГА обусловлена гипокалиемией (калий плазмы составляет менее 3,6–3,8 ммоль/л), характерными клиническими проявлениями которой являются выраженная мышечная слабость, парестезии, судороги, никтурия. Гипокалиемия приводит к нарушению толерантности к глюкозе в результате снижения уровня инсулина в крови. Однако отсутствие гипокалиемии не исключает наличие ПГА [5]. У части пациентов течение заболевания может быть малосимптомным. Сходные клинические проявления наблюдаются и при семейной форме гиперальдостеронизма I типа. В большом проспективном обсервационном исследовании было обнаружено, что около 50% пациентов с альдостерон-продуцирующей аденомой и 80% с идиопатической гиперплазией имели нормальный уровень калия в плазме. Первичный гиперальдостеронизм у пожилых наиболее часто приходится дифференцировать с гипертонической болезнью, тетанией, несахарным диабетом, нефритом с потерей калия, почечной гипертензией, обусловленной ишемией почек, и вторичным гиперальдостеронизмом. Семейный гиперальдостеронизм I типа наследуется как аутосомно-доминантное гетерогенное заболевание и составляет 0,5–1% из всех случаев пациентов с АГ, 5% среди всех форм ПГА, встречается как у мужчин, так и у женщин. Обычно пациенты страдают тяжелой формой АГ с высокой инвалидизацией и смертностью в молодом возрасте в результате геморрагических инсультов. Скрининг должен проводиться у пациентов младше 20 лет с АГ или с семейной историей АГ и геморрагических инсультов в возрасте менее 40 лет [6]. При этой форме имеется гиперпродукция 18-гидроксикортизола (18OHF) и 18-оксокортизола (18oxoF). В большинстве случаев выявляется билатеральная гиперплазия коры надпочечников. Семейный гиперальдостеронизм II типа, встречающийся у 1,2–6% пациентов c ПГА, имеет разные клинические проявления, неотличимые от ИГА и АПА, поэтому диагноз базируется на появлении ПГА у двух и более членов семьи первой степени родства [7]. Семейный гиперальдостеронизм III типа был впервые описан в 2008 г. у отца и двух дочерей с тяжелой гипокалиемической ювенильной гипертензией [8]. Глюкокортикоиднезависимый ГА сопровождался высокими уровнями 18OHF и 18oxoF. Билатеральная надпочечниковая гиперплазия была выявлена у большинства пациентов.
Согласно клиническим рекомендациям эндокринного сообщества скрининг на ПГА проводится у следующих пациентов [9]:
Скрининговые тесты на ПГА включают определение активности ренина плазмы (АРП) и уровня альдостерона. Эти исследования могут быть проведены на фоне приема большинства антигипертензивных препаратов, за исключением антагонистов минералокортикоидных рецепторов или прямых ингибиторов ренина. Пациентам с низким уровнем ренина и высоким уровнем альдостерона сыворотки (более 15 нг/дл) показаны нагрузочные пробы. Для аденомы (альдостеромы) и гиперплазии коры надпочечников характерна низкая АРП, которая обычно не превышает 1 нг/мл/ч после стимулирующего воздействия ходьбы (1–2 часа) или фуросемида, и повышенная секреция альдостерона. Величина ангиотензин-ренинового соотношения (АРС) зависит от единиц измерения, нижней границы определения АРП [10]. Подавляющее большинство исследователей используют значение АРС в пределах 20–40 (концентрация альдостерона в нг/дл к АРП в нг/мл/ч). Пациентам с высоким АРС проводят дополнительные нагрузочные тесты для дифференциальной диагностики альдостеромы и гиперплазии коры надпочечников, поскольку тактика лечения этих форм АГ различна: больные с альдостеромой успешно лечатся хирургически, а больным с гиперплазией коры надпочечников показано медикаментозное лечение. В настоящее время наиболее широко используется проба с физиологическим раствором, реже — с флюдрокортизоном. Для визуализации поражения надпочечников и уточнения стороны локализации опухоли используют томографические методы с введением контрастного вещества. О гормональной активности выявленных в надпочечниках структурных изменений можно судить по результатам флебографии надпочечников и раздельной катетеризации вен надпочечников с определением концентрации альдостерона и кортизола в крови, оттекающей от правого и левого надпочечников. Хирургическое удаление альдостером у 50–70% больных приводит к нормализации или к значительному снижению АД [11]. До хирургического удаления альдостером и пациентам с двусторонней гиперплазией коры надпочечников назначают спиронолактон, при недостаточном гипотензивном эффекте возможно присоединение антагонистов кальция. Эплеренон является селективным антагонистом минералокортикоидных рецепторов, не обладающим антиандрогенными и прогестагенными свойствами, что снижает частоту побочных явлений. За рубежом препарат используется для лечения больных ПГА, в России пока показания для лечения ГА не зарегистрировано. Антагонистическая активность эплеренона составляет 60% от таковой спиронолактона. У больных с семейной формой гиперальдостеронизма I типа проводят терапию глюкокортикостероидами (дексаметазон), что приводит к нормализации АД и показателей РААС. Лечение направлено на коррекцию основного заболевания и устранение условий, стимулирующих повышенную секрецию альдостерона. Необходимо понимать, что успех лечения и прогноз у пациентов с гиперальдостеронизмом напрямую зависит от своевременности диагноза, понимания преимуществ и недостатков диагностических тестов, формирования правильных показаний к сравнительному селективному забору крови из надпочечниковых вен и подходов к дальнейшей терапии.
Синдром Иценко–Кушинга (СИК) — клинический синдром, который развивается при повышенной секреции глюкокортикоидов. СИК приводит к развитию АГ у 70–85% пациентов старше 18 лет и у 50–78% пациентов младше 18 лет с эндогенным гиперкортицизмом [12–15]. Выделяют АКТГ-зависимые и АКТГ-независимые эндогенные формы гиперкортицизма. АКТГ-зависимые формы эндогенного гиперкортицизма выявляются в 85% случаев.
АКТГ-зависимый эндогенный СИК или болезнь Иценко–Кушинга (БИК) — заболевание, обусловленное опухолью гипофиза или гиперплазией клеток аденогипофиза, секретирующих АКТГ; нарушением выработки кортиколиберина в гипоталамусе. При БИК значительно повышается продукция АКТГ, а также нарушается секреция всех тропных гормонов гипофиза. Повышение секреции АКТГ ведет к стимуляции стероидогенеза в коре надпочечников и развитию гиперплазии коры надпочечников [16].
Причиной СИК могут быть аденома, карцинома коры надпочечников, эктопическая опухоль с гиперпродукцией АКТГ. Клиническая картина меняется от бессимптомного течения до клинических проявлений гиперкортицизма. Опухоли коры надпочечников продуцируют не только глюкокортикоиды, но андрогены (предшественники), а также минералокортикоиды и эстрогены [17], что обусловливает клиническую картину заболевания.
СИК, вызванный эктопическим синтезом АКТГ (эктопический АКТГ-синдром), встречается в 15% случаев эндогенного гиперкортицизма. Эктопический АКТГ-синдром выявляется в 50% случаев злокачественной мелкоклеточной опухолью легкого. Этот синдром может быть проявлением нейроэндокринных опухолей, которые локализованы в поджелудочной железе (10%), бронхе (10%) или тимусе (15%). Отличительными особенностями эктопического АКТГ-синдрома являются значительное повышение уровня кортизола, отсутствие абдоминального ожирения, характерного для других форм СИК [17].
АКТГ-независимая двусторонняя микронодулярная гиперплазия надпочечников встречается у детей и лиц молодого возраста. Микронодулярная гиперплазия надпочечников отличается значительной функциональной активностью с автономной гиперсекрецией кортизола. АКТГ-независимая двусторонняя макронодулярная гиперплазия надпочечников встречается редко. Наиболее частой причиной является наличие в надпочечниках рецепторов гастроинтестинального полипептида. Секреция этого полипептида клетками желудочно-кишечного тракта повышается после приема пищи, что стимулирует секрецию глюкокортикоидов в надпочечниках, т. е. развивается связанный с приемом пищи гиперкортизолизм. Содержание АКТГ в крови у таких больных низкое [17].
Основным патогенетическим механизмом развития АГ при эндогенном гиперкортицизме является повышение уровня глюкокортикоидов в крови, вследствие чего увеличивается продукция ангиотензиногена в печени [19], уменьшается продукция простагландинов за счет ингибирования фосфолипазы А и увеличивается инсулинорезистентность [20, 21], отмечается повышение симпатической активности. Избыточный уровень глюкокортикоидов оказывает влияние на минералокортикоидные рецепторы почек за счет гиперактивации 11β-гидроксистероиддегидрогеназы — фермента, который катализирует превращение кортизола в кортизон [22], что ведет к повышению концентрации натрия и задержке воды. Имеются данные о снижении активности вазодепрессорных механизмов, особенно эндотелиального оксида азота [22].
АГ носит постоянный характер с тенденцией к постепенному возрастанию уровня АД вне зависимости от этиологии заболевания. Особенностью АГ при эндогенном СИК является отсутствие существенной зависимости уровня АД от пола и возраста пациента, а также от уровня циркулирующего кортизола [12, 13].
При длительной гиперпродукции глюкокортикоидов в миокарде развиваются функциональные и структурные изменения: выраженная гипертрофия миокарда левого желудочка, электролитно-стероидная кардиопатия, дилатационная кардиомиопатия, снижение сократительной способности миокарда.
Клиническая картина СИК проявляется основными клиническими симптомами, являющимися следствием гормональных и метаболических изменений. Длительная гиперпродукция кортикостероидов приводит к развитию диспластического ожирения, трофическим изменениям кожи, кардиомиопатиям, нарушениям углеводного обмена, вторичному иммунодефициту, вторичному гипогонадизму, системному остеопорозу, нефролитиазу со вторичным пиелонефритом, энцефалопатиям, различным эмоционально-психическим расстройствам.
Обследование больных АГ с подозрением на гиперсекрецию глюкокортикоидов целесообразно начинать с выявления и подтверждения наличия гиперкортизолемии, определения кортизола слюны и определения уровня экскреции свободного кортизола в суточной моче. При наличии характерных клинических проявлений заболевания для выявления гиперкортицизма проводят определение суточного ритма секреции АКТГ.
Следующий этап диагностики заключается в дифференциации этиологии заболевания с помощью функциональных проб (проведение ночного дексаметазонового теста с 1 мг, дексаметазоновых тестов с 2 и 8 мг) [23].
Для установления локализации основного патологического процесса на разных этапах диагностики применяются визуализирующие методы исследования: УЗИ надпочечников, компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) головного мозга и надпочечников. Наиболее информативными методами топической диагностики опухолей при эндогенных формах гиперкортицизма, безусловно, являются КТ и МРТ. Данные методы позволяют обнаружить диффузное или диффузно-узелковое увеличение обоих надпочечников, их деформацию, наличие узелковых образований от 0,5 до 2,0 см в диаметре.
Этиологическое лечение при рассмотренных формах гиперкортицизма предусматривает применение хирургических, лучевых и медикаментозных методов, эффективность которых зависит от точности и своевременности поставленного диагноза. Основным методом лечения БИК является удаление аденомы гипофиза (трансфеноидальная аденомэктомия), также возможна одно- или двусторонняя адреналэктомия в сочетании с лучевой терапией. При выявлении опухоли — источника эктопической секреции АКТГ применяют хирургические методы лечения, при необходимости химиотерапевтические методы лечения. При невозможности установить источник эктопии с целью ликвидации симптомов гиперкортицизма проводят двустороннюю адреналэктомию с последующей длительной гормонотерапией [24]. Медикаментозная терапия применяется как дополнение к указанным основным методам лечения. В качестве симптоматической антигипертензивной терапии могут применяться лекарственные препараты всех основных классов [25, 26]. Так как в основе патогенеза АГ при гиперкортицизме лежит гипернатриемия и гиперволемия, предпочтение отдается диуретикам в сочетании со спиронолактоном [25].
Причиной АГ могут являться гипертензивные формы врожденной дисфункции коры надпочечников (ВДКН). Недостаточность фермента стероидогенеза 11β-гидроксилазы составляет около 5% всех случаев ВДКН. Этот фермент катализирует преобразование дезоксикортикостерона в кортикостерон (предшественник альдостерона) и 11-дезоксикортизола в кортизол. Недостаточность 11β-гидроксилазы приводит к повышенному образованию 11-дезоксикортикостерона, который оказывает минералокортикоидное действие, способствуя задержке натрия в организме и развитию АГ. Вследствие дефицита кортизола отмечается повышение АКТГ, что приводит к стимуляции стероидогенеза, накоплению промежуточных продуктов стероидогенеза (17-ОН-прогестерона и андростендиона, увеличению секреции андрогенов), что влечет за собой пренатальную вирилизацию и псевдогермафродитизм у девочек. Для мальчиков характерно раннее начало пубертата. Гипертензия, как правило, не коррелирует с наличием и степенью выраженности вирилизацию. При этой форме ВДКН отсутствует гиперплазия юкстагломерулярного аппарата почки и уровень ренина в плазме крови не повышен [27, 28].
При лабораторном исследовании выявляются увеличение уровня 11-дезоксикортизола и дезоксикортикостерона в сыворотке крови с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ).
Терапия глюкокортикоидными гормонами приводит к нормализации АКТГ, дезоксикортикостерона и андрогенов, что клинически проявляется нормализацией артериального давления.
Синдром Биглиери является редкой формой ВДКН, при которой отмечается дефицит ферментов стероидогенеза 17α-гидроксилазы и 17,20-лиазы. Недостаточность 17α-гидроксилазы и 17,20-лиазы приводит к частичной или полной блокаде синтеза кортизола, при этом секреция кортикостерона и дезоксикортикостерона не нарушается. Недостаток секреции кортизола является причиной повышения секреции АКТГ с последующей гиперплазией коры надпочечников. Стимуляция стероидогенеза приводит к избыточному образованию дезоксикортикостерона, что способствует задержке натрия в организме и артериальной гипертензии. Вследствие гиперволемии отмечается снижение активности ренин-ангиотензинной системы. 17-гидроксилирование является необходимым этапом в образовании андрогенов, поэтому при этой форме имеется дефицит андрогенов [28, 29].
У мальчиков недостаток андрогенов приводит к нарушению формирования наружных половых органов с явлениями псевдогермафродитизма, у девочек диагностика этого нарушения затруднена, так как наружные половые органы развиты нормально и лишь в период полового созревания выявляется недостаточность функции яичников.
При гормональном исследовании определяется повышение содержания АКТГ, кортикостерона и дезоксикортикостерона при снижении уровней кортизола, альдостерона и андрогенов [30].
Заместительная терапия глюкокортикоидами приводит к снижению секреции АКТГ, уменьшению образования кортикостерона и дезоксикортикостерона и нормализации артериального давления [30].
Симптоматические гипертензии при заболеваниях коры надпочечников в первую очередь требуют проведения патогенетического лечения вне зависимости от стандартных методов лечения АГ. Задачей диагностики является выявление пациентов на ранних стадиях заболевания и проведение специального обследования согласно принятым рекомендациям. Поздняя диагностика, неправильная тактика лечения заболеваний надпочечников приводит к необратимым изменениям тканей и органов-мишеней.
Литература
ФГБОУ ВО СЗГМУ им. И. И. Мечникова МЗ РФ, Москва