удалили сальник в брюшной полости что это такое
Оментэктомия – удаление большого сальника
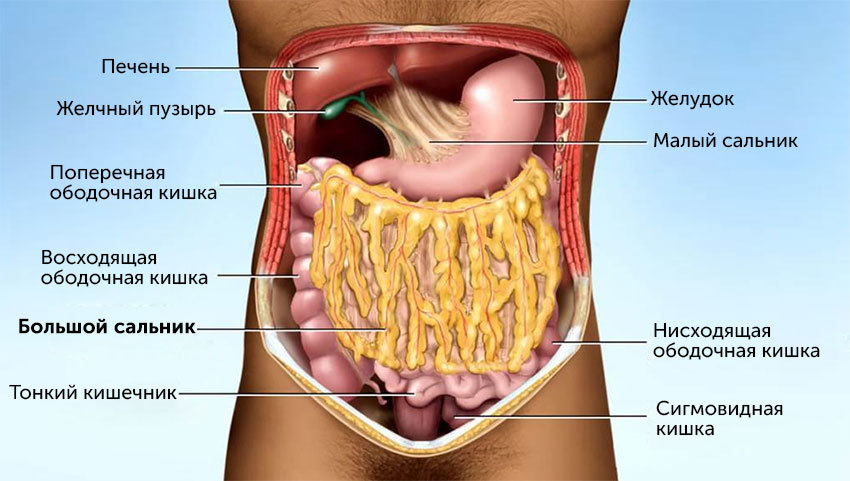
Оментэктомия — это хирургическое удаление большого сальника, который представляет собой подобие жирового фартука, свободно свисающего от желудка до петли кишечника.
Что такое большой сальник
Внутренние органы брюшной полости покрыты тонким защитным слоем соединительной ткани — брюшиной.
В процессе эволюции для дополнительной защиты брюшной полости сформировался отдельный орган — большой сальник. Он представляет собой разросшуюся брюшину, состоящую из четырех листков. Жировая клетчатка между этими листками дала название органу.
Главная функция большого сальника — защита от внешних ударных воздействий. Он начинается от передней стенки желудка, накрывает петли тонкого кишечника и заканчивается на уровне кишки.
Большой сальник, как и брюшина в целом, обильно насыщен кровеносными сосудами, лимфатическими каналами. этого он максимально подвержен метастазированию при злокачественных опухолях органов брюшной полости и малого таза.
Показания к удалению
высокого риска образования метастазов большой сальник удаляется даже при отсутствии видимых очагов. Это делается для того, чтобы свести к минимуму риск рецидивов после хирургического лечения раковых опухолей яичников и других органов.
Даже если метастазы не были обнаружены при диагностике, это не дает гарантии отсутствия раковых клеток в жировом фартуке. А поскольку вероятность их существования всегда высока, обычно принимается решение о превентивном удалении сальника.
Такая операция называется оментэктомией. Она практически не влияет на качество жизни, и при этом существенно повышает эффективность лечения, улучшает прогноз пятилетней выживаемости при онкологических заболеваниях.
Злокачественные опухоли самого сальника исключительно редки. Как правило, речь идет о метастазах и распространении (диссеминации) раковых клеток.
Закажите обратный звонок. Мы работаем круглосуточно
Резекция большого сальника (лапароскопия/лапаротомия)
Резекция большого сальника — операция, при которой иссекается и ушивается складка брюшины, покрывающая полость брюшины от области желудка до тонкого кишечника. Данное хирургическое вмешательство, как правило, не является самостоятельной операцией, и чаще выполняется при злокачественном процессе в органах брюшины и малого таза. Как показывает практика, при поражении матки и придатков своевременная выполненная резекция увеличивает выживаемость пациенток. Объясняется это тем, что в ткани сальника легко метастазируют злокачественные клетки. Незамеченные при операции, они будут причиной новых очагов, поэтому удаленная ткань сальника в обязательном порядке должна направляться на гистологический анализ. В ходе хирургического вмешательства по поводу злокачественного процесса удалению также подлежат затронутые раком структуры: лимфатические узлы, кишечник.
Резекция большого сальника может быть проведена с использованием лапароскопического или лапаротомического доступа. В ходе лапаротомии выполняется разрез передней брюшной стенки, открытый метод целесообразен, если необходим обзор пораженных участков. Продолжительность госпитализации в этом случае составляет около 10 дней, восстановление займет около 1-1,5 месяца. В отличие от лапаротомии, при лапароскопическом доступе манипуляции выполняются через несколько небольших разрезов на животе с использованием видеоэндоскопического оборудования. Все действия хирурга отражаются на мониторе с качественным разрешением, визуальный контроль современной аппаратуры обеспечивает высокую точность манипуляций. После лапароскопии длительность пребывания в клинике составляет не более трех дней, период восстановления занимает не более 4 недель.
Показания и противопоказания
Преимущества резекции большого сальника
Комментарий врача

Руководитель хирургической службы SwissClinic Пучков Константин Викторович
Почему резекцию большого сальника лучше сделать в Швейцарской Университетской клинике?
Часто задаваемые вопросы
В чем заключается подготовка к резекции большого сальника?
Перед операцией необходимо тщательно очистить кишечник. Также за несколько дней до вмешательства нужно исключить из рациона продукты, способные вызвать повышенное газообразование. Операция проводится строго натощак, последний прием пищи, как минимум, за 8 ч до ее начала. При необходимости приема каких-либо медикаментов необходимо предупредить лечащего врача, возможно, некоторые препараты нужно будет исключить на несколько дней.
Возможны ли осложнения при резекции большого сальника?
Как при любом оперативном вмешательстве, при резекции также есть риск развития осложнений, теоретически нельзя исключить кровотечения или повреждения близлежащих органов в ходе вмешательства, инфицирование в ранний послеоперационный период. Поэтому наши пациенты проходят тщательное предоперационное обследование, чтобы исключить факторы, увеличивающие риск развития осложнений. Визуальный контроль процесса и использование при проведении операции оборудования и инструментария последнего поколения сводит к минимуму риск негативных последствий.
Реабилитация после резекции большого сальника
На продолжительность восстановления влияет, прежде всего, метод проведения операции. Но, независимо от используемого доступа, через несколько часов женщина может ходить, ей разрешается принимать жидкую легкую пищу. При лапаротомическом доступе длительность госпитализации составляет около 7-10 дней, восстановление занимает 4-6 недель. После лапароскопии период реабилитации значительно короче, женщина, как правило, выписывается на 3 сутки, полное восстановление занимает 2-4 недели. В послеоперационный период могут быть назначены антибактериальные и обезболивающие препараты. На протяжении месяца следует отказаться от интенсивных физических нагрузок и половых контактов, лучше исключить посещение бассейна или сауны.
Используется ли анестезия при резекции большого сальника?
В ходе оперативного вмешательства какие-либо болезненные ощущения полностью исключены, операция может быть проведена под общим наркозом, эпидуральной или спинальной анестезией. Какому способу отдать предпочтение, решает врач в каждом случае индивидуально.
Заболевания
Рак шейки матки
Рак шейки матки — онкологическое заболевание, при котором эпителий нижнего отдела матки трансформируется в злокачественные клетки. В зависимости от типа эпителия различают плоскоклеточный рак — он диагностируется у 85-95% больных, и аденокарциному — появляющуюся в 5-15%.
Рак эндометрия
Рак эндометрия — онкологическое заболевание, при котором злокачественный процесс развивается во внутреннем слое матки. Среди онкологических патологий женской половой сферы эта болезнь по частоте возникновения занимает лидирующее место. Согласно статистике, на 100 тысяч женщин приходится около 13 пациенток с диагностированным заболеванием. Около 75% заболевших приходится на женщин после 50 лет — предменопаузального и постменопаузального возраста, однако в последние годы все чаще пациентками онколога становятся женщины помоложе.
Рак яичников
Рак яичников — одно из распространенных онкологических заболеваний в гинекологии, по частоте развития уступает первенство лишь злокачественным опухолям матки. Поражение яичника может быть первичным — патологический очаг находится в самом яичнике, и вторичным, называемым метастатическим — очаг патологии расположен в любом другом органе. Злокачественные клетки в тканях яичника могут появляться при опухолях в молочной железе, матке, кишечнике, желудке.
Записывайтесь на консультацию: +7 (495) 782-50-10
Удалили сальник в брюшной полости что это такое
Удаление детородных органов – операция всегда вынужденная, обусловленная серьезными показаниями, и если врач принимает такое решение, то, чаще всего это означает борьбу за сохранение жизни пациентки. Самая распространенная причина, по которой врач предписывает удаление матки и придатков – онкологическое заболевание или заболевание, которое может привести к онкологическому – миома больших размеров или множественные миоматозные образования, миома с сомнительным результатом биопсии, аденомиоз, эндорметриоз, не поддающиеся консервативному лечению, частые или обильные кровотечения, выпадение матки или другие ситуации, когда присутствие матки в женском организме несет больше опасностей, нежели обещаний будущего материнства. Если выявлено онкологическое заболевание, врачи нередко вместе с удалением матки и придатков предписывают и удаление большого сальника – складки брюшины, простирающейся от желудка до тонкого кишечника. Это обусловлено тем, что зачастую в ткани сальника проникают метастазы, и удаление этой складки существенно повышает выживаемость пациенток, прошедших подобное лечение.
Операции по удалению матки, придатков и сальника, как правило, предшествует процесс внимательной и детальной диагностики – изучается не только степень сложности заболевания, а и общее состояние пациентки, и когда учтены и сведены на минимум все риски относительно возможных осложнений, врач переходит к подготовке операции. Операция может выполняться лапароскопически или лапаротомически. Нередко полосная (лапаротомическая) операция позволяет врачу более внимательно изучить состояние всех органов, находящихся в брюшной полости, удалить возможные метастазы и исключить вероятность продолжения заболевания. Такая операция выполняется под общим наркозом в операционном зале и на операционном столе (в отличие от некоторых гинекологических операций, выполняемых на гинекологическом кресле), и ее продолжительность зависит от степени сложности состояния пациентки. После того, как наркоз начинает действовать, врач делает разрез в нижней части живота, удаляет орган, пораженный недугом, и тщательно осматривает органы, расположенные в брюшной полости, поблизости с репродуктивными органами. После этого удаляется сальник, и рана ушивается. После выполнения операции пациентка некоторое время остается в стационаре под наблюдением врача. Срок нахождения в клинике врач определяет, исходя из состояния больной.
Реабилитация после такой операции может занимать различное время, однако, во избежание образования спаек и застойных явлений, желательна как можно более быстрая активизация женщины – через сутки ей могут разрешить аккуратно вставать и бережно передвигаться. Катетер в мочевом пузыре также может быть оставлен на срок до суток. На протяжении двух месяцев пациенткам, перенесшим подобные операции, рекомендуется отказ от выполнения тяжелого физического труда, воздержание от занятий спортом и половой жизни. В случае своевременного обращения пациентки к врачу и вовремя выполненного лечения женщина уже через несколько месяцев может вернуться к нормальной здоровой жизни и забыть о недуге.
Клиника “Медистар” оборудована современным высокоточным диагностическим оборудованием, помещения отличаются комфортностью и стерильной чистотой, а наши врачи – высококвалифицированные специалисты, обладающие значительным опытом в лечении гинекологических заболеваний любой сложности, вернувшие здоровье огромному числу женщин.
Перитонеальный канцероматоз
Перитонеальный канцероматоз
Вам поставили диагноз: перитонеальный канцероматоз (опухоль брюшины)
Предлагаем Вашему вниманию краткий, но очень подробный обзор перитонеального канцероматоза.
Филиалы и отделения, где лечат перитонеальный канцероматоз
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Национальный центр лечения больных канцероматозом
МНИОИ имени П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Руководитель Центра к.м.н. Владимир Михайлович Хомяков – 8 495 150 11 22
Введение
Причины возникновения перитонеального канцероматоза
Развитие перитонеального канцероматоза является поэтапным процессом. Первый этап – распространение опухолевых клеток из первичного очага поражения. Это связано с нарушением межклеточного взаимодействия и приобретением клетками опухоли подвижности. При этом эпителиальные клетки меняют фенотип на мезенхимальный, происходит деградация межклеточного матрикса. Распространение опухолевых клеток может происходить в ходе оперативного вмешательства. Их механическое отделение возможно при повреждении лимфатических или кровеносных сосудов. Попавшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов, имплантируются в местах повышенной резорбции: большом сальнике, в области слепой кишки, дугласовых карманах.
На втором этапе опухолевые клетки взаимодействуют с мезотелием брюшины. Механизмы адгезии определяются природой клеток, особенностями морфологии брюшины, а также наличием участков ее повреждения. Далее клетки закрепляются в мезотелии, происходит их горизонтальное распространение по поверхности перитонеума, а затем инвазивный рост – прорастание в базальную мембрану, соединительную ткань. Следующим этапом является стимуляция неоангиогенеза – обязательного фактора развития опухоли. Морфопатогенетические механизмы формирования канцероматоза брюшины еще недостаточно изучены, в связи с чем отсутствуют радикальные методы лечения.
Частота развития канцероматоза брюшины зависит не только от первичной локализации опухоли, но и от ее размеров, глубины инвазии, гистотипа, степени дифференцировки (недифференцированный рак желудка осложняется поражением брюшины в 60% случаев, ограниченный – в 15%).
Классификация перитонельного канцероматоза
Единая классификация данного заболевания отсутствует, поскольку характеристики первичных опухолей, приводящих к поражению брюшины, весьма разнообразны. Наиболее распространена классификация перитонеального канцероматоза брюшины в зависимости от числа, локализации метастазов, которая предусматривает три степени:
Р1 – локальное поражение брюшины
Р2 – несколько областей канцероматоза, разделенных здоровыми участками брюшины
Р3 – многочисленные очаги поражения
Также используется метод определения индекса канцероматоза брюшины: суммируются баллы измерения максимальных очагов поражения (0-3 балла) в каждой из 13 наиболее вероятных областей поражения брюшины.
Симптомы перитонеального канцероматоза
Перитонеальный канцероматоз брюшины является вторичным поражением, поэтому его клиническая картина во многом определяется проявлениями первичной опухоли. Характерным признаком является обильный выпот в брюшную полость – формирование асцита. Зачастую асцитический синдром, развивающийся вследствие обструкции лимфатического дренажа, является единственным признаком заболевания, и пациенты могут поступать в отделение гастроэнтерологии или терапии для диагностики причин асцита. Состояние больных тяжелое, характерна значительная потеря веса. Неспецифическими признаками являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов возможно их прощупывание через брюшную стенку.
Диагностика перитонеального канцероматоза
Перитонельный канцероматоз имеет неспецифическую клиническую картину, однако консультация гастроэнтеролога или онколога позволяет предположить данное заболевание на основании симптомов и физикальных данных. Лабораторные анализы не выявляют специфических изменений: определяется лейкоцитоз, ускорение СОЭ. Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Информативным методом диагностики перитонеального канцероматоза является лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, сопровождающаяся биопсией. Высокой специфичностью обладает обратнотранскриптазная полимеразная цепная реакция (ОТ-ПЦР), которая позволяет определить источник диссеминации даже при малом количестве опухолевых клеток.
Сложности диагностики возникают при наличии перитонеального канцероматоза без выявленного первичного очага. Данная форма заболевания, встречающаяся в 3-5 % случаев, проявляется клинически только при уже сформировавшемся поражении брюшины. При этом первичный очаг может иметь настолько малые размеры, что его прижизненное обнаружение невозможно.
В качестве дополнительных методов может использоваться определение онкомаркеров (кислой фосфатазы, раково-эмбрионального антигена, альфа-фетопротеина, бета-субъединицы ХГЧ). Такая диагностика не обладает высокой специфичностью, но применяется для оценки прогноза, раннего выявления диссеминации, рецидивов, а также для контроля эффективности лечения.
Лечение перитонеального канцероматоза
Хирургическое лечение канцероматоза включает удаление первичной опухоли с регионарными метастазами и отсевами по брюшине. Циторедуктивная операция выполняется в объеме перитонэктомии, может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После проведения операции оценивается индекс полноты циторедукции: СС-0: после проведения хирургического лечения очаги поражения визуально не определяются; СС-1: имеются неудаленные очаги диаметром до 2,5 мм; СС-2: очаги диаметром 2,5 мм – 2,5 см; СС-3: очаги поражения более 2,5 см в диаметре. Однако даже при определении индекса СС-0 нельзя полностью исключить возможность диссеминации, поэтому обязательно проводится химиотерапия.
Эффективные подходы к лечению, как правило, подразумевают проведение комбинированной терапии, например, сочетания хирургического вмешательства и системной химиотерапии. Одним из наиболее эффективных методов является локальная химиотерапия. Идея локальной химиотерапии состоит в том, чтобы обеспечить доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Из-за крайне низкой проницаемости этой области для лекарственных препаратов, например, при внутривенном их введении или приеме в виде таблеток, доставка препаратов в виде аэрозоля под давлением углекислого газа даёт накопление препарата в опухоли в значительно больших концентрациях.
Методы лечения перитонеального канцероматоза
Длительное время канцероматоз брюшины и плевры считали терминальной стадией болезни, не подлежащей специальному лечению. Разработка методик непосредственного воздействия на брюшину и плевру позволила улучшить прогноз при этом состоянии. МНИОИ им. П.А. Герцена обладает уникальными возможностями лечения больных с канцероматозом, имея в арсенале весь комплекс новейших методов терапии.
Гипертермическая интраоперационная внутрибрюшная (внутриплевральная) химиотерапия (HITEC).
Это методика, при которой во время операции в брюшную или плевральную полость вводится подогретый до 42,5С, высококонцентрированный раствор химиотерапевтических препаратов, что обеспечивает их воздействие непосредственно на раковые клетки в брюшной (плевральной) полости при минимальном воздействии на другие органы. Сеанс проводится в течение часа, что позволяет разрушить опухолевые клетки, оставшиеся после так называемой циторедуктивной операции.
Внутрибрюшная (внутриплевральная) аэрозольная химиотерапия под давлением (PIРAC)
Это новейший инновационный метод лечения перитонеального канцероматоза, который обеспечивает доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Метод совсем недавно появился в России. Процедуру проводят посредством лапароскопии (торакоскопии). В брюшной или плевральной полости под давлением углекислого газа распыляют аэрозоль химиопрепаратов и оставляют в течение 30 мин. При таком способе введения химиопрепаратов их воздействие на опухоль многократно возрастает при полном отсутствии системной токсичности. Ноу-хау МНИОИ имени П.А. Герцена в этом методе лечения стала разработка собственной специальной форсунки, которая формирует поток мелкодисперсного аэрозоля с размером капель от 1 до 40 мкм. Изделие выполнено из специализированных материалов и не уступает по качеству импортному аналогу, а по ряду технических характеристик его превосходит.
Преимущества лечения перитонеального канцероматоза в МНИОИ имени П.А. Герцена – филиале ФГБУ «НМИЦ радиологии» Минздрава России
Операция и химиотерапия при раке яичников.
Эффективный подход в лечении рака яичников. Интервальная химиотерапия и лапароскопия. Профессор Пучков К.В.
Мой опыт лапароскопических оперативных вмешательств по поводу кист, опухолей и рака яичников составляет более 800 операций, который обобщен в многочисленных научных работах и монографиях. Регулярно по этой теме мной проводится мастер-классы для гинекологов и онкологов.
Выбор тактики лечения пациенток с раком яичников осуществляется тремя специалистами — врачом- хирургом, онкологом и химиотерапевтом, с обязательным участием грамотного морфолога.
Для бесплатно письменной консультации с целью определения вида опухоли яичника и степени поражения внутренних органов, а также выбора правильной тактики хирургического и медикаментозного лечения Вы можете прислать мне на личный электронный адрес puchkovkv@mail.ru puchkovkv@mail.ru копировать полное описание УЗИ органов малого таза и брюшной полости, данные МРТ малого таза с контрастом, результаты крови на онкомаркеры, указать возраст и основные жалобы. Тогда я смогу дать более точный ответ по вашей ситуации.
Я придерживаюсь определенной стратегии в лечении этой категории больных. Она позволяет быстро поставить правильный диагноз. Обойтись малоинвазивными методами операций и в большинстве случаев сохранить возможность женщины к беременности и родам.
Суть стратегии, которой я придерживаюсь в лечении этой категории больных
Техника лапароскопической операции при опухоли яичника
Посмотреть видео операций в исполнении профессора Пучкова К.В. Вы можете на сайте «Видео операций лучших хирургов мира».


Лапароскопическая пангистерэктомия с субтотальной резекцией большого сальника и лимфаденэктомией.
Осмотр и ревизия брюшной полости описана выше и выполняется в тоже объеме. Я, как правило, начинаю это оперативное вмешательство с удаления большого сальника. Субтотальная резекция сальника проводится по большой кривизне желудка с иссечением желудочно-ободочной и желудочно-селезеночной связок (места наиболее частого развития метастазов). Положение операционного стола меняется на Фовлера ( приподнятый головной конец стола). От ободочной кишки сальник практически по всей поверхности может быть отсечен холодным способом ножницами в без сосудистой зоне. Крайне редко необходима электрохирургия для гемостаза в зоне отдельных сосудов. В области большой кривизны желудка проходит большое количество кровеносных сосудов, поэтому самый быстрый и надежный способ пересечения желудочно ободочной связки может быть осуществлен аппаратом Force Triad «LigaSure» (Швейцария). Далее положение операционного стола меняется, опускается головной и поднимается его тазовый конец.
Вопрос о проведении аортоподвздошной и билатеральной тазовой лимфаденэктомии остается дискутабельным. По мнению одних авторов, лимфаденэктомия должна осуществляться всем больным злокачественными опухолями яичников, причем изменение оценки стадии заболевания благодаря проведению этой процедуры происходит в 13-20% случаев. Другие исследователи придерживаются мнения, что достаточно проводить биопсию забрюшинных лимфоузлов, причем частота их поражения при изначально установленной 1 стадии процесса составляет 4,2%. Третья группа авторов считает, что биопсия лимфоузлов должна осуществляться только при низко дифференцированных новообразованиях 1 стадии. Я в данной ситуации поступаю следующим образом. Если при первичной операции я обнаруживаю метастазы в парааортальные лимфоузлы ( по данным гистологического исследования), то на втором этапе я обязательно выполняю лимфаденэктомию. Если нет, то все зависит от стадии и дифференцировки опухоли. Если пангистерэктомия проводится во время первой операции, то я стараюсь выполнять лимфаденэктомию всегда. На следующем этапе операции я выполняю пангистерэктомию, используя для диссекции связочного аппарата матки и лигирования маточных сосудов инструмент «LigaSure» (Швейцария).
После пангистерэктомии, извлечение макропрепаратов сальника, лимфоузлов и матки из брюшной полости осуществляется в пластиковом контейнере трансвагинальным доступом.
Затем я обязательно тщательно послойно ушиваю стенки влагалища и связки тазового дна эндоскопическим способом, используя рассасывающиеся нити Монокрил 0 на атравматичной игле. Этот этап очень важен для профилактики опущения стенок влагалища и мочевого пузыря в послеоперационном периоде.
Следует отметить, что по данным литературы последних лет, мнение ученых о значимости интраоперационного нарушения целостности опухоли изменилось. E.Surwit (1994), W.Parker и J.Berek (1993) не отметили ухудшения прогноза из-за ятрогенного разрыва интактной капсулы злокачественной опухоли яичника. Авторы полагают, что частота рецидивов определяется лишь наличием плотных спаек, дифференцировкой опухоли и большим количеством асцитической жидкости. F.Y.Ahmed (1996), S.Kodama и K.Tanaka (1997) указывают, что наличие асцита, спаек, дооперационный разрыв капсулы опухоли и уровень СА-125 влияют на прогноз заболевания, в то время как нарушение целостности новообразования или пункция опухоли во время проведения хирургического вмешательства оказываются прогностически незначимыми.
Несмотря на представленные литературные данные, все манипуляции с кистой и опухолью, я выполняю в специальном контейнере (20х20 см). Поэтому в случае случайной перфорация стенки, это происходит в контейнере без контаминации брюшной полости, то есть в условиях полной абластики.
Всем пациенткам после удаления препарата необходимо выполнять гистологическое исследование для стадирования онкологического процесса.
Исходя из моего длительного опыта (22 года) и многочисленных данных литературы, лапароскопический доступ имеет ряд преимуществ в сравнении с традиционным, сохраняя при этом основные онкологические принципы выполнения оперативных вмешательств. При лапароскопии отмечается лучшая визуализация операционного поля за счет достаточного освещения и оптического увеличения, более тщательная диссекция сосудистых структур, более тщательный гемостаз, уменьшение болевого синдрома в послеоперационном периоде, полное отсутствие лимфореи, сокращение сроков реабилитации. Эти преимущества позволяют в случае постановки диагноза рака яичника своевременно начать химиотерапию, что существенно сказывается на результатах лечения этой категории больных.
Высокая квалификация хирурга, четкое понимание стоящих перед ним задач при первичном выявлении злокачественной опухоли любой локализации и новообразований яичников в частности, позволяет выполнить адекватный объем оперативного вмешательства, тщательную ревизию брюшной полости и правильное стадирование онкологического процесса, что помогает избавить пациентку от нередко существенно отсроченной по времени повторной операции. В связи с этим чрезвычайно актуальным остается вопрос определения адекватной тактики хирурга во время операции, так как от грамотности его действий зависит прогноз дальнейшего лечения и судьба больной.
Средняя длительность оперативного вмешательства составляет 1-1,5 часа. На следующий день пациентки встают с постели и принимают жидкую пищу. Выписываются на 2-3 сутки. На 7 сутки проходят контрольный осмотр на кресле, при необходимости выполняется Узи органов малого таза и брюшной полости.
Обязательно данные гистологического исследования обсуждаются с врачами смежных специальностей (онколог, химиотерапевт, радиолог) для определения оптимальной тактики дальнейшего лечения.
При необходимости, по желанию пациента, курсы химиотерапии могут быть проведены в Швейцарской университетской клиники под контролем опытных онкологов.