триперекись ацетона что это такое
Пероксид ацетона
| Пероксид ацетона | |
 | |
 | |
| Общие | |
|---|---|
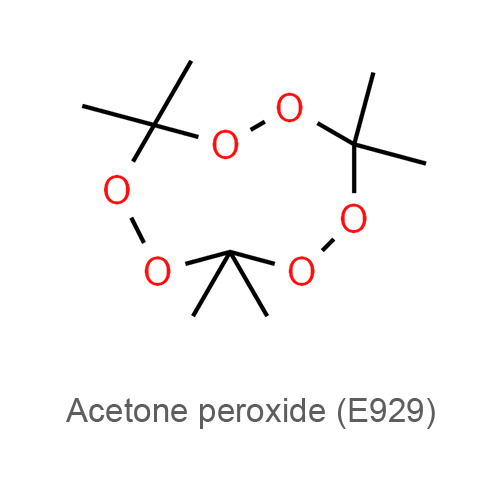
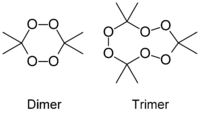
| Систематическое наименование | 3,3,6,6-тетраметил-1,2,4,5-тетраоксан (димер) 3,3,6,6,9,9-гексаметил-1,2,4, 5,7,8-гексаоксациклононан (тример) |
| Химическая формула | C6H12O4 (димер) C9H18O6 (тример) |
| Физические свойства | |
| Молярная масса | (димер) 148,157 г/моль (тример) 222,24 г/моль |
| Термические свойства | |
| Температура плавления | 91 °C |
| Температура кипения | 97–160 °C |
| Классификация | |
| Рег. номер CAS | 17088-37-8 |
| SMILES | CC1(OOC(OOC(OO1)(C)C)(C)C)C |
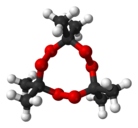
Пероксид ацетона (перекись ацетона, триперекись ацетона, диперекись ацетона, трициклоацетонпероксид, ТА, ДА, ТЦАП, киса, (3,3,6,6,9,9-гексаметил-1,2,4,5,7,8-гексаоксонан)) — инициирующее взрывчатое вещество, впервые получено в 1885 году Вольфенштейном. Существует в виде тримера и димера. Иногда можно встретить утверждения о существовании мономера и полимера, однако достоверные подтверждения этого неизвестны. В большинстве случаев образуется триперекись, иногда с небольшими примесями диперекиси. Чистая диперекись получается лишь при использовании специальных кислот. Часто можно встретить ошибку, когда триперекись называют диперекисью. Название «киса» является жаргонным, произошло, по всей видимости, от «перекись ацетона», или из-за сильной чувствительности к трению («против шерсти лучше не гладить»).
Содержание
Физические свойства
Представляет собой мелкодисперсное вещество, похожее на муку. После многомесячного хранения или перекристаллизации из растворителя образуются крупные прозрачно-белые кристаллы неправильной формы. Вещество практически нерастворимо в воде, растворимо в ацетоне, эфире. Температура плавления триперекиси — 97 °С, диперекиси — 132 °С.
При комнатной температуре улетучивается с разложением, в открытом сосуде большие количества перекиси могут полностью испариться за десятки минут. При хранении даже в приоткрытом сосуде происходит кристаллизация из паров, что ведёт к росту высокочувствительных кристаллов.
Взрывчатые свойства
Скорость детонации при плотности 0,92 г/см³ — 3750 м/с, 1,2 г/см³ — 5290 м/с. Способна к перепрессовке, то есть спрессованная под давлением около 2000 кгс/см² уже горит, а не детонирует.
По бризантности превосходит азид свинца и ГМТД, по инициирующей способности превосходит гремучую ртуть, но уступает ГМТД и азиду свинца.
Инициирующая способность для тетрила 0,09;г, для тротила 0,18;г.
Уравнение взрывчатого разложения:
Небольшие количества на открытой поверхности сгорают большим, объёмным пламенем, с глухим звуком хлопка. В количествах более 10 г и/или запрессованная в бумажный корпус оглушительно детонирует.
Не взаимодействует с большинством металлов, однако свинец является катализатором разложения перекисей и может привести к самоподрыву, поэтому контакт перекисей ацетона с ним опасен. Соли переходных металлов (железо, хром, марганец) также являются катализаторами разложения перекиси ацетона.
Получение
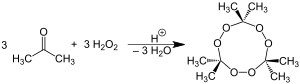
Перекись ацетона получают путём воздействия пероксида водорода на ацетон в кислой среде. Реакция отличается малой требовательностью к условиям. Для получения кислой среды используются разнообразные минеральные кислоты. Как правило, рекомендуется использование соляной кислоты, однако реакция идёт и при использовании азотной, ортофосфорной, серной, надсерной и других кислот. В случае использования серной кислоты образуется триперекись с примесями диперекиси, в случае надсерной кислоты — диперекись. В остальных случаях образуется триперекись ацетона
Применение
C 9 H 18 O 6 (тример)
C 12 H 24 O 8 (тетрамер)
222,24 г / моль (тример)
91 ° C (тример)
17 384 фут / с
3,29 миль в секунду
СОДЕРЖАНИЕ
История
Работа над этой методологией и над различными полученными продуктами была дополнительно исследована в середине 20 века Миласом и Голубовичем.
Химия
Продукт, полученный с использованием соляной кислоты, считается более стабильным, чем продукт, полученный с использованием серной кислоты. Известно, что следы серной кислоты, захваченные внутри образовавшихся кристаллов пероксида ацетона, приводят к нестабильности. Фактически, захваченная серная кислота может вызывать детонацию при температурах до 50 ° C (122 ° F), это наиболее вероятный механизм случайных взрывов пероксида ацетона, которые происходят во время сушки на нагретых поверхностях.
Трипероксид триацетона образуется в 2-пропаноле при длительном стоянии на воздухе.
Для анализа следов ТАТФ можно использовать несколько методов, включая газовую хроматографию / масс-спектрометрию (ГХ / МС), высокоэффективную жидкостную хроматографию / масс-спектрометрию (ВЭЖХ / МС) и ВЭЖХ с дериватизацией после колонки.
Пероксид ацетона растворим в толуоле, хлороформе, ацетоне, дихлорметане и метаноле. Перекристаллизация первичных взрывчатых веществ может давать большие кристаллы, которые самопроизвольно взрываются из-за внутренней деформации.
Промышленное использование
Перекись ацетона используется в качестве отбеливателя муки для отбеливания и «зрелой» муки.
Использование в самодельных взрывных устройствах
Избыточное давление ударной волны ТАТФ составляет 70% от давления ТНТ, импульс положительной фазы составляет 55% от эквивалента ТНТ. ТАТФ при 0,4 г / см 3 имеет примерно одну треть бризантности TNT (1,2 г / см 3 ), измеренной с помощью теста Гесса.
В Европейском Союзе приняты законодательные меры по ограничению продажи концентрированной перекиси водорода до 12% и выше.
Е929 пищевая добавка
Описание
Пищевая добавка Е929 (пероксид ацетона) — относится к улучшителям муки и хлеба синтетического происхождения, используется в технологических целях в процессе производства пищевых продуктов. Пероксид ацетона — обладает высокими отбеливающими и окислительными свойствами. Внешне выглядит как мелкодисперсный порошок, после длительного хранения — кристаллы правильной формы. Имеет резкий характерный запах, вкус отсутствует. Хорошо растворим в эфире, бензоле, ацетоне, уксусной кислоте, нерастворим в воде.
Не гигроскопичен. При обычных условиях хранения не разлагается; обладает повышенной летучестью, при комнатной температуре испаряется в течение 2 часов; при нагревании с раствором серной кислоты распадается до ацетона и перекиси водорода; устойчива в кислотных и щелочных растворах; не корродирует металлы (исключение — свинец); проявляет окислительные свойства; плавится при температуре 97 °C. Взрывоопасен!
Получают при взаимодействии ацетона с концентрированным пероксидом водорода. Реакция протекает в присутствии минеральной одноосновной кислоты: серной (чаще всего), азотной, соляной. Молекула содержит обычно 2 или 3 пероксидные группы. Легче получить триперекись ацетона, но и она будет содержать димер в качестве примеси.
Польза
Научные данные о пользе применения пищевой добавки Е929 для здоровья человека в настоящий момент отсутствуют. Биологической ценности не представляет.
Вдыхание порошка и паров перекиси ацетона может вызвать отёк слизистых, поражение дыхательных путей.
При работе с перекисью ацетона необходимо соблюдать технику безопасности. Вещество отличается высокой взрывчатой силой: 5 500 кДж/кг (это почти на 20 % выше того же показателя для тринитротолуола, входящего в состав динамита). Сухой порошок может сдетонировать при лёгком нагреве (например, при сушке на батарее отопления) или от искры статического электричества, образующего на одежде.
Применение
Ранее применялся для для отбеливания и улучшения качества хлебопекарной муки. По состоянию на 2019 год пищевая добавка Е929 практически не используется с этой целью, вместо него применяются другие улучшители.
Другие сферы применения: военная промышленность.
Правовой статус
Пищевая добавка Е929 не входит в перечень разрешённых к применению в пищевой промышленности в Российской Федерации, Евросоюзе и большинстве стран мира.
Характеристика
Схема
Поделиться этой страницей
Подробнее по теме
Ознакомьтесь с дополнительной информацией о пищевой добавке E929:
Триперекись ацетона что это такое
Что такое перекись ацетона?
Строение молекулы перекиси водорода
Перекись водорода (3% раствор)
Цистерна с перекисью водорода
Перекись водорода проявляет окислительные свойства. Некоторые горючие органические материалы (например, бумага, солома, метанол) при контакте с крепкой перекисью водорода могут воспламеняться. От действия 30% раствора перекиси водорода кожа и волосы человека становятся белыми. Разбавленные водные растворы перекиси водорода гораздо более стабильны. Трехпроцентная перекись водорода продается в аптеках как антисептик.
Другие неорганические перекиси также проявляют окислительные свойства, многие из них довольно неустойчивы и легко отщепляют кислород.
Однако, некоторые неорганические перекиси достаточно стабильны. Например, перекись натрия Na2O2 образуется при горении натрия на воздухе. Данное вещество плавится без разложения при 675°C. Более того: при нагревании оксида натрия Na2O на воздухе образуется пероксид Na2O2.
Если в перекиси водорода Н-О-О-Н заместить один или оба атома водорода на органический радикал R, то мы получим органические гидроперекиси R-О-О-Н и перекиси R-О-О-R соответственно.
Органические гидроперекиси
Органические перекиси
Органические перекиси неустойчивы и легко разлагаются, иногда разложение происходит со взрывом. Например, перекись ацетона и перекись бензоила при нагревании взрываются.
Молекулы органических перекисей способны распадаться, образуя свободные радикалы. Некоторые перекиси используют в промышленности как инициаторы радикальной полимеризации (перекись бензоила, перекись метилэтилкетона).
Органические пероксопроизводные очень разнообразны, в частности, существуют перекиси, которые являются производными карбоновых кислот RC(O)OOH (пероксокислоты или надкислоты), сложных эфиров RC(O)OOR, альдегидов.
Пероксокислоты (надкислоты)
Пероксопроизводные сложных эфиров
Диперекись и триперекись ацетона
В большинстве случаев при осаждении из водных растворов образуется триперекись ацетона, однако, нельзя исключить, что она не содержит примеси диперекиси. Диперекись ацетона получить гораздо сложнее, чем триперекись: для этого необходимо проводить синтез в строго определенных условиях (методика получения диперекиси изложена в приложении ко второй части статьи, однако она дается в основном для ознакомления).
Есть также сообщение о получении тетраперекиси ацетона (ссылка), однако относиться к таким статьям следует с большой осторожностью: много подобных открытий было со временем опровергнуто.
Перекись ацетона представляет собой белое кристаллическое вещество. Практически нерастворима в воде, растворима в ацетоне, эфире. Температура плавления триперекиси 97 °C, диперекиси 132 °C. Даже при комнатной температуре перекись ацетона легко сублимируется.
С другой стороны, перекись ацетона окружена своеобразным ореолом таинственности, в результате находится немало молодых людей, которые хотят познакомиться с этим веществом поближе, не всегда осознавая опасности.
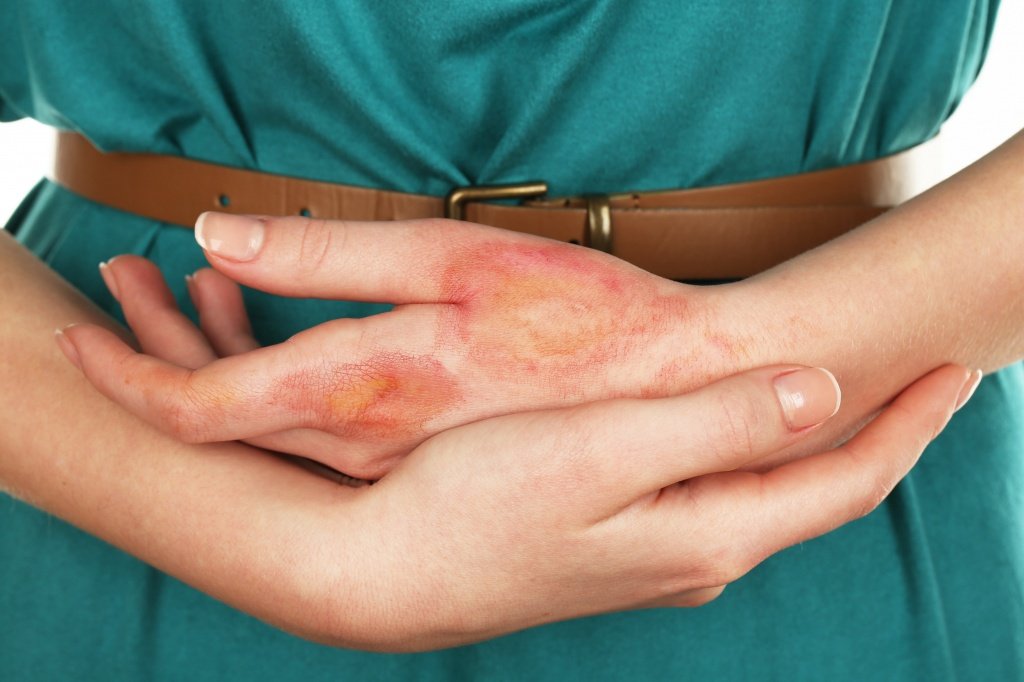
Химический ожог
Химический ожог — повреждение кожи внешних частей тела и слизистых оболочек органов дыхания и пищеварения в результате воздействия агрессивных химических веществ: щелочей, тяжелых металлов, кислот. Ожог глотки, пищевода, ротовой полости развивается при попадании высококонцентрированных растворов химикатов внутрь, и чаще связан с попыткой суицида. Ожог кожи вызывает неосторожное обращение с токсикантами в быту и на производстве. Незначительные поверхностные ожоги легкой степени тяжести не угрожают здоровью, лечение проходит в амбулаторных и домашних условиях. Обширные ожоги и ожоги внутренних органов опасны осложнениями со стороны органов дыхания, сердечно-сосудистой, нервной систем, инвалидизацией, летальным исходом.
Причины и симптомы
Химический ожог связан с воздействием высококонцентрированных агрессивных соединений на кожные покровы, слизистые оболочки. Основная причина ожогового повреждения кожи, глаз — случайный или преднамеренный контакт с химическими веществами, несоблюдение техники безопасности в быту и на производстве, ошибки выбора средств, использование хлорсодержащих моющих веществ.
При попадании токсикантов на кожу или в глаза развивается колликвационный некроз — ткань расплавляется, становится дряблой, влажной, вокруг образуется отек, покраснение, гнойный инфильтрат. Существует риск присоединения вторичной инфекции.
На месте ожога появляется участок влажного некроза, покрытый белой или черной корочкой (струпом). После отторжения струпа формируется язва, затем рубец. Сколько времени займет заживление ожога, зависит от химического вещества, площади и глубины повреждения.
Химические ожоги слизистых оболочек глотки, гортани, пищевода и желудка возникают после вдыхания токсических паров или приема внутрь химических веществ. Основная причина — ошибочное или сознательное проглатывание токсикантов, нетрадиционное лечение, прием суррогатов алкоголя.
Агрессивные компоненты попадают на слизистые оболочки ротовой полости, глотки, пищевода, и повреждают эпителий, провоцируют некробиоз — необратимую гибель клеток.
При воздействии малых доз токсикантов появляются только признаки химического раздражения и слабо-выраженная интоксикация:
болезненность в области живота,
жжение и першение в горле,
При тяжелых ожогах глотки, пищевода патологический процесс затрагивает не только слизистые оболочки, но и подслизистый и мышечный слой. Химические вещества проникают в глубокие слои, разрушают эритроциты, развивается диссеминированное сосудистое свертывание (ДВС-синдром) — массивное внутреннее кровотечение.
Справка! Щелочи вызывают более выраженный ожог желудка, кислоты — пищевода.
На стадии восстановления и регенерации происходит отторжение некротизированной ткани, восстанавливается здоровая слизистая оболочка, на месте некроза формируется рубец. При выраженных ожогах внутренних органов полное выздоровление не наступает — образуется стеноз, пациент страдает хроническими воспалительными заболеваниями.
Вещества, вызывающие ожог
Химический ожог провоцируют разные химические вещества:
щелочи: едкий натрий, гидроокись натрия, каустическая сода;
концентрированные кислоты: уксусная, соляная, серная;
другие вещества: перекись водорода, йод, нашатырный спирт, ацетон, силикатный клей, марганцовка, фенол;
бытовые чистящие средства;
Более 85% химических повреждений глотки и пищевода у взрослых вызывает прием уксусной кислоты, у детей — перманганат калия.
Справка! Большинство пациентов с ожогами пищевода — дети в возрасте до 10 лет. Прием токсикантов происходит непреднамеренно, а из-за рассеянности детей, природной любознательности, невнимательности родителей.
Классификация
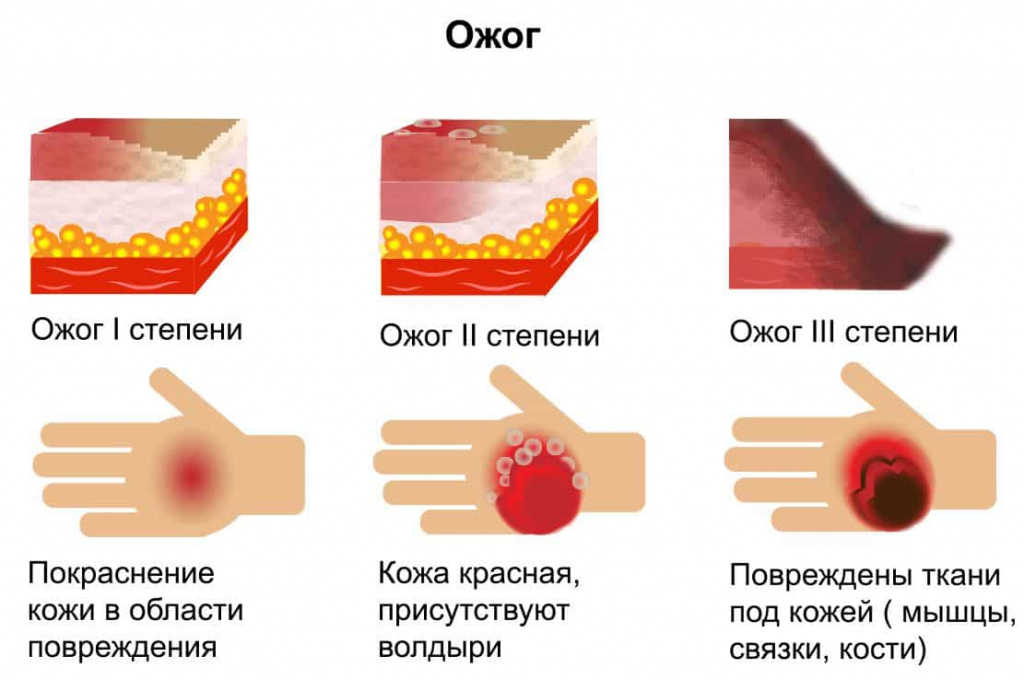
С учетом глубины химического поражения, клинической картины выделяют три степени ожогов кожи:
I степень. Неполное повреждение кожных покровов или поверхностного слоя эпителия, вызванное кратковременным или слабым по интенсивности воздействующим веществом. Местные признаки — ограниченный отек, покраснение кожи, ощущение жжения и локальная боль. Заживление наступает на 3–5 стуки самостоятельно без образования рубцов.
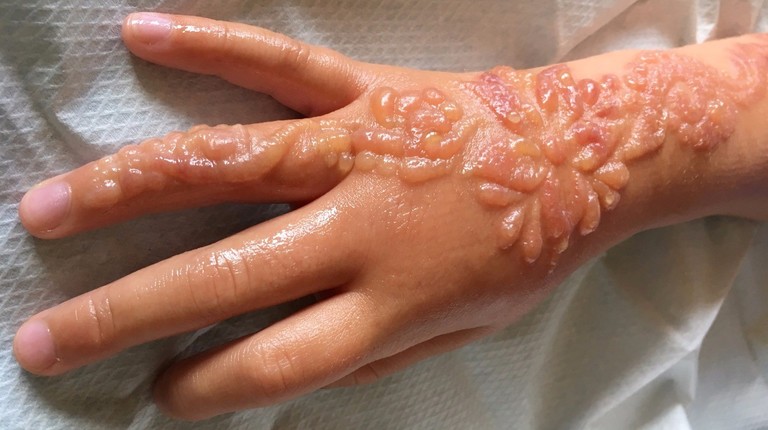
II степень. Сопровождается повреждением эпидермиса, с образованием волдырей, заполненных жидким прозрачным содержимым. Через 2–3 дня жидкость становится густой и желеобразной. Боль, припухлость и покраснение в месте повреждения более выражены. Восстановление тканей продолжается в течение 12–15 дней. Возрастает угроза инфицирования.
III степень. Определяют при повреждении нижних и поверхностных слоев кожи. Бывает двух видов: III степень А — клетки самого глубокого базального слоя сохранены, III степень Б — происходит омертвение всей толщи кожи и внутреннего слоя. На месте ожога образуется участок влажного некроза, покрытый корочкой. Отторжение корочек происходит через 10–15 дней, а полное заживление ожоговой травмы — 1–2 месяца. В месте повреждения кожи образуется грубый рубец.
При химическом повреждении слизистых оболочек органов респираторной и пищеварительной систем также выделяют три степени тяжести:
легкая— повреждение поверхностного слоя эпителия;
средняя — поражение до уровня слизистого слоя;
тяжелая — травмирование слизистой оболочки и нижерасположенных тканей на различную глубину.
В зависимости от распространения патологического процесса ожоги бывают изолированные и комбинированные.
Осложнения химических ожогов
Обширные и глубокие местные ожоговые травмы приводят к развитию ожоговой болезни, которая сопровождается нарушением водно-солевого баланса, расстройством кровообращения, истощением иммунной системы, интоксикацией.
При прогрессирующих ожогах возникают различные осложнения:
парез кишечника — паралич мускулатуры кишечной стенки;
миокардит — воспаление в мышечной оболочке сердца;
перикардит — воспаление наружной сердечной оболочки;
гломерулонефрит — иммуновоспалительная болезнь почек,
пиелит — воспаление в почечной лоханке.
Поражение глубоких тканей отягощается образованием ограниченных или разлитых гнойно-воспалительных изменений в мышцах, подкожно-жировой клетчатке, возникновением сепсиса, артрита. К нежелательным последствиям ожогов относят формирование грубых неэластичных рубцов.
Справка! Воздействие любого физического и химического фактора, который у взрослого вызывает неполное повреждение поверхностного слоя кожи, у детей приводит к глубокой травме.
Ожоги глаз, пищевода, респираторного тракта протекают тяжелее, нарушают важные жизненные функции.
Среди осложнений химического повреждения органов дыхания и пищеварения наиболее часто встречаются:
отек гортани и глотки,
стеноз гортани — сужение просвета,
При химическом поражении глубоких слоев слизистой и подслизистой оболочек, токсические вещества попадают в системный кровоток, и вызывают поражение печени, почек, головного мозга.
К исходам тяжелых ожогов глаз относят снижение зрительной функции, атрофию глазного яблока, образования бельма.
Первая помощь при химическом ожоге
От того, насколько своевременно и грамотно были оказаны меры срочной помощи пострадавшему, зависит дальнейший прогноз ожоговой травмы.
Как оказать неотложную помощь:
Ограничить контакт человека с химическим веществом.
Обожженное место обильно промыть водой, слабо концентрированным раствором соды или лимонной кислоты.
Свежую рану нельзя обрабатывать мазью, кремом, спреем, растительным маслом, самостоятельно вскрывать пузыри.
При неглубоких ожогах ограниченных малой площадью, аккуратно снять одежду, наложить стерильную повязку или забинтовать.
При ожогах 3 степени пострадавшего укутать в чистую простыню, дать обезболивающее, вызвать неотложную помощь или доставить в специализированное медицинское учреждение самостоятельно.
До приезда скорой помощи важно отпаивать теплой водой, чтобы не допустить обезвоживания.
Ожог глаз
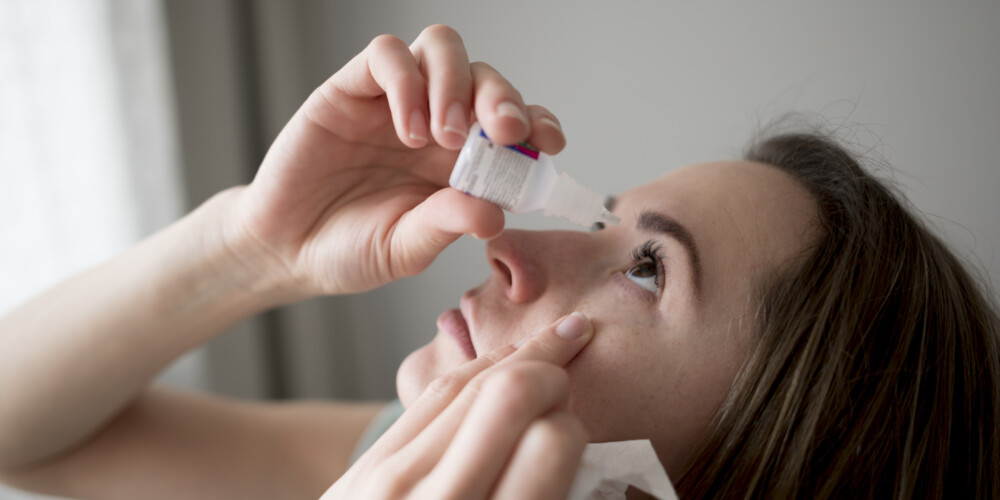
Первую помощь при химическом ожоге глаз важно оказать на месте.
Промыть конъюнктивную полость водой или физраствором.
Удалить гной и слизь, остатки химических веществ.
Промыть слезно-носовой канал физиологическим раствором.
Закапать или наложить в конъюнктивную полость антисептический препарат.
Категорически противопоказано самостоятельно использовать нейтрализующие растворы, так как тяжело спрогнозировать реакцию веществ на поврежденную ткань.
Ожог пищевода и глотки
Первую помощь оказывают на догоспитальном этапе либо в отделении реанимации. Для нейтрализации кислот используют содовый раствор, щелочей — слабоконцентрированный раствор уксусной кислоты с маслом. Если точно не известен токсикант, ротовую полость промывают большим количеством чистой воды комнатной температуры, дают выпить два стакана молока.
Важно! Промывание выполняют только в первые 5–6 часов после получения ожога, потом процедура нецелесообразна.
Что нельзя делать при химическом ожоге
При проглатывании агрессивных химических соединений категорически запрещено вызывать рвоту, так как возрастает риск разрыва пищевода. Нельзя давать активированный уголь — твердые таблетки дополнительно травмируют пищевод.
Не стоит полностью укладывать пострадавшего, чтобы не спровоцировать гастроэзофагеальную рефлюксную болезнь — обратный заброс содержимого желудка. Оптимальное положение — полусидячее.
Лечение химического ожога
Как лечить химический ожог зависит от глубины и площади повреждения. Ожоги 1–2 степени — поверхностные, и могут зажить самостоятельно. При прогрессирующем повреждении тканей необходима квалифицированная медицинская помощь, удаление омертвевших тканей с последующей коррекцией рубцов. Лечение ожогов выполняют в специальных ожоговых палатах.
На первом этапе проводят обработку ожоговой поверхности, чтобы предотвратить проникновение инфекции в организм:
Обрабатывают кожу вокруг ожоговой поверхности антисептиком.
Удаляют загрязнения, остатки токсикантов, большие пузыри вскрывают и опорожняют, рану заливают раствором перекиси, подсушивают.
Сверху наносят мазь, крем или спрей.
При обширных и глубоких поражениях обработку ожоговых ран выполняют под анестезией.
Раневую поверхность защищают повязкой или оставляют открытой.
На первых этапах восстановления тканей используют мази, растворы и аэрозоли с обезболивающим, охлаждающим и заживляющим действием. При наличии струпа, его не снимают, оставляют до самостоятельного отторжения. На раневую поверхность наносят растворы с воском и парафином, чтобы не повредить растущий эпителий при перевязках. Салициловая мазь и протеазы расщепляют образовавшуюся при тяжелых ожогах сухую корочку.
На втором и третьем этапе назначают препараты для активизации обмена веществ, улучшения кровообращения, защиты от инфекций.
При глубоких ожогах и больших площадях повреждения тканей человек утрачивает много жидкости и солей. Чтобы возместить потери белка и воды, предупредить обезвоживание, нормализовать кислотно-щелочной баланс через капельницу вводят питательные растворы, глюкозу, хлорид натрия.
Лечение ожога пищевода
Для удаления раздражающего вещества устанавливают желудочный зонд, обработанный вазелином, и промывают желудок антидотом — водой, содовым раствором, неконцентрированным раствором уксуса и масла. Предварительно проводят обезболивание.
Для профилактики инфицирования вводят антибиотик. Далее с учетом состояния пациента назначают обезболивающую, противошоковую, дезинтоксикационную терапию.
В подострой фазе через 7–10 дней ежедневно выполняют бужирование пищевода — расширение просвета с помощью эндоскопического прибора. Процедура позволяет нормализовать проходимость органа, уменьшить рубцевание. При стенозе и полной непроходимости пищевода, образовании грубых рубцов в плановом порядке проводят оперативное лечение.
Лечение ожога глаз
В стационаре пациенту в конъюнктивальную полость вводят антихолинергические капли. Они хорошо обезболивают, минимизируют риск образования спаек. Для профилактики инфицирования используют антибактериальные мази или капли. Внутримышечно вводят антиоксиданты. При повышенном внутриглазном давлении назначают гипотензивные препараты.
При ожогах глаз тяжелой степени подключают гормональную терапию — субконъюнктивальные инъекции (в область переходной складки конъюнктивы) и парабульбарные (через кожу нижнего века в край глазницы).
В сочетании с фармакотерапией хороший эффект оказывает массаж век, физиотерапия. При угрозе потери зрения в раннем периоде проводят оперативное лечение на веках, глазном яблоке, конъюнктиве, роговице.