тонкая эндометрия матки что делать
ЭКО при тонком эндометрии. Как увеличить шансы на зачатие?
Подготовка женского организма к долгожданной беременности.
Можно ли забеременеть при помощи ЭКО, если поставлен диагноз гипоплазия эндометрия? В этой статье расскажем что учесть при планировании беременности, об эффективности ЭКО, причинах и признаках возникновения тонкого эндометрия, что может помочь нарастить толщину эндометрия.
Роль эндометрия в процессе наступления беременности чрезвычайно важна. От состояния этого маточного слоя зависит, сможет ли оплодотворенная яйцеклетка закрепиться в матке и произойдет ли зарождение новой жизни.
Именно истончение (или гипоплазия) эндометрия очень часто становится причиной того, что женщина не может забеременеть в естественном цикле зачатия, а также снижает шансы на успех при проведении процедур ЭКО.
Тонкий эндометрий при планировании беременности: почему на это стоит обратить внимание?
На протяжении всего менструального цикла состояние эндометрия меняется, что связано с выработкой женских половых гормонов. С началом менструации большая часть эндометрия сходит, оголяя базальный слой, и выводится из матки. Когда месячные заканчиваются, запускается процесс подготовки к имплантации эмбриона: начинается активное деление клеток базального слоя, ткань эндометрия утолщается, усиливается кровоснабжение матки.
Оплодотворенная яйцеклетка погружается в восстановленный слизистый слой матки, освобождается от оболочки и запускает процессы активного роста сосудов и образования плаценты. Утолщение эпителия происходит под воздействием определенных гормонов.
Как показывают исследования (К. Г. Сребренникова и другие. Прегравидарная подготовка у пациенток с тонким эндометрием в программах вспомогательных репродуктивных технологий. Акушерство и гинекология, No3,2017), оптимальная толщина эндометрия для успешного зачатия и вынашивания ребенка может колебаться от 8 до 12 мм. Слой меньше 8 мм считается «прогностически неблагоприятным фактором в отношении наступления и исхода беременности в циклах ВРТ, в частности ранней потери беременности и высокой частоты внематочной беременности».
Причины тонкого эндометрия: что может привести к гипоплазии?
Причин нарушения нормального роста слизистой может быть множество:
Чтобы лучше понимать, каким образом эти факторы влияют на функциональность эндометрия, еще раз вернемся к механизму его роста. Как сказано выше, на «утолщение» слоя влияют половые гормоны, а именно, эстрогены, вырабатываемые фолликулами. В ходе фолликулярной фазы цикла выделяется доминантный фолликул, созревание которого сопровождается ростом уровня эстрогенов (как следствие, утолщением эндометрия).
Если процесс фолликулогенеза и овуляции нарушен, происходит сбой и в формировании «правильного» слоя слизистой. Это самая частая причина тонкого эндометрия, для её устранения нужно, прежде всего, выяснить источник проблемы. К примеру, созревание доминантного фолликула может тормозиться высоким уровнем пролактина. В этом случае необходимо восстановление баланса пролактина, а не прием препаратов с эстрогенами.
Вторая по частоте причина недостаточной толщины эндометрия – травмы, нанесенные базальному слою в процессе хирургических манипуляций. Диагностическое выскабливание или чистку матки врачи не контролируют визуально, полагаясь только на свои ощущения. А эндометрий – очень тонкая структура, которую легко повредить во время подобной процедуры, причем повреждения могут быть достаточно глубокие. В этом случае нужно уделить внимание всем возможным причинам, мешающим закреплению зародыша – иммунологическим, биохимическим и так далее.
Нарушение кровообращения в органах малого таза ухудшает кровоснабжение матки, что приводит к плохому снабжению кровью растущего эндометрия. Попутно происходит сбой в выработке питательных веществ, нужных для развития эмбриона.
Тонкий эндометрий матки: как распознать проблему?
Как правило, контроль состояния эндометрия проводится с помощью УЗИ. Процедура обязательна, если установлен диагноз бесплодие или беременность прервалась на ранних сроках. На проблемы при зачатии, связанные с состоянием эндометрия, могут указывать:
Гипоплазия эндометрия – одна из самых распространенных проблем у женщин детородного возраста. И оттягивать её решение не стоит, если пара хочет завести детей.
Можно ли нарастить эндометрий? Методы лечения тонкого эндометрия
Итак, тонкий эндометрий – не причина, а следствие каких-то изменений в организме. Поэтому и лечение должно быть направлено, прежде всего, на истинный источник патологии.
Для лучшего прилива крови к органам малого таза применяется гирудотерапия или иглоукалывание. При эндокринной природе гипоплазии эндометрия назначают препараты, которые нормализуют гормональный баланс. В некоторых случаях могут назначаться комбинированные оральные контрацептивы, курс эстрадиола, прогестеронсодержащие препараты (Утрожестан, Дюфастон).
Хорошие результаты может дать комплексная терапия – гормональная стимуляция с применением комплекса Прегнотон. Прегнотон – негормональный комплекс, в состав которого входят витамины, минералы, аминокислоты, а также экстракт растения витекс священный.
Применение Прегнотона в программах подготовки к ЭКО у женщин с диагнозом «тонкий эндометрий» может помочь добиться оптимальных показателей толщины эндометрия для успешной имплантации эмбриона и потенциально увеличить процент наступления беременности.
Более того, препарат может помочь увеличить количество зрелых яйцеклеток и пригодных для переноса эмбрионов, а также сгладить негативные последствия операций на женских репродуктивных органах, так как хирургические вмешательства часто приводят к снижению способности к зачатию и ухудшению работы репродуктивной системы.
Важно помнить, что большинство случаев гипоплазии эндометрия хорошо поддается коррекции. Поэтому затягивать с решением этой проблемы, если пара планирует ребенка, не стоит.
Тонкий эндометрий и возможности физиотерапевтического лечения
Проблема так называемого маточного фактора бесплодия не потеряла своей акутальности в наше время. С уточнением причин неудавшейся имплантации эмбрионов сталкивается практически каждая третья супружеская пара, обратившись в клинику репродукции. Прикрепление эмбриона к слизистой тела матки (эндометрию) многофакторный процесс Одной из важных причин, определяющих успех наступления беременности, является качество эндометрия, которое характеризуется его структурой, толщиной, наличием признаков воспалительного процесса.
Считается, что одним из косвенных признаков неблагополучия эндометрия является его толщина и кровоснабжение в маточных и спиральных артериях в период, совпадающий по дням с потенциально возможным переносом эмбрионов в полость матки. Оптимальным периодом для оценки состояния эндометрия являются несколько дней после овуляции. В это время проводится ультразвуковое исследования с допплерометрической оценкой кровотока.
До 15% женщин сталкиваются с проблемой тонкого эндометрия, когда его толщина составляет менее 7мм в период «имплантационного окна»- дни, когда условия прикрепления эмбриона оптимальны.
Повышение шансов на наступление беременности, возможно благодаря проведению физиотерапевтического лечения с помощью аппарата «Андро-Гин». Физиотерапия оказывает противовоспалительное, сосудорасширяющее, обезболивающе действие и улучшает питания тканей эндометрия, что повышает толщину эндометрия.
Также в современных условиях для подготовки эндометрия применяются электрофорез с различными лекарственными препаратами, гальванические и синусмодулирующие токи.
Каждая процедура должна быть подобрана индивидуально для каждой пациентки, в зависимости от наличия сопутствующих гинекологических заболеваний. Максимального успеха в решении проблемы тонкого эндометрия возможно достичь путем комплексного подхода, применяя не только физиотерапевтическое лечение, но и антибактериальные, гормональные, имуномодулирующие, кроверазжижающие препараты. Врач гинеколог-репродуктолог составит индивидуальный план комплексной терапии в вашем конкретном случае.
Показания к физиотерапевтическому лечению:
Тонкий эндометрий (по данным УЗИ толщина эндометрия менее 7мм во вторую фазу менструального цикла).
Подготовка к криопереносу эмбрионов при неудачных попытках ЭКО.
Подготовка полости матки перед проведением донорских программ.
Реабилитация после внутриматочных вмешательств.
Уважаемые пациенты! В условиях нашей клиники есть возможность проведения полного курса физиотерапевтической подготовки эндометрия к программам вспомогательных репродуктивных технологий, что безусловно повысит шансы для достижения беременности. Новейшее оборудование и современные клинические подходы в лечении помогут преодолеть проблемы с репродуктивным здоровьем!
Подготовка эндометрия к ЭКО: как подготовить слизистую к имплантации?
Эндометрий – слизистая оболочка, выстилающая внутриматочную полость и играющая важную роль в протекании беременности. Именно в этом слое закрепляется оплодотворенная яйцеклетка, из него же частично образуется плацента, а эндометриальные кровеносные сосуды участвуют в кровоснабжении плода. Здоровое состояние эндометрия перед ЭКО – один из важнейших факторов наступления беременности, поэтому для успешного экстракорпорального оплодотворения его нужно подготовить.
Почему нужно подготавливать эндометрий перед ЭКО?
Эндометрий – гормонозависимая ткань, чья толщина, клеточный состав и другие характеристики изменяются со временем (в течение менструального цикла) под влиянием половых гормонов. Экстракорпоральное оплодотворение, в свою очередь, не является физиологической нормой для организма женщины. Это полностью искусственная и контролируемая человеком процедура, цель которой – с максимальной вероятностью успеха имплантировать оплодотворенную яйцеклетку в матку. Соответственно, данные два фактора необходимо привести в соответствие друг с другом.
Для успешного наступления беременности эндометрий должен иметь достаточно строгие характеристики:
Любое отклонение от этих параметров, даже незначительное, существенно снижает вероятность успешного наступления беременности. Поэтому перед пересадкой эмбрионов врач изучает характеристики эндометрия. Наибольшее значение имеет его толщина – если на ультразвуковом исследовании она больше или меньше указанной нормы, то процедуру отменяют. Сложнее обстоит дело с кровоснабжением и клеточным составом слизистой, изучить которые можно только с помощью биопсии.
Влияние патологий эндометрия на успех ЭКО
Предварительная подготовка эндометрия особенно важна при заболеваниях слизистой, которые снижают или вовсе делают невозможным наступление беременности. К наиболее распространенным патологиям слизистой матки относятся:
Привести состояние эндометрия в норму при имеющихся патологиях – задача более сложная. Если в норме достаточно минимального консервативного вмешательства (гормональной терапии), то при эндометрите, эндометриозе или атрофии проводится комплексное лечение, включающее также хирургические методы, физиотерапию, курсы антимикробных, противовоспалительных и других препаратов.
Как улучшить эндометрий перед ЭКО
Если у пациентки не диагностированы патологии слизистой матки, ее подготовка к экстракорпоральному оплодотворению включает только прием гормональных препаратов и вспомогательных веществ. Терапия проводится в несколько этапов:
Помимо гормональной терапии, в рамках подготовки к ЭКО пациентке назначается прием витаминно-минеральных комплексов, содержащих витамины группы В, витамины А, Е, С, цинк, железо, магнием и другими нужными элементами. Для коррекции состояния эндометрия врач также прописывает препараты, улучшающие кровоснабжение матки.
Подготовка к ЭКО при патологиях эндометрия
При заболеваниях слизистой оболочки матки пациентка проходит более сложный и продолжительный курс терапии. Первый этап направлен на устранение первичной патологии, которое вызвало негативные изменения в тканях. Например, большое значение при подготовке к ЭКО при хроническом эндометрите имеет прием:
При эндометриозе, напротив, требуется удаление излишков эндометриальной ткани. Для этого используются хирургические методы в комплексе с препаратами, подавляющими патологический рост слизистой, нормализующих гормональный фон, эндокринную функцию организма и т. д. Сегодняшние технологии позволяют удалить разросшиеся участки эндометрия с минимальными побочными эффектами – например, с помощью электро- или криодеструкции, лазерной вапоризации. В отличие от традиционной хирургической резекции они моментально коагулируют кровеносные сосуды, тем самым предотвращая маточные кровотечения или инфицирование органа.
Для точного выявления патологий проводится гистероскопия эндометрия перед ЭКО. Этот метод исследования заключается в визуальной оценке состояния слизистой с помощью тонкого трубчатого инструмента с оптической или электронно-оптической системой. Она может проводиться одновременно с удалением новообразований с помощью введенного через гистероскоп скальпеля специальной конструкции. Гистероскопия часто дополняется перед ЭКО биопсией эндометрия (извлечением образца ткани для изучения), УЗИ матки и другими способами диагностики.
Образ жизни при подготовке к ЭКО
Большую роль при подготовке матки к экстракорпоральному оплодотворению играет питание пациентки. В пище содержится много веществ, которые благотворно или, наоборот, отрицательно сказываются на состоянии ее слизистой к ЭКО. Полезными для наращивания эндометрия являются ананас, малина, грейпфрут, тыква, бобовые, овощи. Чтобы предотвратить разрастание слизистой на соседние органы, рекомендуют употреблять фасоль, мясо рыбы и птицы, овощи, богатые клетчаткой.
Также пристальное внимание нужно уделить образу жизни в целом. Нарастить эндометрий перед ЭКО помогают:
Однако, используя эти «подручные» способы, помните – по-настоящему качественную и эффективную помощь при подготовке к ЭКО может предоставить только квалифицированный врач. Прием препаратов, диету, уровень активности и прочие аспекты необходимо предварительно согласовывать с ним.
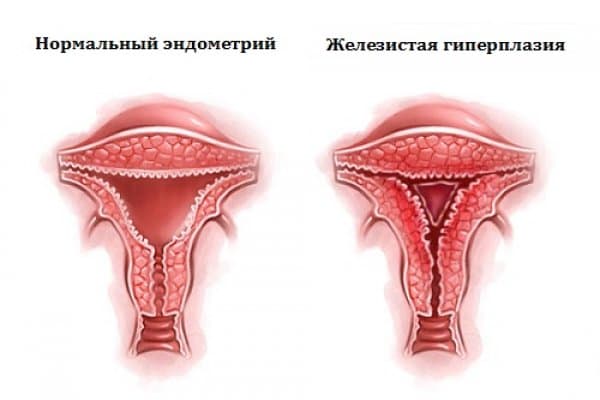
Гиперплазия эндометрия матки
Тел.: 8-800-25-03-03-2
(бесплатно для звонков из регионов России)
Санкт-Петербург, наб. реки Фонтанки, д. 154
Тел.: +7 (812) 676-25-25
Санкт-Петербург, В.О., Кадетская линия, д. 13-15
Тел.: +7 (812) 676-25-25
Санкт-Петербург, ул. Циолковского, д.3
Тел.: +7 (812) 676-25-10
Эндометрий представляет собой нежную тонкую слизистую ткань, которая выстилает полость матки изнутри. Данная ткань каждый месяц быстро растет и утолщается под действием женских половых гормонов. В случае наступления беременности, эндометрий является «пуховой периной» на которую прикрепляется оплодотворенная яйцеклетка. При отсутствии беременности под действием гормонов эндометрий отторгается, выходит в виде менструальной крови.
Классификация гиперплазии эндометрия по локализации
Классификация гиперплазии эндометрия (по гистологической картине)
Причины гиперплазии эндометрия
В настоящее время основной причиной развития гиперплазии считается нарушение баланса женских половых гормонов, который чаще всего встречается в пубертатном периоде и перименопаузе.
Факторы риска развития гиперплазии эндометрия
Симптомы, которые встречаются при гиперплазии эндометрия
Основные из них при гиперплазии эндометрия могут быть:
Обследования, которые помогут выявить и поставить диагноз гиперплазии эндометрия
Лечение гиперплазии эндометрия
Практически в 100% случаев лечение гиперплазии эндометрия хирургическое.
Методами хирургического лечения гиперплазии эндометрия является гистероскопия и гистерорезектоскопия.
Данная операция проводится под общей анестезией. Продолжительность операции не превышает 30 минут, короткий период нахождения под общей анестезией позволяет врачам в тот же день отпустить пациентку домой.
Осложнения гиперплазии
При отсутствии должного и адекватного лечения гиперплазия эндометрия приводит к тяжелой анемии с значительным снижением уровня гемоглобина, появлению слабости, повышенной усталости, сонливости, что связано с большими потерями крови во время менструации. У молодых женщин гиперплазия эндометрия может быть причиной бесплодия и невынашивания беременности. Отдельные формы гиперплазии эндометрия (железистая и кистозная гиперплазии эндометрия) являются предраковым состоянием и в случае длительного наблюдения, при отсутствии лечения, могут переродиться в рак матки.
Профилактические мероприятия при данном заболевании необходимы для того, чтобы снизить риск развития рака эндометрия и предотвратить рецидив гиперплазии.
Гиперплазия эндометрия. Часто задаваемые вопросы
1. Что это такое? Доброкачественный процесс, который характеризуется чрезмерным разрастанием внутреннего слоя матки.
2. Из-за чего она возникает? Из-за постоянного воздействия полового гормона эстрогена на эндометрий, который вызывает его чрезмерное разрастание. Гиперэстрогения возникает из-за нарушения центральной регулиции менструального цикла, гормонопродуцирующих опухолей яичников, неправильного использования гормональных препаратов, дефицита прогестерона (гормон II фазы менструального цикла), обладающего антипролиферативным действием, так же в результате ановуляторных циклов.
3. Это распространенное заболевание? Частота встречаемости в структуре гинекологической заболеваемости 15-50%. По данным обращаемости пациенток частота встречаемости ГПЭ- 30%. В позднем репродуктивном возрасте и в перименопаузе встречается с частотой- 50%
4. Это заболевание очень опасно? Пристального внимания врачей заслуживают:
При отсутствии должного лечения гиперплазия эндометрия может приводить к серьезным маточным кровотечениям, со снижением гемоглобина крови и вытекающими отсюда последствиями.
5. Возможно ли забеременеть на фоне гиперплазии эндометрия? Ответ – нет. Гиперплазия эндометрия не возникает спонтанно, это следствие нарушений в репродуктивной системе женщины. Нарушение баланса между звеньями регуляции менструального цикла вызывает избыток эстрогенов в организме женщины, нехватку прогестерона, вследствие этого отсутствие овуляции (выхода яйцеклетки из фолликула для оплодотворения). Так же сам эндометрий структурно изменен, поэтому является неблагоприятным для имплантации (прикрепление плодного яйца к стенке матки).
7. Как диагностировать атипическую гиперплазию эндометрия? Большую информацию врач получает при опросе пациентки во время общения (возраст менархе или время наступления менопаузы, все особенности менструального цикла- его длительность, характер выделений и т.д.).
УЗ-исследование в зависимости от периода жизни женщины, а также фазы менструального цикла может дать информацию о состоянии эндометрия. По этим данным можно заподозрить проблему, однако подтвердить или опровергнуть атипию в клетках эндометрия нельзя. Только проведение гистероскопии с последующим гистологическим исследованием материала является золотым стандартом для диагностики этого состояния. Информативность метода более 90%.
8. Обязательно ли проводить выскабливание эндометрия при гиперплазии? Раздельное выскабливание цервикального канала и полости матки несет за собой лечебный и диагностический характер. Механическое удаление измененной патогенной ткани из полости матки предотвращает маточное кровотечение, что составляет лечебный эффект. Полученный соскоб отправляется на гистологическое исследование, после которого будет дано заключение о характере ткани, наличии или отсутствии признаков злокачественного поражения.
9. Возможен ли рецидив гиперплазии эндометрия? Да, возможен. Так как причиной гиперплазии эндометрия является нарушение гормонального баланса в организме женщины, то требуется обследование её гормонального фона. Для профилактики рецидива необходимо соответствующее лечение и исключение факторов риска.
Тонкая эндометрия матки что делать
М.Р. Оразов, В.Е. Радзинский, М.Б. Хамошина, Л.А. Кайгородова, Л.Р. Токтар, Л.В. Покуль, М.С. Тулупова
Российский университет дружбы народов, Москва
Актуальность
В доступной академической литературе все чаще применяют термин «репродуктивные неудачи», под которым суммарно понимают первичное и вторичное бесплодие, неудачи имплантации в программах вспомогательных репродуктивных технологий (ВРТ), невынашивание, неразвивающуюся беременность [1]. По данным Всемирной организации здравоохранения, встречаемость бесплодия в современном мире балансирует на грани, демографически значимой (до 15%), и не имеет тенденции к снижению [2]. Согласно данным официальной статистики (Росстат, 2015), его уровень в России – 224,2 на 100 тыс. женщин в возрасте 18–49 лет [3]. Потери потенциальных рождений, связанных с женским бесплодием, в 2014 г. составили 618,6 тыс. Общеизвестно, что проблема бесплодного брака выходит далеко за границы медицинской плоскости, поскольку он как для бесплодной пары, так и для общества в целом влечет за собой демографические, социальные и психологические последствия [3].
С другой стороны, неутешительными остаются данные о высокой распространенности самопроизвольного прерывания беременности в России – от 15 до 23% среди всех случаев зарегистрированных беременностей, около 50% выкидышей приходится на долю привычного невынашивания беременности [3]. Интересно, что риск потери желанной беременности возрастает с увеличением числа репродуктивных неудач и составляет 38% после двух предшествовавших выкидышей [4].
И наконец, в соответствии со сведениями последних лет частым осложнением после ВРТ является самопроизвольное прерывание беременности (12–29%), при этом 80% из них – в I триместре [5].
Одной из глобальных проблем современной репродуктологии, далекой от окончательного решения, по мнению исследователей, является нарушение процессов имплантации, обусловленное дефектом морфологического субстрата и/или дисфункцией эндометриального интерфейса [2, 3, 5, 6]. Особенно важным это представляется с точки зрения прогнозирования исхода беременности при экстракорпоральном оплодотворении (ЭКО) – все еще неуловимой цели репродуктологии, определившей активный поиск прогностических маркеров [5].
В систематическом обзоре и мета-анализе показано, что при выраженном отставании толщины эндометрия (ТЭ) от нижней нормативной границы в середине и в конце фолликулярной фазы стимулируемого цикла в протоколах ВРТ имеет место резкое снижение вероятности успешной имплантации, что служит одной из причин феномена повторных репродуктивных неудач (RIF – recurrent implantation failure) [7, 8]. Именно в этом контексте ранее были оценены материнский возраст, овариальный резерв и маркеры рецептивности эндометрия (РЭ). Безусловно, РЭ является неотъемлемой частью имплантации, поэтому идентификация точного маркера имплантации была бы весьма полезной в циклах ВРТ.
Несмотря на массу исследований в области маточной имплантологии и эмбриологии, на сегодняшний день идеального маркера РЭ не существует. Недостаточная диагностическая точность, прогностическая ценность и инвазивный характер гистологических и биохимических маркеров РЭ ограничивают их клиническую применимость [5].
Эндометрий – уникальная ткань организма, которая у женщин репродуктивного возраста ежемесячно подвергается регулярным динамическим изменениям: процессам трансформации, репарации и регенерации [4]. Все эти превращения направлены прежде всего на подготовку к имплантации эмбриона. Изменения в эндометрии, происходящие в течение менструального цикла, отражают совокупное влияние стероидов овариального цикла. Функциональный слой эндометрия начинает расти под влиянием эстрогена (Эс), пока не достигнет максимума в начале пикового выброса лютеинизирующего гормона (ЛГ), а пред- и постовуляторное повышение прогестерона (Пр) отвечает за секреторную трансформацию эндометрия, что сопровождается структурными изменениями в эндометриальном паттерне [9].
Необходимо отметить тот факт, что в силу своей неинвазивности и универсальной доступности трансвагинальная сонография – наиболее часто используемый и довольно информативный метод для оценки РЭ в протоколах ВРТ. При сонографическом исследовании в динамике могут быть отслежены увеличение ТЭ в фолликулярную фазу и его трансформация из гипоэхогенной полоски в трехслойный компактный вид гиперэхогенной картины в постовуляторном периоде. Считается, что именно наличие трехслойной структуры эндометрия в день введения триггера овуляции связано с увеличением вероятности с точки зрения наступления беременности [10].
При трансвагинальной сонографии ТЭ измеряется как максимальное расстояние между эхогенными интерфейсами миометрия и эндометрия в плоскости, проведенной через центральную продольную ось тела матки. На сегодня доказано, что ТЭ 4,5 и уменьшение конечной диастолической скорости (Vmin) 7 мм соответственно. Интересно, что исследователи сравнили КЧНБ и коэффициент живорождения. У пациенток с «тонким» эндометрием они были дополнительно оценены в зависимости от возраста, числа извлеченных ооцитов и перенесенных эмбрионов.
Оказалось, что значительно лучшие результаты были получены, когда возраст пациенток не достигал 35 лет или число извлеченных ооцитов было >5, или число перенесенных эмбрионов было 3 или более. Авторы пришли к выводу, что если ТЭ 7 мм (23,3 против 48,1%, или ОШ=0,42; 95% ДИ – 0,27–0,67). Положительное прогностическое значение для наступления клинической беременности составило 77%, отрицательное – 48%. Из этого обзора можно сделать вывод: ТЭ может предсказать нам вероятность, но не может быть фактором для прогнозирования наступления беременности [33].
Между тем следует подчеркнуть, что некоторые авторы описывают отрицательное влияние контролируемой стимуляции яичников на РЭ и для улучшения имплантации рекомендуют криоконсервацию эмбрионов с последующим переносом в циклы заместительной гормонотерапии [14].
В свете сказанного интересно было изучить значение ТЭ для КЧНБ и исходов циклов переноса криоконсервированных эмбрионов. Например, в исследованиях T. El-Toukhy et al. (2008) установлено, что ТЭ=9–14 мм, измеренная в день начала прогестероновой поддержки, ассоциируется с более высокой имплантацией и КЧНБ по сравнению с ТЭ=7–8 мм [13].
Не менее интересны результаты Е. Dix и J.H. Check (2010), в ретроспективном анализе изучавших частоту наступления беременности у пациенток с ТЭ 6 мм соответственно не выявлено. Однако исследователи подчеркнули, что в группе с ТЭ не более 8,2 мм наблюдалась бóльшая доля живорождений, чем при более «тонком» эндометрии. Возможно, «тонкий» эндометрий не способен поддерживать развитие беременности после имплантации, что приводит к большему числу выкидышей из-за внутриутробной смерти плода.
Качество эмбрионов играет важную роль в имплантации и является одним из определяющих факторов для исхода беременности. J.A. Gingold et al. (2015) попытались оценить взаимосвязь ТЭ и РЭ на исход беременности после переноса эуплоидных эмбрионов [22]. Перенеся только эуплоидные эмбрионы после предимплантационного генетического скрининга, авторы обнаружили, что ТЭ (≤8 против >8 мм) в день введения триггера овуляции не имела статистически значимой корреляции с КЧНБ или клиническими исходами во всех возрастных группах (23,4–44,4 года, средний – 36,1±4,0 года) ни в свежем, ни в криопротоколах.
Методы, используемые для лечения «тонкого» эндометрия, могут включать гистероскопический адгезиолиз, циклическую гормональныю терапию двумя средствами – эстрогеном (Эс) и прогестероном (Пр), вазоактивными препаратами, и технологии, включая физиотерапию, внутриматочную инфузию гранулоцитарного колониестимулирующего фактора роста и регенеративную медицину [36]. Из вышеперечисленных методов лечение экзогенными Эс – наиболее часто используемый и удобный, позволяющий увеличивать ТЭ и улучшать репродуктивные исходы [1, 12, 39].
Известно, что морфологические изменения в составных компартментах эндометрия в норме на протяжении менструального цикла проходят под воздействием Эс и Пр. Эстрадиол (Э2) — наиболее активный Эс, связываясь с α-рецепторами эстрадиола, вызывает увеличение толщины эндометриальной ткани [32].
Cледует помнить, что именно Э2 обеспечивает повышение чувствительности ткани к Пр, индуцируя экспрессию рецепторов к Пр [32]. Эпителиальные клетки эндометрия эстрогенчувствительны, но они пролиферируют не в результате прямого действия Э2. Эс действуют на стромальные клетки, способствуя синтезу ростовых факторов эпителиальных клеток, что приводит к увеличению синтеза ДНК и размножению соседних клеток эпителия. В противоположность пролиферативному эффекту Э2 Пр способствует четкой дифференцировке эндометрия [32, 40].
Наиболее значимый результат такого рода влияния Пр – инактивация Э2 через стромальные рецепторы к Пр и обеспечение подготовки эндометрия к имплантации эмбриона. Продукция и секреция богатых гликогеном субстанций эпителиальными клетками также индуцируются Пр [40].
Существует несколько путей введения Э2, прописанных в лечении синдрома «тонкого» эндометрия (пероральный, трансдермальный и вагинальный). Пероральное назначение Э2 хорошо переносится пациентками, однако следует отметить, что после перорального введения Э2 активно метаболизируется в слизистой оболочке кишечника и в печени. При этом он легко преобразуется в эстрон (Э1) и эстрон-сульфат (Э1С) с уровнем в крови Э1 в 3–6 раз выше, чем Э2. Э1 является слабым Эс с низким сродством для α- и β-рецепторов Эс. Таким образом, т.н. первичный пассаж через печень может значительно снижать ожидаемую активность Э2, вместе с тем повышая тромботический риск [41].
Очень важно подчеркнуть, что, по мнению некоторых авторов, существует понятие «минимальный период», за который рецептивный эндометрий может вырасти [40, 41]. Он составляет 5–7 дней, поэтому продолжительность назначения Э2 на 10–14 дней не абсолютна. Если ТЭ не достигает нужных параметров за этот период, применение препаратов Э2 может быть продолжено [42].
Результатами многочисленных отечественных исследований убедительно показано, что трансдермальные формы Эс могут вызывать адекватный рост эндометрия, несмотря на более низкую концентрацию Э2 в крови по сравнению с пероральными путями доставки. Исследователями был сделан вывод: трансдермальное применение Э2 благотворно влияет на РЭ [41, 43].
Эксперты междисциплинарной ассоциации специалистов репродуктивной медицины (МАРС) солидарны с изложенным выше мнением.
В протоколе указано, что при выявлении ТЭ менее 8 мм на 21–24-й день цикла получила распространение циклическая гормональная терапия двумя средствами – эстрогеном и прогестероном. Препарат Э2 рекомендуют назначать трансдермально, причем не только в первую, но и во вторую половину цикла. Во вторую фазу цикла к лечению добавляют препарат прогестерона по схеме, совпадающей с терапией НЛФ. Доза эстрадиола подбирается индивидуально в зависимости от толщины слизистой оболочки матки, в cреднем 1–4 мг/сут [44]. В то же время для клинициста важно помнить, что препараты должны назначаться в дозах, не противоречащих официальной инструкции по примененению. В связи с этим необходимо отметить, что зарегистрированные в России трасдермальные формы эстрадиола (Эстрожель и Дивигель) имеют различные ограничения по максимально допустимой суточной дозировке. Для Эстрожеля максимальная суточная доза – 3 мг [45], в то время как для Дивигеля максимально допустимая суточная доза, согласно инструкции – всего 1,5 мг/сут [51]. Таким образом, применение препарата Эстрожель во флаконе с помпой-дозатором позволяет использовать более высокие дозы, оставаясь в рамках правового поля. [45].
Существуют хирургические технологии улучшения репаративной функции эндометрия, такие как процедура эндометриального «скретчинга» с использованием офисной гистероскопии, в ходе которой предусматривается нанесение биопсийными щипцами продольных царапин (каждая длиной 20 и глубиной 2 мм) на обеих боковых и задней поверхностях матки. Установлено, что травматизация эндометрия при биопсии способствует усилению регенераторного потенциала и положительно влияет на частоту наступления клинической беременности в циклах ЭКО [4]. Предположительно существует несколько механизмов, обеспечивающих улучшение рецептивности эндометрия при его повреждении в ходе биопсии в пролиферативной фазе. Локальная травматизация, вероятно, индуцирует децидуализацию эндометрия, таким образом повышая вероятность имплантации. Наличие раневой поверхности при биопсии эндометрия служит фактором, интенсифицирующим процессы репарации, инициируя дополнительную секрецию цитокинов и факторов роста (ИЛ-11, LIF, HB-EGF), принимающих участие в процессе имплантации [4, 46].
Следует отметить, что сегодня поиск физических методов прегравидарной подготовки эндометрия при нарушении его рецептивности продолжается. Например, предложены орошение полости матки кавитированными растворами при гипопластическом эндометрии [35, 47], комплексная синхронная электротерапия, магнито-лазеро-светотерапия при хроническом эндометрите с аутоиммунным компонентом, приводящие к увеличению ТЭ и положительной динамике морфологической картины [48].
В уникальной работе Е.С. Силантьевой (2008) доказана клинико-морфологическая эффективность лечебного действия физиотерапии при синдроме «тонкого» эндометрия. Автором сделан следующий вывод: использование физических методов лечения в комплексной терапии нарушений репродуктивной функции способствует ее восстановлению у 55,3% больных, частота наступления беременности в первом цикле использования ЭКО у инфертильных женщин, ассоциированных с гипопластической дисфункцией эндометрия при предшествовавших неудачах, достигала 41,1%, при этом частота донашивания беременности при синдроме привычной потери плода на ранних сроках беременности регистрировалась у 82,4% пациенток [48].
Аналогичные позитивные изменения после применения комплексного физиотерапевтического лечения были получены в исследовании М.П. Плясуновой (2018). Автором показано достоверное увеличение ТЭ>7,0 мм в период «окна имплантации», исчезновение неоднородности эндометрия, гиперэхогенных включений в эндометрии по данным ультразвукового исследования, а также уменьшение IR 2,5 см/с при допплерометрии кровотока в маточных артериях [12].
Перспективно при синдроме «тонкого» эндометрия использование с целью коррекции трофических нарушений витамина Е, L-аргинина, PRP (Platelet Rich Plasma)-терапии, силденафила цитрата: гистологически доказан рост железистого эпителия и улучшение васкулогенеза, экспрессии сосудистых факторов роста, но пока недостаточно рандомизированных клинических испытаний [39, 49]. Целесообразна при синдроме «тонкого» эндометрия, но не доказана терапия аспирином и омега-3 при верифицированной недостаточности маточной перфузии [4, 50].
Заключение
Таким образом, варианты совершенствования подготовки женщин к имплантации эмбриона после неудач в циклах ВРТ в научной литературе обсуждаются активно, однако с позиций анализа синдрома «тонкого» эндометрия данная тема далека от окончательного решения. В мире до сих пор отсутствует единая методология определения РЭ – все диагностические маркеры имеют недостаточную доказательную базу в плане интерпретации результатов, трудно воспроизводимы в рутинной клинической практике. Улучшение диагностических возможностей в отношении РЭ позволит в будущем повысить эффективность преодоления репродуктивных неудач, ассоциированных с синдромом «тонкого» эндометрия.
Литература
1. Базина М.И. Предгравидарная подготовка женщин при репродуктивных неудачах. Дисс. канд. мед. наук. М., 2016.
2. Федеральная служба государственной статистики. Демография. Численность и состав населения. Электронный ресурс. Режим доступа: http://www.gks.ru/
3. Радзинский В.Е., Симоновская Х.Ю., Маклецова С.А. Ключевое гинекологическое открытие поколения: почему динозавры вымерли, а мы еще нет. Status Praesens. 2015;4(27):23–7.
4. Бесплодный брак. Версии и контраверсии / Под ред. В.Е. Радзинского. М., 2018. С. 220–23.
5. Mahajan N., Sharma S. The endometrium in assisted reproductive technology: How thin is thin? J. Hum. Reprod. Sci. 2016;9(1):3–8. Doi: 10.4103/0974-1208.
6. Grunfeld L., Walker B., Bergh P.A., et al. High-resolution endovaginal ultrasonography of the endometrium: A noninvasive test for endometrial adequacy. Obstet. Gynecol. 1991;78:200–4.
7. Kasius A., Smit J.G., Torrance H. L., et al. Endometrial thickness and pregnancy rates after IVF: a systematic review and meta-analysis. Hum. Reprod. Updatе. 2014;20(4):530–41. Doi.org/10.1093/humupd/dmu011.
8. Sher G., Herbert C., Maassarani G., Jacobs M.H. Assessment of the late proliferative phase endometrium by ultrasonography in patients undergoing in-vitro fertilization and embryo transfer (IVF/ET) Hum. Reprod. 1991;6:232–37.
9. Dickey R.P., Olar T.T., Curole D.N., et al. Endometrial pattern and thickness associated with pregnancy outcome after assisted reproduction technologies. Hum. Reprod. 1992;7:418–21.
10. Bonilla-Musoles F., Raga F., Osborne N.G., et al. Endometrial receptivity: Evaluation with ultrasound. Ultrasound Q. 2013;29:3–20.
11. Barker M.A., Boehnlein L.M., Kovacs P., Lindheim S.R. Follicular and luteal phase endometrial thickness and echogenic pattern and pregnancy outcome in oocyte donation cycles. J. Assist. Reprod. Genet. 2009;26:243–49.
12. Плясунова М.П. Восстановление морфофункционального состояния эндометрия после повторных неразвивающихся беременностей. Дисс. канд. мед. наук. М., 2018.
13. El-Toukhy T., Coomarasamy A., Khairy M., et al. The relationship between endometrial thickness and outcome of medicated frozen embryo replacement cycles. Fertil. Steril. 2008;89:832–39.
14. Kumbak B., Erden H.F., Tosun S., et al. Outcome of assisted reproduction treatment in patients with endometrial thickness less than 7 mm. Reprod. Biomed. Online. 2009;18:79–84.
15. Rinaldi L., Lisi F., Floccari A., et al. Endometrial thickness as a predictor of pregnancy after in-vitro fertilization but not after intracytoplasmic sperm injection. Hum. Reprod. 1996;11:1538–41.
16. Kovacs P., Matyas S., Boda K., Kaali S.G. The effect of endometrial thickness on IVF/ICSI outcome. Hum. Reprod. 2003;18:2337–41.
17. Zhang X., Chen C.H., Confino E., et al. Increased endometrial thickness is associated with improved treatment outcome for selected patients undergoing in vitro fertilization-embryo transfer. Fertil. Steril. 2005;83:336–40.
18. Richter K.S., Bugge K.R., Bromer J.G., Levy M.J. Relationship between endometrial thickness and embryo implantation, based on 1,294 cycles of in vitro fertilization with transfer of two blastocyst-stage embryos. Fertil. Steril. 2007;87:53–9.
19. Shapiro H., Cowell C., Casper R.F. The use of vaginal ultrasound for monitoring endometrial preparation in a donor oocyte program. Fertil. Steril. 1993;59:1055–58.
20. Coulam C.B., Bustillo M., Soenksen D.M., Britten S. Ultrasonographic predictors of implantation after assisted reproduction. Fertil. Steril. 1994;62:1004–10.
21. Gonen Y., Casper R.F. Prediction of implantation by the sonographic appearance of the endometrium during controlled ovarian stimulation for in vitro fertilization (IVF) J. In Vitro Fert. Embryo. Transf. 1990;7:146–52.
22. Gingold J.A., Lee J.A., Rodriguez-Purata J., et al. Endometrial pattern, but not endometrial thickness, affects implantation rates in euploid embryo transfers. Fertil. Steril. 2015;104:620–8.e5.
23. Remohí J., Ardiles G., García-Velasco J.A., et al. Endometrial thickness and serum oestradiol concentrations as predictors of outcome in oocyte donation. Hum. Reprod. 1997;12:2271–76.
24. Check J.H., Dietterich C., Check M.L., Katz Y. Successful delivery despite conception with a maximal endometrial thickness of 4 mm. Clin. Exp. Obstet. Gynecol. 2003;30:93–4.
25. Sundström P. Establishment of a successful pregnancy following in-vitro fertilization with an endometrial thickness of no more than 4 mm. Hum. Reprod. 1998;13:1550–52.
26. Краснопольская К.В., Назаренко Т.А., Ершова И.Ю. Современные подходы к оценке рецептивности эндометрия. Проблемы репродукции. 2016;5:61–9.
27. Dain L., Bider D., Levron J., et al. Thin endometrium in donor oocyte recipients: Enigma or obstacle for implantation? Fertil. Steril. 2013;100:1289–95.
28. Strohmer H., Obruca A., Radner K.M., Feichtinger W. Relationship of the individual uterine size and the endometrial thickness in stimulated cycles. Fertil. Steril. 1994;61:972–75.
29. Scioscia M., Lamanna G., Lorusso F., et al. Characterization of endometrial growth in proliferative and early luteal phase in IVF cycles. Reprod. Biomed. Online. 2009;18:73–8.
30. Cakmak H., Taylor H.S. Implantation failure: molecular mechanisms and clinical treatment. Hum. Reprod. Update. 2011;17(2):242–53.
31. Xu B., Zhang Q., Hao J., Xu D., Li Y. Two protocols to treat thin endometrium with granulocyte colony-stimulating factor during frozen embryo transfer cycles. Reprod. Biomed. Online. 2015;30:349–58.
32. Лызикова Ю.А. Хронический эндометрит как причина нарушений репродуктивной функции у женщин. Проблемы здоровья и экологии. 2015;3(45):9–16.
33. Kasius A., Smit J.G., Torrance H.L., et al. Endometrial thickness and pregnancy rates after IVF: A systematic review and meta-analysis. Hum. Reprod. Update. 2014;20:530–41.
34. Крутова В.А. Пути преодоления женского бесплодия. Дисс. докт. мед. наук. М., 2016.
35. Львова А.В. Эффективность лечения «тонкого» эндометрия при маточной форме бесплодия и невынашивании беременности. Дисс. канд. мед. наук. М., 2018.
36. Мелкозерова О.А., Башмакова Н.В., Чистякова Г.Н. Программа диагностики нарушений рецептивности эндометрия у пациенток с репродуктивными неудачами. Мелкозерова. Уральский мед. журн. 2017;9:119–27.
37. Dix E., Check J.H. Successful pregnancies following embryo transfer despite very thin late proliferative endometrium. Clin. Exp. Obstet. Gynecol. 2010;37:15–6.
38. Check J.H., Cohen R., Wilson C., et al. Very thin endometria in the late proliferative phase is more associated with poor pregnancy rates following controlled ovarian hyperstimulation than graduated estradiol regimens used for frozen embryo transfer. Fertil. Steril. 2014;101:e21.
39. Takasaki A., Tamura H., Miwa I., et al. Endometrial growth and uterine blood flow: a pilot study for improving endometrial thickness in the patients with a thin endometrium. Fertil. Steril. 2010;9(6):1851–58.
40. Мальцева Л.И., Смолина Г.Р., Юпатов Е.Ю. Хронический эндометрит и тазовая боль. Акушерство. Гинекология. Репродукция. 2012;6(3):23–7.
41. Берестовой O.A., Веселовский В.В. Эндометрий в программах вспомогательных репродуктивных технологий: подходы к подготовке трансдермальными формами натурального эстрадиола. Женское здоровье. 2012;4:27–30.
42. Allahbadia G.A. Low-Molecular-Weight Heparin (LMWH) in Women with Repeated Implantation Failure. J. Obstet. Gynaecol. India. 2012;62(4):381–83.
43. Громова О.А., Лиманова О.А., Торшин И.Ю. Систематический анализ фундаментальных и клинических исследований, как обоснование необходимости совместного использования эстрогенсодержащих препаратов с препаратами магния и пиридоксина. Акушерство, гинекология и репродукция. 2013;3:35–50.
44. Неразвивающаяся беременность. Методические рекомендации МАРС (Междисциплинарной ассоциации специалистов репродуктивной медицины). Авт.-сост. В.Е. Радзинский и др. М., 2015. 48 с.
45. Инструкция по медицинскому применению препарата эстрожель. Национальный регистр лекарственных средств. 2017.
46. Van der Linden M., Buckingham K., Farquhar C., et al. Luteal phase support for assisted reproduction cycles. Cochrane Database Syst. Rev. 2015;(7):CD009154.
47. Богданова А.М., Глухов Е.Ю., Дикке Г.Б. Применение низкочастотного ультразвука в комплексном лечении гипопластического варианта хронического эндометрита. Акушерство и гинекология. 2017;2:90–6.
48. Силантьева Е.С. Физические методы структурно–функционального ремоделирования эндометрия у женщин с нарушением репродуктивной функции. Дисс. докт. мед. наук. М., 2008.
49. van den Boogaard N.M., Bensdorp A.J., Oude Rengerink K., et al Prognostic profiles and the effectiveness of assisted conception: secondary analyses of individual patient data. Hum. Reprod. Update. 2014;20(1):141–51.
50. Lazzarin N., Vaquero E., Exacoustos C., et al. Low-dose aspirin and omega-3 fatty acids improve uterine artery blood flow velocity in women with recurrent miscarriage due to impaired uterine perfusion. Fertil. Steril. 2009;92:296–300.
51. Инструкция по медицинскому применению препарата Дивигель.