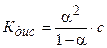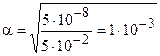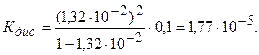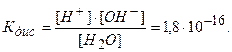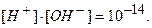Как узнать степень диссоциации
Электролитическая диссоциация. Степень и константа диссоциации
По способности проводить электрический ток в водном растворе или в расплаве, вещества делятся на электролиты и неэлектролиты.
Электролитами называются вещества, растворы или расплавы которых проводят электрический ток. К электролитам относятся соли, кислоты, основания. В молекулах этих веществ имеются ионные или ковалентные сильно полярные химические связи.
Неэлектролитами называются вещества, растворы или расплавы которых не проводят электрический ток. К неэлектролитам относятся, например, кислород, водород, многие органические вещества (сахар, эфир, бензол и др.). В молекулах этих веществ существуют ковалентные неполярные или малополярные связи.
Для объяснения электропроводности растворов и расплавов солей, кислот и оснований шведский ученый С. Аррениус создал теорию электролитической диссоциации (1887 г.):
1.Молекулы электролитов при растворении или расплавлении распадаются на ионы.
Процесс распада молекул электролитов на ионы в растворе или в расплаве называется электролитической диссоциацией, или ионизацией.
Ионы — это атомы или группы атомов, имеющие положительный или отрицательный заряд.
2.В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока, положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы движутся к положительно заряженному электроду (аноду). Поэтому положительные ионы называются катионами, отрицательные ионы — анионами.
3.Диссоциация — процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (ионизация, или диссоциация) и соединение ионов в молекулы (ассоциация, или моляризация).
Диссоциацию молекул электролитов выражают уравнениями, в которых вместо знака равенства ставят знак обратимости. В левой части уравнения записывают формулу молекулы электролита, в правой — формулы ионов, которые образуются в процессе электролитической диссоциации. Например:
Каждая молекула нитрата магния диссоциирует на ион магния и два нитрат-иона. Следовательно, в результате диссоциации одной молекулы Mg(NO3)2 образуются три иона.
Общая сумма зарядов катионов равна общей сумме зарядов анионов и противоположна по знаку (так как растворы электролитов электронейтральны).
Механизм электролитической диссоциации. Гидратация ионов
Причины и механизм диссоциации электролитов объясняются химической теорией раствора Д. И. Менделеева и природой химической связи. Как известно, электролитами являются вещества с ионной или ковалентной сильно полярной связями. Растворители, в которых происходит диссоциация, состоят из полярных молекул. Например, вода — полярный растворитель. Диссоциация электролитов с ионной и полярной связями протекает различно. Рассмотрим механизм диссоциации электролитов в водных растворах.
I. Механизм диссоциации электролитов с ионной связью
В результате этого взаимодействия между молекулами растворителя и ионами электролита притяжение между ионами в кристаллической решетке вещества ослабевает. Кристаллическая решетка разрушается, и ионы переходят в раствор. Эти ионы в водном растворе находятся не в свободном состоянии, а связаны с молекулами воды, т. е. являются гидратированными ионами.
Диссоциация ионных соединений в водном растворе протекает полностью. Так диссоциируют соли и щелочи: KCl, LiNO3, Ba(OH)2 и др.
II. Механизм диссоциации электролитов, которые состоят из полярных молекул
При растворении в воде веществ с полярной ковалентной связью происходит взаимодействие дипольных молекул электролита с дипольными молекулами воды. Например, при растворении в воде хлороводорода происходит взаимодействие молекул НСl с молекулами Н2O. Под влиянием этого взаимодействия изменяется характер связи в молекуле HCl: сначала связь становится более полярной, а затем переходит в ионную связь. Результатом процесса является диссоциация электролита и образование в растворе гидратированных ионов.
Так диссоциируют кислородсодержащие и бескислородные кислоты: H2SO4, HNO3, НI и др. Диссоциация электролитов с полярной связью может быть полной или частичной. Это зависит от полярности связей в молекулах электролитов.
Таким образом, главной причиной диссоциации в водных растворах является гидратация ионов. В растворах электролитов все ионы находятся в гидратированном состоянии. Например, ионы водорода соединяются с молекулой воды и образуют ионы гидроксония Н3O+ по донорно-акцепторному механизму:
Свойства ионов
Ионы по физическим, химическим и физиологическим свойствам отличаются от нейтральных атомов, из которых они образовались. Например, ионы натрия Na + и хлорид-ионы Сl — не взаимодействуют с водой, не имеют цвета, запаха, неядовиты.
Атомы натрия Na 0 энергично взаимодействуют с водой. Вещество хлор C12 в свободном состоянии — газ желто-зеленого цвета, ядовит, сильный окислитель.
Различные свойства атомов и ионов одного и того же элемента объясняются разным электронным строением этих частиц. Химические свойства свободных атомов металлов определяются валентными электронами, которые атомы металлов легко отдают и переходят в положительно заряженные ионы. Атомы неметаллов легко присоединяют электроны и переходят в отрицательно заряженные ионы. Ионы находятся в более устойчивых электронных состояниях, чем атомы.
Степень диссоциации
В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на ионы частично, часть их молекул остается в растворе в недиссоциированном виде.
Число, показывающее, какая часть молекул распалась на ионы, называется степенью электролитической диссоциации (степенью ионизации).
Степень электролитической диссоциации (α) равна отношению числа молекул, которые распались на ионы, к общему числу молекул в растворе:
где n — число молекул, распавшихся на ионы; N — общее число растворенных молекул.
Например, степень диссоциации (α) уксусной кислоты СН3СООН в 0,1 М растворе равна 1,36%. Это означает, что из 10000 молекул СН3СООН 136 молекул распадаются на ионы по уравнению:
Степень диссоциации зависит от природы растворителя и природы растворяемого вещества, концентрации раствора, температуры и других факторов.
Различные вещества диссоциируют в разной степени. Например, муравьиной кислоты НСООН при одинаковых условиях больше α уксусной кислоты СН3СООН.
При уменьшении концентрации электролита, т. е. при разбавлении раствора, степень диссоциации увеличивается, так как увеличиваются расстояния между ионами в растворе и уменьшается возможность соединения их в молекулы.
При повышении температуры степень диссоциации, как правило, увеличивается.
В зависимости от степени диссоциации электролиты делятся на сильные и слабые.
Сильные электролиты — это такие электролиты, которые в водных растворах полностью диссоциируют на ионы, т. е. их степень диссоциации равна 1 (100%). К сильным электролитам относятся: 1) соли; 2) сильные кислоты (HClO4, НСlO3, НNО3, H2SO4, HCl, НВr, HI и др.); 3) щелочи (LiОН, NaOH, КОН, RbOH, СsОН, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Слабые электролиты — это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы, т. е. их степень диссоциации меньше 1 (100%). К слабым электролитам относятся: 1) слабые кислоты (НСlO2, HClO, HNO2, H2SO3, Н2СO3, H2SiO3, Н3РО4, H3РО3, H3BO3, СН3СООН, Н2S, HCN, HF и др.); 2) слабые нерастворимые в воде основания Fe(OH)2, Pb(OH)2, Cu(OH)2 и др.); 3) гидроксид аммония (NH4OH); 4) вода (Н2О).
Константа диссоциации (ионизации)
Для характеристики слабых электролитов применяют константу диссоциации (Kд). Вследствие того, что слабые электролиты диссоциируют на ионы не полностью, в их растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Для слабого электролита общей формулы АnВm уравнение диссоциации имеет вид:
Применяя закон действующих масс, запишем выражение константы равновесия:
Константу равновесия в этом случае называют константой диссоциации (Kд), или константой ионизации.
Константа ионизации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем легче электролит распадается на ионы, тем больше ионов в его растворе, тем сильнее электролит. Например:
Следовательно, уксусная кислота СН3СООН более сильный электролит, чем циановодородная кислота HCN.
Для слабого электролита константа диссоциации — постоянная величина при данной температуре, которая не зависит от концентрации раствора. Константа диссоциации зависит от природы электролита, природы растворителя и температуры. Константы диссоциации некоторых слабых электролитов приведены в таблице.
Значение электролитов для живых организмов
Как узнать степень диссоциации
Электролитическая диссоциация в той или иной степени – процесс обратимый. Но при растворении некоторых соединений равновесие диссоциации в значительной степени смещено в сторону диссоциируемой формы. В растворах таких электролитов диссоциация протекает практически необратимо. Поэтому при написании уравнений диссоциации таких веществ пишется или знак равенства или прямая стрелка, обозначающая, что реакция происходит практически необратимо.
I. Степень электролитической диссоциации
Посмотрите видео-презентацию: “Степень электролитической диссоциации”
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Степень диссоциации зависит от природы электролита и растворителя, от концентрации электролита, температуры.
1. Зависимость степени диссоциации от природы: чем полярнее химическая связь в молекуле электролита и растворителя, тем сильнее выражен процесс диссоциации электролита на ионы и тем выше значение степени диссоциации.
2. Зависимость степени диссоциации от концентрации электролита: с уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается.
3. Зависимость степени диссоциации от температуры: степень диссоциации возрастает при повышении температуры (повышение температуры приводит к увеличению кинетической энергии растворённых частиц, что способствует распаду молекул на ионы).
II. Сильные и слабые электролиты
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
Классификация электролитов в зависимости от степени электролитической диссоциации (памятка)
Классификация электролитов
Сильные электролиты
Средние электролиты
Слабые электролиты
Значение степени диссоциации (α)
Степень диссоциации. Сильные и слабые электролиты
В растворах некоторых электролитов диссоциирует лишь часть молекул. Способность вещества к электролитической диссоциации называется степенью диссоциации. Она показывает отношение числа молекул, продиссоциированных на ионы, к общему числу молекул растворенного электролита:
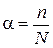
где α— степень диссоциации;
п — количество ионов в растворе;
N— общее число молекул в растворе.
По степени диссоциации в растворах все электролиты делятся на две группы. К первой группе относят электролиты, степень диссоциации которых в растворах α > 30 % и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах относятся щелочи: КОН, NaOH, Ba(OH)2, Са(ОН)2; кислоты: HNO3, НСl, H2SO4, НClO4, а также их соли.
Электролиты, степень диссоциации которых в растворах α Читайте также: Галогены: список элементов и химические свойства
В растворах слабых электролитов процесс диссоциации протекает обратимо и его можно представить в виде обратимой химической реакции. Так, для процесса диссоциации уксусной кислоты:
константа равновесия этого процесса будет равна:
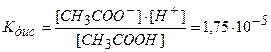
где [СНзСОО-], [Н+] — концентрация ионов;
[СН3СООН] — концентрация непродиссоциированных молекул.
Константа равновесия, соответствующая диссоциации слабого электролита, называется константой диссоциации.
Константа диссоциации зависит от природы диссоциирующего вещества и растворителя, температуры и не зависит от концентрации раствора.
Константа диссоциации показывает устойчивость молекул вещества к диссоциации. Чем меньше значение константы диссоциации в данном растворе, тем слабее диссоциирует электролит.
Степень диссоциации a изменяется с изменением концентрации раствора. Рассмотрим эту зависимость на примере слабого электролита уксусной кислоты:
Принимая исходную концентрацию кислоты равной с, а степень диссоциация a, получаем, что концентрация части кислоты, которая диссоциирована, будет равна aс. Так как при диссоциации одной молекулы кислоты образуется по одному иону Н+ и СНзСОО-, то их концентрации будут равны aс. Концентрация кислоты, оставшейся в недиссоциированном состоянии, будет равна с — aс = с(1 — a). Подставив значения равновесных концентраций ионов и кислоты в уравнение (5.2), получим:
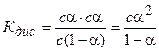
Пример 3. Вычислите степень диссоциации хлорноватистой кислоты и концентрацию ионов водорода в растворе с молярной концентрацией 0,05 моль/дм3.
Решение. НСlO — слабый электролит: HCIO « Н+ + СlO-. Следовательно, в соответствии с законом разбавления Оствальда (5.4, б), определяем степень диссоциации:
Кдис(НСlO) = 5×10-8 моль/дм3.
Молярную концентрацию определяем по формуле (5.5). Так как при диссоциации НС1О « Н++ СlO- образуется один ион Н+ (k(Н+) =1), то
с(Н+) = 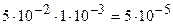
Ответ: a(HClO) = 1 ×10-3; с(Н+) = 5×10 5 моль/дм3.
Решение. В уравнение закона разбавления Оствальда (5.3) подставим данные:
Ионное произведение воды, водородный показатель (рН). Вода является слабым электролитом и диссоциирует на ионы в незначительной степени. Процесс диссоциации воды может быть записан уравнением:
Константа диссоциации будет равна:
Преобразуем выражение (5.7) к следующему виду:
Концентрацию молекул воды можно рассчитать, разделив массу 1 дм3 на массу 1 моля:
Произведение двух постоянных величин есть величина постоянная <Кдис[HгО] = const = KH20), тогда уравнение (5.8) принимает вид:
Полученное уравнение показывает, что для воды и разбавленных водных растворов при постоянной температуре произведение концентрации ионов водорода и гидроксила есть величина постоянная.
Эта постоянная величина называется ионным произведением воды.
Численное значение ионного произведения равно:
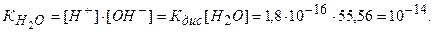
Таким образом, произведение концентрации ионов водорода и гидроксильных ионов в растворе при температуре 295 К равно 10-14.
Отсюда, для чистой воды концентрация ионов при температуре 295 К равна:
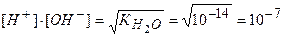
Допустим, что концентрация ионов водорода при добавлении кислоты увеличилась в 1000 раз и стала [Н+] = 10-4 моль/дм3, тогда концентрация ионов [ОН-] в растворе будет равна:
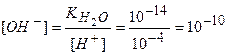
Мы получаем, что в растворах с различной средой всегда присутствуют ионы Н+ и ОН-.
[Н+] Читайте также: Энергетические эффекты химических реакций
Для характеристики кислотности (щелочности) среды введен специальный параметр — водородный показатель, или рН. Водородным показателем, или рН, называется взятый с обратным знаком десятичный логарифм концентрации ионов водорода в растворе:
Следовательно, если рН = 7 — нейтральная среда;
СТЕПЕНЬ ДИССОЦИАЦИИ. КОНСТАНТА ДИССОЦИАЦИИ. РАСЧЕТ КОНЦЕНТРАЦИИ ИОНОВ. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
Пример 1. Вычислить константу диссоциации уксусной кислоты, зная, что в 0,1 Μ растворе она диссоциирована на 1,32%.
Решение. Математически зависимость между константой диссоциации К, степенью диссоциации α и концентрацией С электролита может быть выражена формулой (закон разбавления Оствальда)
Если степень диссоциации электролита очень мала, т.е. α 2 *C
Так как степень диссоциации уксусной кислоты мала, то применяя формулу (2.3.2), находим
При более точном расчете по формуле (2.3.1) получим
Решение. Так как синильная кислота очень слабый электролит, то применяя формулу (2.3.1), получим
Решение. Концентрация ионов (Сг-ион/л) рассчитывается по формуле
[Ва 2+ ] = 0,05*0,72*1 = 0,036 г-ион/л;
Ответ. [Ва 2+ ] = 0,036 г-ион/л;
Пример 4. Концентрация ионов водорода в растворе равна 0,001 г-ион/л. Определить водородный показатель РН раствора
Пример 5. Какова концентрация гидроксильных ионов в растворе, PН которого равен 11?
Решение. Находим концентрацию ионов водорода в растворе:
Так как ионное произведение воды при 298°К
Концентрация раствора соляной кислоты при n = 1 и α =1 по формуле (2.3.3):
CHCl=[H + ]/ αn=0,001 моль/л.
Молекулярный вес HCl равен 36,5. Следовательно, надо взять 36,5*0,001= 0,0365 гр HCl, чтобы получить раствор, РН которого равно трем.
48. Вычислить константу диссоциации уксусной кислоты, если степень диссоциации ее в 0,1 Η растворе равна 1,32%.
51. Вычислить константу диссоциации Н2CО3 (первая ступень), если степень ее диссоциации в 0,1 Η растворе равна 0,00173.
54. Вычислить степень диссоциации и концентрацию водородных ионов в 0,1 Μ растворе Н2СО3, Кдисс которой (первая ступень) V о 1 г»_7 г 3 ДИСС
Определите величину Кдисс.
60. Считая диссоциацию Na2CO3 полной, вычислить концентрацию иона CO3 2- в 0,5 Μ растворе соли.
65. Число ионов водорода в растворе в 100 раз больше, чем ионов гидроксила. Чему равен рН этого раствора?
66. Какое количество едкого натра растворено в 200 мл раствора ΝаΟΗ, если рН этого раствора равен 12?
67. Сколько граммов NаОН содержится в 5 л раствора, рΗ которого равен 11 (α = 100%)?
70. Сколько ионов водорода содержится в 1 мл раствора, рН которого равен 13?
71. Вычислить концентрацию раствора HCl (α = 1), имеющего рН= 3.
72. Вычислить рН раствора КОН, если титр его равен 0,00028 г/мл.
Степень диссоциации
«Степень диссоциации это есть отношения числа продиссоциируемых молекул к общему числу молекул и умноженному на 100%»:
числа распавшихся на ионы молекул к общему числу растворенных молекул.
Степень диссоциации 




Пример
Методы определения
Мнимая степень диссоциации
Поскольку сильные электролиты диссоциируют практически полностью, можно было бы ожидать для них изотонический коэффициент, равный количеству ионов (или поляризованных атомов) в формульной единице (молекуле). Однако в действительности этот коэффициент всегда меньше определённого по формуле. Например, изотонический коэффициент для 0,05-моляльного раствора NaCl равен 1,9 вместо 2,0, (для раствора сульфата магния той же концентрации и вовсе i = 1,3). Это объясняет теория сильных электролитов, разработанная в 1923 году П. Дебаем и Э. Хюккелем: передвижение ионов в растворе затруднено образовавшейся оболочкой сольватации. К тому же, ионы взаимодействуют и между собой: разноимённо заряженные притягиваются, а одноимённо заряженные — отталкиваются; силы взаимного притяжения приводят к образованию групп ионов, перемещающихся по раствору совместно. Такие группы называют ионными ассоциатами или ионными па́рами. Соответственно, раствор ведёт себя так, будто содержит меньше частиц, чем на самом деле, ведь свобода их перемещения ограничена. Наиболее очевиден пример, касающийся электропроводности растворов λ, которая возрастает с разбавлением раствора. Через отношение реальной электропроводности к таковой при бесконечном разбавлении определяют мнимую степень диссоциации сильных электролитов, также обозначаемую через α:

где nimg — мнимое, а ndisslv. — реальное количество частиц в растворе.