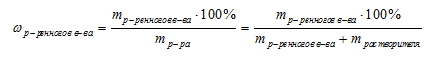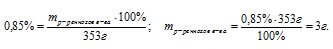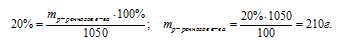Как узнать массу растворителя
Методы решения расчетных задач по химии, связанные с концентрацией растворов
Во всех задачах этой группы присутствуют расчеты, связанные с концентрацией растворов. Причем во всех тестах используется единственный способ выражения концентрации — массовая доля. Поэтому при решении практически всех задач В9 мы будем пользоваться соотношением для определения массовой доли:
Анализ всех задач, предлагавшихся для решения, за последние годы позволяет распределить их на четыре группы:
1. Определение массы растворенного вещества в определенной порции раствора при известной концентрации;
2. Приготовление раствора путем растворения определенного количества вещества в некотором объеме (массе) растворителя;
3. Изменение концентрации уже имеющегося раствора одним из следующих способов:
а) добавлением к раствору того же растворенного вещества;
б) добавлением к раствору растворителя;
в) смешиванием двух различных растворов одного и того же вещества;
г) выпариванием растворителя или растворенного вещества из раствора.
4. Использование химической реакции в процессе приготовления раствора.
В этой статье,рассмотрим задачи 1-й из вышеперечисленных четырех групп.
Определение массы растворенного вещества в растворе
Ответ: масса растворенного вещества равна 3г.
Ответ: m(НNO3) 210 г.
Источник:
ЕГЭ. Химия. Расчетные задачи в тестах ЕГЭ. Части А, В, С / Д.Н. Турчен. — М.: Издательство «Экзамен», 2009. — 399 [1]с. (Серия «ЕГЭ. 100 баллов»). I8ВN 978-5-377-02482-8.
Сколько ложечек сахара ты кладешь в чай?
– Дома – две, в гостях – восемь.
Концентрацию вещества можно выражать различными способами. Кстати, число ложечек на чашку воды – способ вполне приемлемый, но только для кухни. Трудно представить себе химика, приготавливающего раствор таким образом.
Один из самых распространенных способов выражения концентрации раствора – через массовую долю растворенного вещества.
Массовой долей вещества в растворе называют отношение массы растворенного вещества к массе раствора:
Не правда ли, очень похоже на объемную долю? Так оно и есть, ведь любая доля, как вы уже знаете, – это отношение какой-то части к целому. Как и массовая доля элемента в сложном веществе, массовая доля вещества в растворе обозначается греческой буквой («омега» ) и может принимать значения от 0 до 1 (или от 0 до 100%). Она показывает, какая часть массы раствора приходится на растворенное вещество. И еще: массовая доля вещества в процентах численно равна массе растворенного вещества в 100 г раствора. К примеру, в 100 г 3%-го раствора уксуса содержится 3 г чистой уксусной кислоты.
Самые простые растворы состоят из двух компонентов. Один из компонентов раствора – растворитель. Для нас более привычны жидкие растворы, значит, растворитель в них – жидкое вещество. Чаще всего – вода.
Другой компонент раствора – растворенное вещество. Им может быть и газ, и жидкое, и твердое вещество.
Масса раствора складывается из массы растворителя и массы растворенного вещества, т. е. верно выражение:
Предположим, массовая доля растворенного вещества равна 0,1, или 10%. Значит, оставшиеся 0,9, или 90%, – это массовая доля растворителя.
Массовая доля растворенного вещества широко используется не только в химии, но и в медицине, биологии, физике, да и в повседневной жизни. В качестве иллюстрации к сказанному рассмотрим решение некоторых задач прикладного характера.
Задача 1. Перед посадкой семена томатов дезинфицируют (протравливают) 1%-м раствором марганцовки. Какую массу такого раствора можно приготовить из 0,25 г марганцовки?
(марганцовки) = 0,01 г,
m(марганцовки) = 0,25 г.
Зная массу растворенного вещества и его массовую долю в растворе, можно вычислить массу раствора:
Как найти массу растворителя в растворе?
Растворимость соединений, состоящих в одном гомологическом ряду значительно уменьшается в случае увеличения молекулярной массы, это связано с тем, что межмолекулярные силы взаимодействия повышаются.
К примеру, бензол способен полностью смешаться с этанолом, тогда как этанол и антрацен смешиваются только частично. Влияние молекулярной массы на общую растворимость особенно заметно в макромолекулах. Например, ацетон, спирт и концентрированная уксусная кислота способны легко растворить стирол, однако не могут растворить полистирол; винилацетат без проблем растворяется в эфирах и насыщенных углеводородах, но с поливинилацетатом такое не наблюдается. В спиртах не растворяется целлюлоза, в эфирах – полиэтиленгликоль, в винилхлориде – поливинилхлорид, в ацетонитриле – полиакрилонитрил, хотя наличие химического родства между этими полимерами и мономерами очевидно.
Из-за большой молекулярной массы структурированные полимеры не способны раствориться в растворителях даже при высокой температуре. Одна они способны набухать в присутствии растворителей в зависимости от плотности и природы поперечных связей.
В растворах общее соотношение количеств растворителя и растворенного вещества бывает разным. Если же количество растворенного вещества в отношении к растворителю довольно большое, то этот раствор называется концентрированным. В противном случает этот раствор считается слабым.
Масса раствора представляет собой сумму масс растворителя и растворенного вещества. К примеру, если 10 г сахара растворить в 100 г воды, то масса всего раствора составит 110 г. При описании любого раствора очень важной характеристикой считается его концентрация, т.е. сколько процентов занимает растворенное вещество в растворе. Например, если масса растворителя 647 равна 10 г, а масса раствора 110 г, то для нахождения концентрации 647 растворителя нужно 10 г разделить на 110 г, а результат умножить на 100%. Следовательно, 10г/110г*100%=9,09%.
Концентрация растворов точно описывает массовую долю всего растворенного вещества (w) – отношение всей массы растворенного вещества к массе раствора. Следует отметить, что именно отношение к массе самого раствора, а не к общей массе растворителя. Массовая доля выражается в процентах и в долях (безмерная величина).
Если же масса раствора будет составлять 200 г, а масса растворенного вещества в данном растворе равняется 50 г, то рассчитать массовую долю очень просто – 50/200 = 25% или 0,25. Также легко можно найти массовую долю самого растворителя. Она будет равна 200-50 = 150 г, таким образом, 150/200 = 75% или 0,75.
Концентрация растворов. Способы выражения концентрации растворов.
Концентрация раствора может выражаться как в безразмерных единицах (долях, процентах), так и в размерных величинах (массовых долях, молярности, титрах, мольных долях).
Способы выражения концентрации растворов.
1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:

ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
Массовую долю выражают в долях от единицы или в процентах.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:

C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl);
n – количество растворенного вещества, моль;
V – объём раствора, л.
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m:

С (x) – моляльность, моль/кг;
n – количество растворенного вещества, моль;
4. Титр – содержание вещества в граммах в 1 мл раствора:

T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г;
5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе:

N – мольная доля растворённого вещества;
n – количество растворённого вещества, моль;
nр-ля – количество вещества растворителя, моль.
Сумма мольных долей должна равняться 1:
Иногда при решении задач необходимо переходить от одних единиц выражения к другим:
М(Х) – молярная масса растворенного вещества;
ρ= m/(1000V) – плотность раствора. 6. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора.
Грамм-эквивалент вещества – количество граммов вещества, численно равное его эквиваленту.
Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.

СН – нормальная концентрация, моль-экв/л;
z – число эквивалентности;
Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при конкретной температуре, к массе растворителя:
Как найти массу растворителя в растворе?
Растворимость соединений, состоящих в одном гомологическом ряду значительно уменьшается в случае увеличения молекулярной массы, это связано с тем, что межмолекулярные силы взаимодействия повышаются.
К примеру, бензол способен полностью смешаться с этанолом, тогда как этанол и антрацен смешиваются только частично. Влияние молекулярной массы на общую растворимость особенно заметно в макромолекулах. Например, ацетон, спирт и концентрированная уксусная кислота способны легко растворить стирол, однако не могут растворить полистирол; винилацетат без проблем растворяется в эфирах и насыщенных углеводородах, но с поливинилацетатом такое не наблюдается. В спиртах не растворяется целлюлоза, в эфирах – полиэтиленгликоль, в винилхлориде – поливинилхлорид, в ацетонитриле – полиакрилонитрил, хотя наличие химического родства между этими полимерами и мономерами очевидно.
Из-за большой молекулярной массы структурированные полимеры не способны раствориться в растворителях даже при высокой температуре. Одна они способны набухать в присутствии растворителей в зависимости от плотности и природы поперечных связей.
В растворах общее соотношение количеств растворителя и растворенного вещества бывает разным. Если же количество растворенного вещества в отношении к растворителю довольно большое, то этот раствор называется концентрированным. В противном случает этот раствор считается слабым.
Масса раствора представляет собой сумму масс растворителя и растворенного вещества. К примеру, если 10 г сахара растворить в 100 г воды, то масса всего раствора составит 110 г. При описании любого раствора очень важной характеристикой считается его концентрация, т.е. сколько процентов занимает растворенное вещество в растворе. Например, если масса растворителя 647 равна 10 г, а масса раствора 110 г, то для нахождения концентрации 647 растворителя нужно 10 г разделить на 110 г, а результат умножить на 100%. Следовательно, 10г/110г*100%=9,09%.
Концентрация растворов точно описывает массовую долю всего растворенного вещества (w) – отношение всей массы растворенного вещества к массе раствора. Следует отметить, что именно отношение к массе самого раствора, а не к общей массе растворителя. Массовая доля выражается в процентах и в долях (безмерная величина).
Если же масса раствора будет составлять 200 г, а масса растворенного вещества в данном растворе равняется 50 г, то рассчитать массовую долю очень просто – 50/200 = 25% или 0,25. Также легко можно найти массовую долю самого растворителя. Она будет равна 200-50 = 150 г, таким образом, 150/200 = 75% или 0,75.