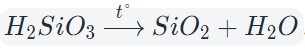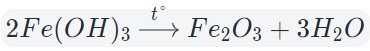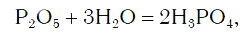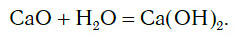Как узнать формулу оксида
Формулы оксидов
Общая формула оксидов
Общая формула оксидов: ЭхОу
Кислород имеет второе по величине значение электроотрицательности (после фтора), поэтому большинство соединений химических элементов с кисло родом являются оксидами.
Классификация оксидов
К солеобразующим оксидам относят те оксиды, которые способны взаимодействовать с кислотами или с основаниями с образованием соответствующей соли и воды. К солеобразующим оксидам относятся:
Несолеобразующие оксиды не взаимодействуют ни с кислотами, ни с основаниями, соответственно, солей не образуют. N2O, NO, CO, SiO.
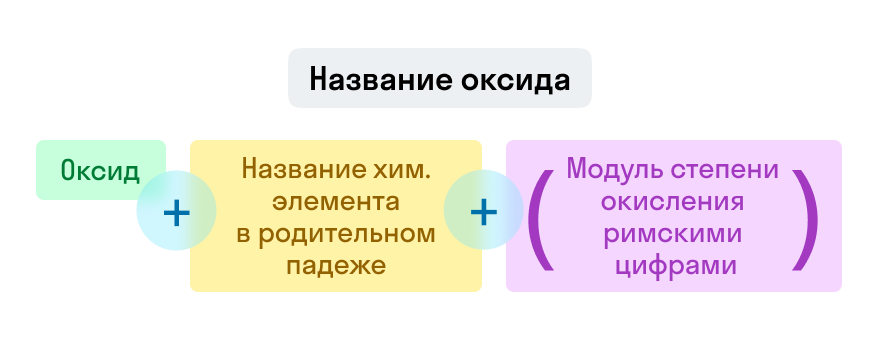
Согласно номенклатуре ИЮПАК названия оксидов составляются из слова оксид и названия второго химического элемента (с меньшей электроотрицательностью) в родительном падеже:
Оксид кальция – CaO.
Если элемент способен образовывать несколько оксидов, то в их названиях следует указать степень окисления элемента (римской цифрой в скобках после названия):
MnO2 – оксид марганца (IV).
Допускается использовать латинские приставки для указания количества атомов элементов, входящих в молекулу оксида:
Na2O –оксид динатрия;
CO – монооксид углерода;
СО2 – диоксид углерода.
Часто используются также тривиальные названия некоторых оксидов:
Как узнать формулу оксида
Порядок составления формул оксидов
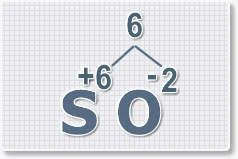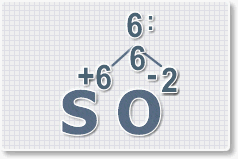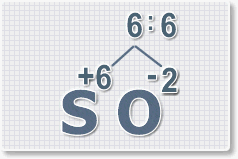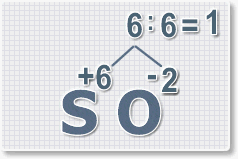
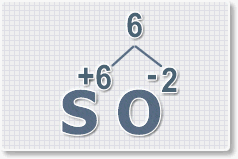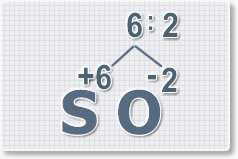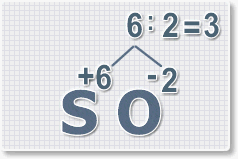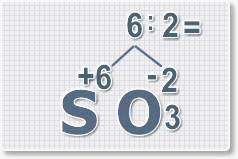
Формулы оксидов можно составлять по правилу креста:
Таблица.1 Степени окисления некоторых элементов
С неметаллами кислород образует оксид, если только этот неметалл менее электроотрицательный, чем сам кислород см. таблицу электроотрицательности.
Составим формулу оксида натрия :
Правило наименьшего общего кратного это способ наиболее универсальный для составления формул. Как им пользоваться рассмотрим на примере.
6 : 2 = 3 это индекс для кислорода
В результате получим формулу оксида серы (VI):
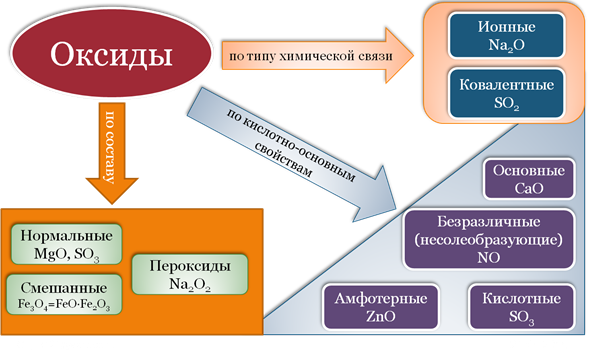
Оксиды
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
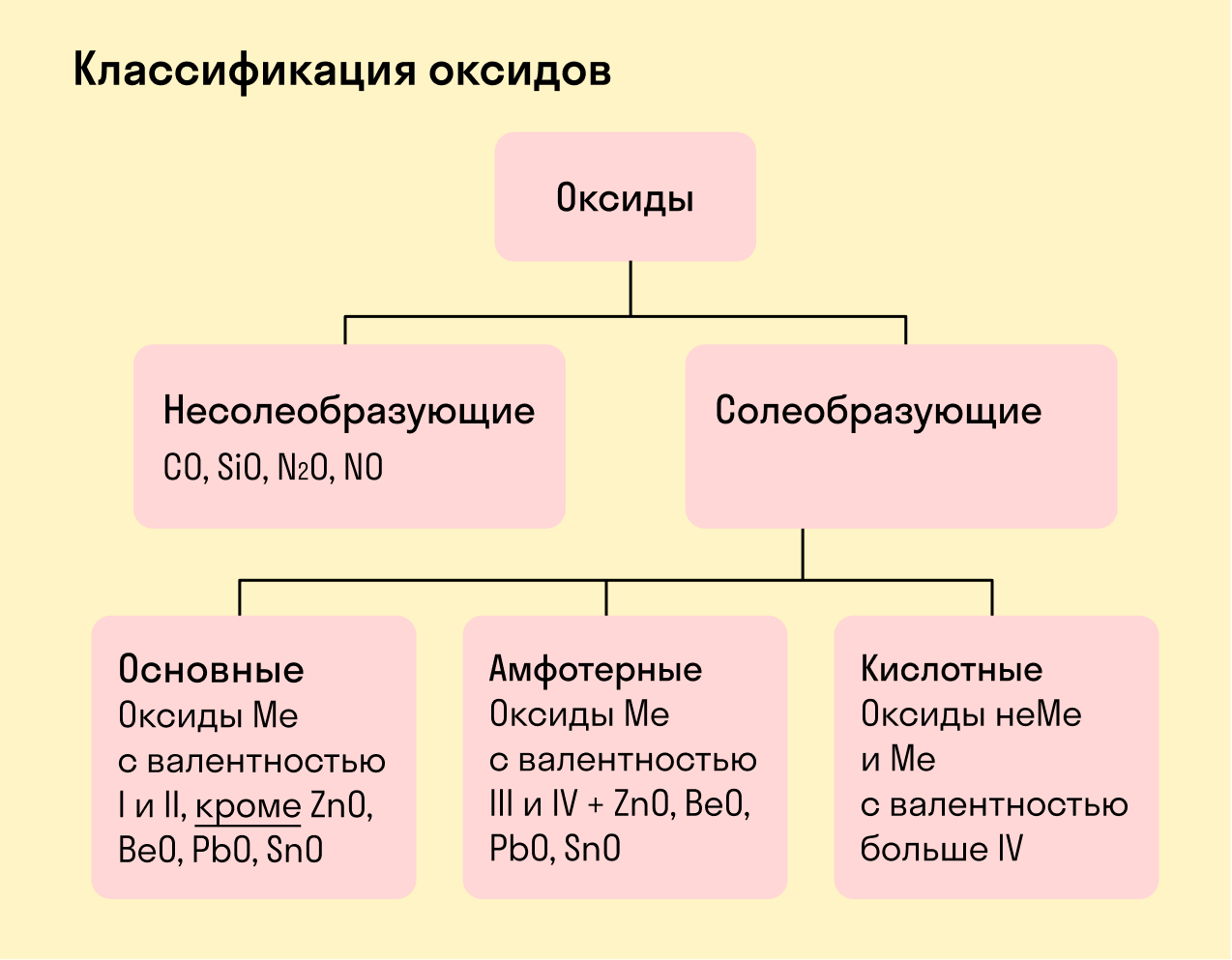
Виды оксидов
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na +1 2O, Ca +2 O, Ba +2 O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al +3 2O3, Fe2 +3 O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S +6 O3, N2 +5 O5, Mn2 +7 O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
Названия оксидов строятся по систематической номенклатуре следующим образом:
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида
Бытовое (тривиальное название)
Возможное научное название
Химические свойства основных оксидов
1. Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота
2. Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль
Кислотный оксид + основание = соль + вода
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль
Кислотный оксид + амфотерный оксид = соль + вода
Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль
Амфотерный оксид + кислота = соль + вода
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль
4. Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль
Амфотерный оксид + щелочь (расплав) = средняя соль + вода
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Урок 31. Оксиды
В уроке 31 «Оксиды» из курса «Химия для чайников» познакомимся с оксидами их классификацией, а также узнаем где они встречаются в природе.
Все неорганические вещества делятся на несколько классов, важнейшими из которых являются оксиды, кислоты, основания и соли. Первоначальные сведения об этих веществах вы уже получили. Теперь вам предстоит познакомиться с ними более подробно и систематизировать свои знания.
Вы уже знаете, что самым распространенным элементом на Земле является кислород. Его атомы, соединяясь с атомами других элементов, образуют огромное количество сложных неорганических веществ, среди которых важное место занимают оксиды.
Состав оксидов
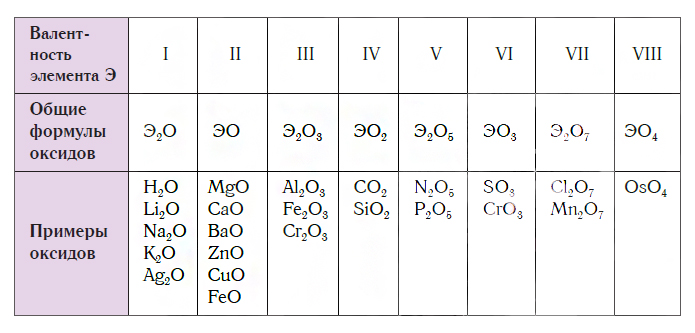
В состав любого оксида входят атомы двух химических элементов, один из которых — кислород, например: Н2О, Al2O3, Р2О5, CuO, Cl2O7. Всего известно около трехсот разных оксидов. Их общая химическая формула — ЭxOy, где буква Э обозначает символ химического элемента, образующего оксид, О — символ кислорода, а буквы x и y — индексы, обозначающие число атомов в молекулах или в формульных единицах оксидов.
Поскольку валентность атомов кислорода в оксидах всегда равна II, а валентность атомов других элементов принимает значения от I до VIII, состав оксидов выражается формулами, приведенными в следующей таблице.
Классификация оксидов
Поскольку оксидов известно очень много, возникает необходимость классификации этих веществ по их химическим свойствам, т. е. по способности превращаться в другие вещества.
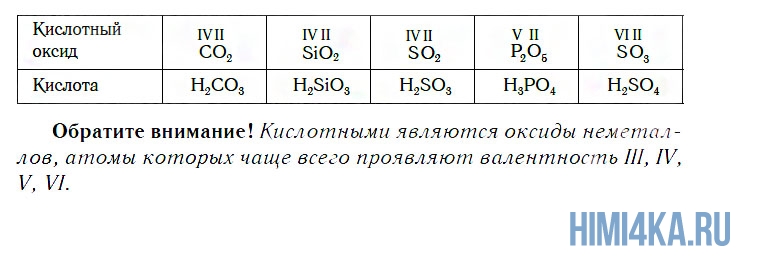
Вы уже знаете, что оксиды могут реагировать с водой, превращаясь при этом в соединения двух типов — кислоты и основания. Так, например, оксид фосфора(V) P2O5, присоединяя воду, превращается в кислоту H3PO4:
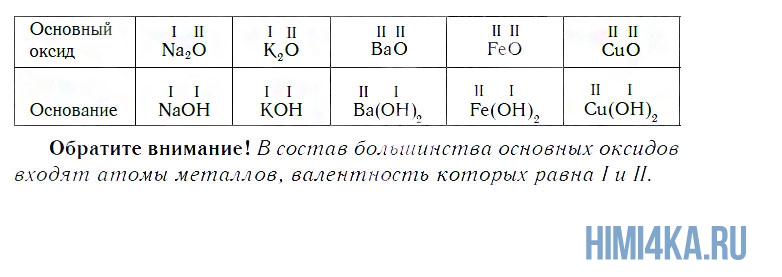
а оксид кальция CaO, взаимодействуя с водой, превращается в основание Ca(OH)2:
Иначе говоря, оксиду фосфора соответствует кислота, а оксиду кальция соответствует основание. Исходя из этого, оксиды можно разделить на две большие группы — кислотные и основные оксиды.
К кислотным относятся оксиды, которым соответствуют кислоты. Наряду с Р2О5, кислотными являются также оксиды: CO2, SiO2, SO2, N2O5, SO3 и некоторые другие. Всем им соответствуют кислоты.
К основным относятся оксиды, которым соответствуют основания. Кроме СaO, основными являются оксиды: Na2O, K2O, BaO, FeO, CuO и ряд других. Всем этим оксидам соответствуют основания.
Оксиды в природе
Оксиды содержатся в каждой из трех оболочек нашей планеты — в атмосфере, гидросфере, литосфере.
Самым распространенным оксидом в атмосфере и гидросфере является вода H2O, а в литосфере — оксид кремния(IV) SiO2, встречающийся в виде красивых кристаллов кварца (рис. 116) и кварцевого песка.
Краткие выводы урока:
Надеюсь урок 31 «Оксиды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Оксиды – Химия 8 класс
Химические формулы оксидов и их названия Вам уже известно, что оксиды – это бинарные соединения, в состав которых обязательно входит химический элемент кислород.
На сегодняшний день получены оксиды всех существующих в природе химических элементов кроме трех: гелия, неона и аргона.
Рассмотрим химические формулы оксидов, с которыми мы уже встречались:
CO2, SO2, Fe3O4 и т.д.
Как видно, в формулах оксидов на первом месте принято записывать химический символ элемента, который образует оксид, а на втором – химический символ кислорода. Попробуем вывести общую формулу для оксидов, то есть формулу, при помощи которой можно составить формулу оксида любого элемента. Элемент, образующих оксид, будем обозначать буквой R, а его валентность в оксиде, как х.
С учетом того, что валентность кислорода равна II, получим:
Итак, общая формула оксидов:
Рассмотрим пример. Необходимо составить формулы оксидов серы, в которых сера проявляет валентность IV и VI. Получаем: В тех случаях, когда оксид образован химическим элементом с переменной валентностью, после названия оксида, в скобках, римской цифрой указывается валентность элемента в данном оксиде.
Например:
SO2 – оксид серы (IV), SO3 – оксид серы (VI). Если валентность химического элемента постоянна, естественно, он может образовать с кислородом только один оксид. В таких случаях валентность в скобках после названия не указывается. Например: ZnO – оксид цинка
Классификация оксидов
Оксиды – весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд природных пигментов. Оксидами также является класс минералов, представляющих собой соединения металлов с кислородом. Самым распространенным оксидом в земной коре является минерал кварц, его систематическое название – оксид кремния (IV) – SiO2. Этот оксид образует множество различных минералов, которые геологи объединяют в минералы группы кварца.
По своему агрегатному состоянию оксиды могут быть газообразными: углекислый газ CO2, сернистый газ SO2 – эти газы бесцветны. А оксид азота (IV) NO2 – газ коричневого цвета.
Оксидов – жидкостей в обычных условиях сравнительно немного. Примеры таких оксидов: вода – оксид водорода, оксид марганца (VII) Mn2O7, оксид хлора (VII) Cl2O7, оксид хлора (VI) ClO3.
Большинство оксидов – твердые вещества, имеющие молекулярное или ионное строение.
Оксиды металлов имеют ионное строение. В кристаллических решетках оксидов металлов находятся ионы кислорода O2− и ионы соответствующего металла. Оксиды неметаллов, как правило, имеют молекулярное строение. На рисунке 139 приведена модель молекулы оксида фосфора (V).
Химическая формула оксида фосфора (V), которую мы уже записывали не раз – P2O5.
На самом деле это эмпирическая, простейшая формула. Истинная химическая формула, которая реально отвечает строению оксида фосфора (V) – P4O10 Существуют оксиды и атомного строения. К таким оксидам относятся оксид бора B2O3, оксид кремния (IV) SiO2. Кристаллические решетки этих оксидов состоят из атомов.
Применение оксидов
Многие оксиды нашли разнообразное применение в различных сферах деятельности человека. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически нерастворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO2. Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды. TiO2 добавляют в качестве наполнителя в мыло, лекарственные препараты, которые выпускаются в виде таблеток.
Оксид хрома (III) – Cr2O3 – кристаллы темно-зеленого цвета (см. рисунок 138, а), нерастворимые в воде. Cr2O3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Благодаря нерастворимости и прочности оксида хрома (III) его используют и в полиграфических красках (например, для окраски денежных купюр). Вообще, оксиды многих металлов применяются в качестве пигментов для самых разнообразных красок, хотя это далеко не единственное их применение Оксиды неметаллов так же имеют широкое применение. Углекислый газ, или оксид углерода (IV) – CO2 применяется как наполнитель углекислотных огнетушителей, так как данный оксид негорюч. Сернистый газ, или оксид серы (IV) – SO2 применяется в качестве дезинфицирующего вещества для зернохранилищ. Как вы уже заметили, множество химических веществ имеют тривиальные названия. Ниже приведены тривиальные названия некоторых оксидов:
| Химическая формула | Химическое название | Тривиальное название |
| СО | Оксид углерода (II) | Угарный газ |
| СО2 | Оксид углерода (IV) | Углекислый газ |
| SO2 | Оксид серы (IV) | Сернистый газ |
| Al2O3 | Оксид алюминия | Глинозём |
| СаО | Оксид кальция | Негашеная известь |