Как узнать форму молекулы
Как узнать форму молекулы
**§3.6 Пространственная форма молекул.
Формулы Льюиса многое говорят об электронном строении и устойчивости молекул, но пока ничего не могут сказать об их пространственном строении. В теории химической связи существуют два хороших подхода к объяснению и предсказанию геометрии молекул. Они хорошо согласуются между собой.
Первый подход называется теорией отталкивания валентных электронных пар (ОВЭП). Несмотря на “страшное” название, суть этого подхода очень проста и понятна:
химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга.
Поясним на конкретных примерах. В молекуле BeCl 2 есть две связи Be—Cl. Форма этой молекулы должна быть такой, чтобы обе эти связи и атомы хлора на их концах располагались как можно дальше друг от друга:
Другой пример: в молекуле BF 3 имеется 3 связи B—F. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника, где все углы между связями (углы FBF) равны 120 о :
В молекуле CH 4 угол НСН такой же, как в математическом тетраэдре: 109 о 28’.
Последний пример: молекула H 2 O в своем составе имеет две связи O—H и две неподеленные пары электронов. Вывод: эта молекула также должна иметь форму, похожую на тетраэдр.
Теория отталкивания валентных электронных пар (ОВЭП) проста и наглядна. Она опирается на классическую геометрию и позволяет правильно предсказывать форму молекул.
Однако образование одинаковых связей из атомных орбиталей разного вида потребовало введения такого понятия, как ГИБРИДИЗАЦИЯ (то есть “смешивание”) атомных орбиталей. Почему это понятие стало необходимо?
Чтобы объяснить равноценность связей Be—Cl, говорят о sp-гибридизации валентных атомных орбиталей бериллия, при которой одна s-орбиталь и одна p-орбиталь (они обведены овалом на орбитальной диаграмме) как бы смешиваются и выравниваются по форме и энергии, давая две одинаковые sp-гибридные орбитали (рис. 3-7).
Существует важное правило:
При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ АТОМНЫХ ОРБИТАЛЕЙ.
Если бы не происходило гибридизации (“выравнивания” связей O-H), валентный угол HOH был бы равен 90°, потому что атомы водорода были бы присоединены к двум взаимно перпендикулярным р-орбиталям. В этом случае наш мир выглядел бы, вероятно, совершенно по-другому. Почему? На этот вопрос вы сможете ответить сами, когда прочтете о молекуле H 2 O в отдельной главе, посвященной воде и растворам.
Геометрия молекул
Геометрия молекул
Российский университет дружбы народов, Москва
ВВедение
Определение пространственного расположения атомов в молекуле, то есть геометрии молекулы, представляет собой в настоящее время задачу, вполне разрешимую даже для достаточно сложной молекулы, путем решения соответствующей квантовохимической задачи.
Вместе с тем существуют приближенные подходы, которые могут быть использованы для анализа экспериментальных данных по геометрическим конфигурациям молекул.
К числу подобных подходов относятся:
— метод валентных связей
— метод трехцентровых связей
— метод отталкивания валентных электронных пар
метод валентных связей
Метод валентных связей наиболее известен и включает рассмотрение таких понятий как валентность, гибридизация атомных орбиталей, направленность ковалентных связей и т. д.
Согласно теории валентных связей химическая связь между двумя атомами А и В образуется с помощь общей пары электронов
А + В = А ¯ В ковалентная связь
А ¯ + В = А ¯ В донорно-акцепторная связь
Валентность характеризует способность атомов, образовывать химические связи, и равна числу химических связей образованных атомом. Согласно методу валентных связей валентность равна числу общих пар электронов, а в случае ковалентной связи валентность равна числу неспаренных электронов на внешнем уровне атомов в основном или возбужденных состояниях.
C 2s22p2 ¯ вал = II C=O
C* 2s12p3 вал = IV О=C=O
S 3s23p4 ¯ ¯ вал = II H-S-H
S* 3s23p33d1 ¯ вал = IV SO2
S** 3s13p33d2 вал = VI SO3
Гибридизация атомных орбиталей – это смешивание АО разных подуровней атома, электроны которых участвуют в образовании эквивалентных s-связей. Для определения типа гибридизации определяют число s-связей, образованных атомом.
 |
Расположение гибридных орбиталей
Три неспаренных электрона на гибридных орбиталях бора взаимодействуют с неспаренными р-электронами фтора с образованием трех ковалентных связей. В силу направленности ковалентных связей эти три связи располагаются под теми же углами 120о, что и гибридные орбитали, и молекула BF3 имеет плоское строение с углами 120о между связями.
Молекула СlF3. Атом хлора в основном состоянии имеет лишь один неспаренный электрон. Для объяснения существующей и равной трем валентности хлора предполагается переход этого атома в возбужденное состояние: Cl 3s23p5 ® Cl* 3s23p43d1, в котором имеются три неспаренных электрона. Поскольку в гибридизации участвуют АО, содержащие как по одному, так и по два электрона, то имеется пять dsp3-ГО, на которых находятся две неподеленные пары и три неспаренных электрона (рис.1.). Подобные гибридные орбитали имеют тригонально-бипирамидальное расположение. Из пяти возможных мест координации (двух аксиальных и трех экваториальных) более выгодными (с меньшим межлигандным отталкиванием) оказываются экваториальные положения. Именно два из них и занимаются неподеленными парами. А неспаренные электроны занимают оставшееся экваториальное положение и аксиальные положения. В силу направленности ковалентных связей расположение связей Cl – F аналогично расположению орбиталей с неспаренными электронами, а молекула ClF3 имеет Т-образное строение с углом между связями, близким к 90о.

Рис. 1. Геометрия молекулы ClF3 в методе валентных связей: расположение гибридных орбиталей; расположение связей и неподеленных пар; расположение связей.
Метод трехцентровых связей
Применение метода валентных связей к элементам VА – VIIIА групп периодической системы элементов требует возбуждения одного или нескольких электронов с орбитали р на орбиталь d. Энергия подобного возбуждения велика и, во всяком случае, больше энергии двух образующихся связей. Это означает, что такое возбуждение не может иметь место во время образования связи и что использование теории валентных связей для этих соединений не корректно. Так для р-элементов V – VIII групп периодической системы разница между энергиями ns—, np- и nd-орбиталями более 1000 кДж/моль. Это значит, что энергии ns-орбиталей малы, энергии nd—орбиталей велики, чтобы взаимодействовать с орбиталями других атомов. Поэтому только np—орбитали могут взаимодействовать с орбиталями других атомов. Однако число неспаренных np— электронов недостаточно для объяснения возможных валентностей и уменьшается к концу периода, в то время как высшая валентность увеличивается. Возникает вопрос, могут ли пары р-электронов образовывать связи? Положительный ответ на этот вопрос дает теория трехцентровых связей.
Рассмотрим трехатомную линейную молекулу MX2 с помощью метода МО. Атом М имеет р-орбиталь с двумя электронами. Каждый из двух атомов X имеет одну р-орбиталь, содержащую один электрон. Взаимодействие этих орбиталей приводит к системе из трех МО: s (связывающей), s0 (несвязывающей) и s* (антисвязывающей). Связывающие и антисвязывающие МО содержат вклады всех трех атомов, несвязывающие МО образованы АО только двух атомов лигандов (рис.2).
Рис. 2. Схема МО линейного трехцентрового фрагмента Х-М-Х.
Такая система устойчива, порядок связи равен 0,5(2-0) = 1 для трехцентровой связи, т. е. по 0,5 единиц на каждую двухцентровую связь. Подобная связь менее устойчива, чем двухцентровая ковалентная связь.
Видно, что перед образованием связи атом М имел два электрона, атомы Х имели по одному электрону. В образовавшейся системе АО атомов Х формируют целиком несвязывающую МО и участвуют в образовании связывающей МО, и на них находится существенно больше двух электронов. Таким образом, образование подобной трехцентровой связи сопровождается переносом электронной плотности с атома М на атом Х. Это может иметь место только при условии, если атомы Х будут существенно более электроотрицательными, чем атом М.
Можно сделать вывод. Электронная пара р-электронов способна к образованию связи с двумя электроотрицательными лигандами с образованием линейного трехцентрового фрагмента. Подобные связи называются трехцентровыми или гипервалентными I.
Квантовохимические расчеты показали, что в случае максимальной валентности р-элемента его s-электроны могут частично принимать участие в образовании связи и образовывать связи, называемые гипервалентные II и более прочные, чем в рассмотренном случае трехцентровых связей. Геометрическое расположение связей в этом случае определяется их взаимным отталкиванием.
Таким образом, в соединениях р-элементов могут быть три типа химических связей: ковалентные связи, трехцентровые связи (или гипервалентные I) и гипервалентные II связи.
Теория трехцентровых связей – это логическое продолжение теории валентных связей в случаях, когда возбуждения s®p или p®d маловероятны, а центральный атом имеет неподеленную пару р-электронов. В соединениях, образование которых не требует возбуждения электронов или для которых энергия подобного возбуждения мала, образуются только ковалентные связи и использование теории валентных связей оправдано и корректно.
Молекулы SF2, SF4, SF6.
Сера имеет два неспаренных р-электрона, неподеленную пару р-электронов и неподеленную пару s-электронов.
В молекуле SF2 обе образующиеся связи – ковалентные. В молекуле SF4 две связи – ковалентные и одна связь – трехцентровая, гипервалентная I. В молекуле SF6 валентность серы максимальна и все связи – гипервалентные II.
Молекула SF2 угловая из-за взаимодействия связывающих пар электронов с неподеленными парами электронов серы.
Молекула SF4 содержит линейный фрагмент F-S-F трехцентровой связи. Две ковалентные связи и неподеленная пара электронов серы лежат в плоскости перпендикулярной этому фрагменту с учетом их взаимного отталкивания (рис.3).
Молекула SF6 октаэдрическая, так как подобному расположению лигандов соответствует их минимальное отталкивание.
Атом хлора имеет один неспаренный электрон и две неподеленные пары р-электронов. Этот атом может образовать одну ковалентную и две трехцентровые связи.
В молекуле ClF имеется она ковалентная связь, в молекуле ClF3 – одна ковалентная и одна трехцентровая связи, а в молекуле ClF5 – одна ковалентная и две трехцентровые связи.
Поскольку каждой трехцентровой связи соответствует линейный фрагмент, то молекула ClF3 имеет Т-образную форму, молекула ClF5 – форму тетрагональной пирамиды (рис.3).
Атом ксенона не имеет неспаренных электронов и не может образовывать ковалентные связи. Однако ксенон имеет три неподеленные пары р-электронов и может образовывать до трех трехцентровых связей.
В молекуле XeF2 имеется одна гипервалентная I связь, в молекуле XeF4- две, а в молекуле XeF6- три таких же связи.
Вследствие взаимного расположения трехцентровых связей молекула XeF2 – линейная, молекула XeF4 – квадратная, а молекула XeF6 – октаэдрическая. Энергии образующихся связей невелики, они меньше, чем энергии ковалентных связей, однако молекулы устойчивы.
Рис. 3. Геометрия молекул SF4, SF6, ClF3, ClF5 в методе трехцентровых связей. Обозначения связей: ковалентные – черные толстые, гипервалентные I – серые, гипервалентные II – черные тонкие.
Теория трехцентровых связей объясняет, почему получены многочисленные соединения для ксенона, немногочисленные – для криптона, но соединения практически отсутствуют для аргона, неона и гелия (речь идет о нейтральных молекулах), почему большинство найденных соединений являются фторидами или оксидами. Согласно теории трехцентровых связей, необходимым условием образования подобных связей является большая разность электроотрицательностей центрального атома и лигандов. Подобная связь не образуется, если вместо ксенона брать менее электроположительный атом или вместо фтора или кислорода брать менее электроотрицательный атом.
метод отталкивания валентных электронных пар
Согласно этой теории молекулы или ионы, содержащие только простые связи, на валентном уровне центрального атома М могут иметь два типа электронных пар: связывающие пары связей М-Х и неподеленные пары электронов Е.
Эти связывающие и неподеленные пары электронов располагаются таким образом, чтобы их взаимное отталкивание было минимальным.
Это приводит к их определенному расположению в пространстве в зависимости от общего числа электронов (см. таблицу 1).
Учитывая общее число электронных пар атома М (n) и тип молекулы (например, МХ2Е – имеются две связывающие пары и одна неподеленная), можно установить геометрию молекул.
Таблица 1. Геометрия молекул в зависимости от числа электронных пар n и типа молекулы.
1. Неподеленная пара электронов имеет в области центрального атома больший объем, чем общая связывающая пара электронов. Отталкивание неподеленной пары электронов больше, чем отталкивание общей пары электронов.
2. Отталкивание двойной связи больше, чем отталкивание простой связи.
Это правило позволяет рассматривать геометрию молекул с кратными связями. Согласно этому правилу двойная связь занимает на периферии центрального атома одну позицию, имея отталкивание большее, чем отталкивание простых связей.
В молекуле этилена каждый атом углерода имеет четыре электрона. Два из них образуют двойную связь С=С, два других – две простых связи С-Н. Около углерода имеется три электронных облака, имеющих тригональное расположение. Поскольку отталкивание двойной связи больше, чем отталкивание простых связей, то угол между связями С-Н должен быть меньше 120о. Экспериментальное значение этого угла Н-С-Н равно 117,7о.
3. Отталкивание связывающей пары уменьшается с увеличением электроотрицательности лиганда.
С увеличением электроотрицательности лиганда электронная плотность связывающей общей пары электронов смещается в сторону лиганда и уменьшается в области центрального атома, поэтому отталкивание этой пары будет меньшим, чем отталкивание других общих пар электронов.
В случае молекулы NF3, имеющей ту же пирамидальную геометрию, что и молекула NH3, валентный угол должен быть меньше не только тетраэдрического угла 109,5о, из-за большего отталкивания неподеленных пар электронов по сравнению со связывающими парами, но и меньше значения 107,3о, наблюдаемого в молекуле NH3, поскольку отталкивание связи N-F меньше, чем отталкивание связи N-Н. Экспериментальное значение валентного угла в молекуле NF3 (102о) подтверждает предсказание теории.
Замещение атомов водорода на более электроотрицательные атомы в молекуле этилена СН2=СН2, угол НСН равен 117,7о, приводит к уменьшению валентного угла до 114о (угол ClCCl в молекуле CH2=CCl2) и 109о (угол FCF в молекуле CH2=CF2).
Молекула ClF3. Атом хлора имеет на последнем уровне семь электронов. Три из них образуют три общие пары простых связей Cl – F, а четыре другие образуют две неподеленные пары электронов. Тип молекулы MX3E2. Расположение пяти пар – тригонально-бипирамидальное. Положения этих пяти пар не эквивалентные. В аксиальном положении пара имеет три пары под углом 90о и одну под углом 180о. В экваториальном положении пара имеет две пары под углом 90о и две пары под углом 120о. С учетом большего отталкивания ближайших пар отталкивание минимально в экваториальных положениях. Именно эти выгодные положения и занимаются двумя неподеленными парами. Три связывающие пары занимают третье экваториальное положение и два аксиальных положения. Молекула ClF3 имеет Т-образную геометрию.
Из-за большего отталкивания неподеленных пар электронов по сравнению с общими парами электронов угол между аксиальной и экваториальной связями должен быть меньше 90о. Экспериментальное значение этого угла равно 87,5о (рис.4).
Молекула XeF4. Атом ксенона имеет на валентном уровне восемь электронов. Четыре из них образуют четыре связи, четыре других – две неподеленные пары электронов. Тип молекулы МХ4Е2. Расположение шести пар – октаэдрическое. Первая неподеленная пара может занимать любое из шести равноценных положений. Вторая неподеленная пара электронов должна занимать положение противоположное положению первой пары, чтобы минимизировать межэлектронное отталкивание. Молекула имеет квадратное расположение связей.
Молекула IOCl3. В молекуле IOCl3 атом иода имеет 7 электронов. Три из них образуют три простые связи, два – одну двойную связь и еще два – неподеленную пару. Расположение пяти электронных облаков – тригонально-бипирамидальное. Неподеленная пара и двойная связь, как имеющие наибольшее отталкивание, занимают два экваториальные положения. Три простые связи занимают оставшееся экваториальное положение и два аксиальных положения. Геометрия молекулы – искаженный тетраэдр.
Рис. 4. Геометрия молекул в методе Гиллеспи. Приведено расположение связей и неподеленных пар.
Заключение
Таким образом, для определения геометрии молекулы могут быть использованы различные методы. Так необычная Т-образная геометрия молекулы ClF3 может быть правильно предсказана с помощью метода валентных связей (предполагающего в данном случае возбуждение р-электрона на d-орбиталь), с помощью метода трехцентровых связей (указывающего на невозможность подобного возбуждения) и с помощью метода Гиллеспи (вообще не обсуждающего вопросы образования химической связи).
Очевидно, что эти методы не могут объяснить геометрию всех молекул, например, изменения геометрии в ряду: BeF2 – MgF2 – CaF2 (от линейной молекулы к нежесткой и к угловой). Однако, учитывая простоту этих моделей, следует скорее удивляться их успехам, нежели их неудачам.
1. Химическая связь. М.: Наука, 1973. 232 с.
3. Геометрия молекул. М.: Мир, 1975. 278 с.
Как узнать форму молекулы
Исследовательские работы и проекты
Способы определения размеров молекул
Определение размеров молекул
1 способ. Основан на том, что молекулы вещества, когда оно находится в твердом или жидком состоянии, можно считать плотно прилегающими друг к другу. В таком случае для грубой оценки можно считать, что объем V некоторой массы m вещества просто равен сумме объемов содержащихся в нем молекул. Тогда объем одной молекулы мы получим, разделив объем V на число молекул N.
Отсюда объем V0 одной молекулы определяется из равенства
В это выражение входит отношение объема вещества к его массе.
Обратное же отношение
есть плотность вещества,
так что
Плотность практически любого вещества можно найти в доступных всем таблицах. Молярную массу легко определить, если известна химическая формула вещества.
Первый из этих двух корней — постоянная величина, равная ≈ 7,4 · 10-9 моль 1/3, поэтому формула для r принимает вид 
Например, радиус молекулы воды, вычисленный по этой формуле, равен rВ ≈ 1,9 · 10-10 м.
Описанный способ определения радиусов молекул не может быть точным уже потому, что шарики нельзя уложить так, чтобы между ними не было промежутков, даже если они соприкасаются друг с другом. Кроме того, при такой «упаковке» молекул – шариков были бы невозможны молекулярные движения. Тем не менее, вычисления размеров молекул по формуле, приведенной выше, дают результаты, почти совпадающие с результатами других методов, несравненно более точных.
2 способ. Метод Ленгмюра и Дево. В данном методе исследуемая жидкость должна растворяться в спирте (эфире) и быть легче воды, не растворяясь в ней. При попадании капли раствора на поверхность воды спирт растворяется в воде, а исследуемая жидкость образует пятно площадью S и толщиной d (порядка диаметра молекул).
Если допустить, что молекула имеет форму шара, то объем одной молекулы равен:

Необходимо определить диаметр молекулы d. В микропипетку набрать 0,5 мл раствора и, расположив ее над сосудом, отсчитать число капель n, содержащихся в этом объеме. Проделав опыт несколько раз, найти среднее значение числа капель в объеме 0,5 мл, а затем подсчитать объём исследуемой жидкости в капле: 
В ванну налить воду толщиной 1 – 2 см. Насыпать тальк тонким слоем на лист бумаги, ударяя слегка пальцем по коробочке. Расположив лист бумаги выше и сбоку от ванны на расстоянии 10 – 20 см, тальк сдуть с бумаги. На поверхность воды в ванне из пипетки капнуть одну каплю раствора. Линейкой измерить, средний диаметр образовавшегося пятна D и подсчитываю его площадь. Опыт повторить 2- 3 раза, а затем подсчитать диаметр молекул d.
Объём капли масла можно определить следующим образом: накапать 100 капель из капилляра в сосуд и измерить массу масла в нём. После этого массу, выраженную в килограммах, поделить на плотность масла, которую можно взять из таблицы плотности некоторых веществ (плотность масла растительного 800 кг/м3).
Затем полученный результат поделить на количество капель. Объём капли можно определить также с помощью мерного цилиндра: накапать масло в цилиндр, измерить его объём в см3 и перевести в м3, для чего поделить на 1000000, затем на количество капель масла. После того, как объём капли стал известен нужно капнуть одну каплю масла на поверхность воды, которая налита в широкий сосуд.
Для ускорения реакции предварительно немного нужно нагреть воду – приблизительно до 400С. Масло начнёт растекаться, и в результате получится круглое пятно. После того, как пятно перестанет расширяться, с помощью линейки измерить его диаметр и рассчитать площадь пятна по формуле:
Практическое получение наночастиц
В современном мире в связи с общей тенденцией к миниатюризации большими темпами стала развиваться такая наука, как нанотехнология. Методы нанотехнологии позволяют получить принципиально новые устройства и материалы с характеристиками, значительно превосходящими их современный уровень, что весьма важно для интенсивного развития многих областей техники, биотехнологии, медицины, охраны окружающей среды и др.
Ход работы:
1) Определение объёма капли

2) Определение объёма капли путём взвешивания.
1. На весы накапали 10 капель растительного масла, измерили массу
3) Определяем площадь пятна Sмасла=ПR2=11304 мм2
4) Площадь пятна нефти Sнефти=20*16=32000 мм2
5) Определяем толщину плёнки h=V/S
Для масла h=13/11304=1,2*10-7=120 нм
Для нефтиh=13/32000=4*10-8 м=40 нм
Вывод: В лабораторных условиях можно получать нанопленки
Одним из основополагающих понятий современной науки является понятие молекулы. Его введение европейскими учеными в 1860 г. дало толчок к развитию не только химии и физики, но и других естественных наук.
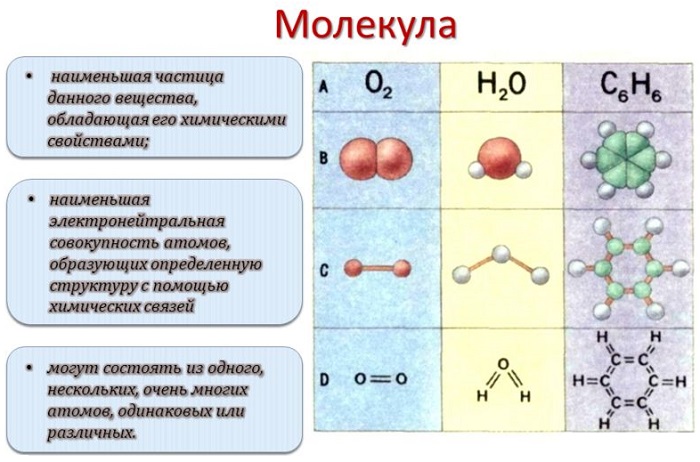
Молекулой, в наиболее общем определении, называется частица, образованная из нескольких (двух или более) атомов, объединенных между собой ковалентными связями. Она не имеет электрического заряда, все электроны в её составе имеют пару.
Молекулы, несущие заряд, называются ионами, неспаренные электроны – радикалами. Качественный и количественный состав их стабилен. Количество ядер атомов, электронов и их взаимное расположение позволяют отличать молекулы разных веществ друг от друга.
Что такое молекула в физике
В физике этим понятием оперируют при изучении свойств разных сред (газы, жидкости) и твердых тел.
Также их свойствами объясняются явления диффузии, теплопроводности и вязкость веществ.
Что такое молекула в химии
Учение о молекулах для химической науки является одним из самых главных. Именно химические исследования дали важнейшие сведения о составе и свойствах этой мельчайшей единицы вещества.
При прохождении химического превращения молекулы обмениваются атомами, распадаются. Поэтому знания о строении и состоянии этих частиц лежат в основе изучения химии веществ и их превращений.
На основании знаний о проходящей химической реакции можно предсказать строение молекул веществ, в ней участвующих. Противоположное заключение тоже будет верным: на основании сведений о строении молекулы вещества реально предсказать его поведение во время химической реакции.
Строение молекулы
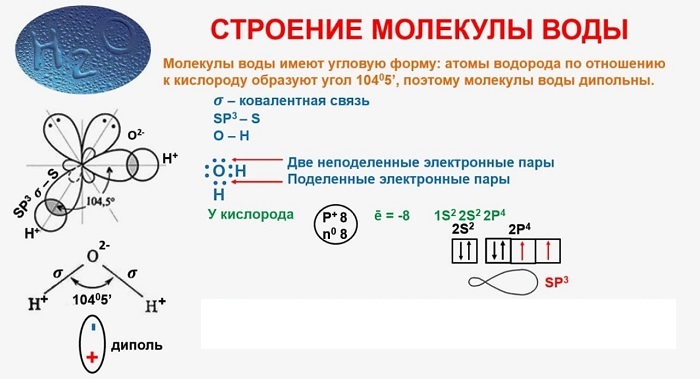
Понятие о строении включает геометрическую структуру и распределение электронной плотности.
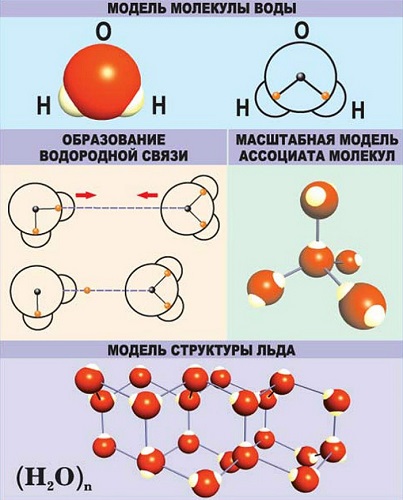
В качестве примера рассмотрим строение наименьшей частицы воды.
Существует несколько способов взаимодействия атомов. Основным способом являются химические связи, благодаря им поддерживается стабильное существование молекул. Прочие (неосновные) взаимодействия происходят между теми атомами, которые не связаны непосредственно.
Виды химической связи:
Водородная — основана на способности атома водорода образовывать дополнительную связь при смещении от него электронной плотности.
Связи характеризуются следующими показателями:
длина – степень удаления друг от друга ядер атомов, образовавших связь;
энергия – сила, прилагаемая для разрушения связи;
полярность – смещение электронного облака к одному из атомов;
порядок или кратность – количество пар электронов, образовавших связь.
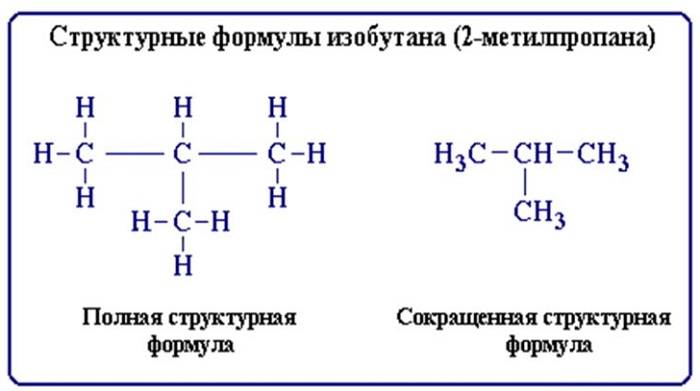
Строение молекул условно отражается структурными формулами. Основные взаимодействия атомов, при составлении таких формул, отображается черточками. В таких формулах связи образуют неразрывную цепь и иллюстрируют валентности образовавших их элементов (атомов).
Структурные формулы также отражают то, как выглядит молекула (линейная, циклическая, наличие радикалов и т. д.).
Масса (размер) молекулы
В зависимости о количества ядер атомов, входящих в их состав, можно выделить молекулы двухатомные, трехатомные и т. д.
В том случае, если количество атомов велико, молекула носит название макромолекулы.
Путем сложения масс атомов, входящих в состав частицы, можно определить молекулярную массу. В зависимости от её величины, все вещества делят на высоко- и низкомолекулярные.
Свойства молекулы
Современная наука выделяет следующие свойства молекул:
Знания о свойствах и строении молекул являются основополагающими для развития теоретических и прикладных наук и играют важную роль в жизни человека.