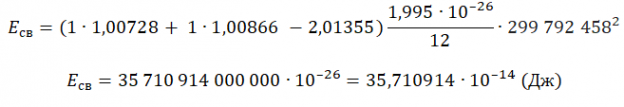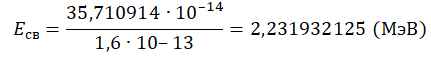Как узнать число нуклонов
Нуклонная модель атома
теория по физике 🧲 квантовая физика
Когда Резерфорд опровергнул модель Томсона о строении атома, возник другой вопрос: из чего состоит
Изотопы
В результате наблюдения огромного числа радиоактивных превращений было обнаружено, что существуют вещества, идентичные по химическим свойствам, но имеющие совершенно различные радиоактивные свойства — в одних и тех же условиях их распад происходил по-разному. Эти вещества не удавалось разделить ни одним из известных химических способов. Поэтому английский радиохимик Содди в 1911 г. высказал предположение о возможности существования элементов с одинаковыми химическими свойствами, но разной радиоактивностью. Эти элементы, по его мнению, нужно было помещать в одну и ту же клетку периодической системы Д. И. Менделеева. Содди назвал такие элементами изотопами (т. е. занимающими одинаковые места).
Предположение Содди о существовании веществ с разной радиоактивностью, но одинаковыми химическими свойствами, было подтверждено экспериментально. Когда английский физик Томсон проводил точные измерения массы ионов неона методом отклонения их в электрическом и магнитном полях, он установил, что неон есть смесь двух видов атомов. Большая часть атомов имела относительную массу 20, но некоторая часть атомов имела массу, равную 22 а. е. м. В результате относительная атомная масса смеси атомов неона была принята равной 20,2. Причем атомы обладали одинаковыми химическими свойствами, но масса их была различна.
С тех пор изотопы были обнаружены у разных химических элементов. Так, они есть у самого тяжелого из существующих в природе элементов — урана (относительные атомные массы 238, 235 и др.) и у самого легкого — водорода (относительные атомные массы 1, 2, 3).
Было установлено, что:
Эти обобщения помогли сделать вывод, что свойства радиоактивности изотопов зависят от их массы. Причем некоторые элементы могут иметь только нестабильные, или радиоактивные изотопы.
Особый интерес для физиков того времени представлял атом водорода, изотопы которого могли отличаться по массе в 2 и 3 раза:
Существование изотопов доказывает, что заряд атомного ядра определяет не все свойства атома, а лишь его химические свойства и те физические свойства, которые зависят от периферии электронной оболочки, например размеры атома. Масса же атома и его радиоактивные свойства не определяются порядковым номером в таблице Д. И. Менделеева.
Открытие нейтрона
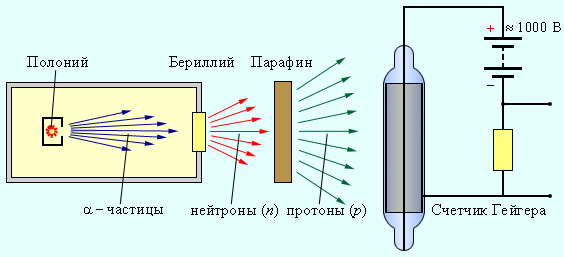
При бомбардировке бериллия α-частицами, испускаемыми нестабильным полонием, возникает сильное проникающее излучение, которое легко преодолевает преграду в виде слоя свинца толщиной до 10–20 см. Это излучение изучали английский физик Чедвик и супруги Жолио-Кюри Ирен и Фредерик из Франции независимо друг от друга примерно в одно и то же время. Ученые предположили, что это излучение создано γ-лучами большой энергии. Но затем выяснилось, что если на пути излучения бериллия поставить пластинку из парафина, то ионизирующая способность излучения резко возрастает.
Было установлено, что излучение бериллия выбивает из парафиновой пластинки протоны, которые в большом количестве имеются в этом веществе. Ученые рассчитали длину свободного пробега протонов в воздухе они оценили энергию γ-квантов, которые сообщают при столкновении с протонами необходимую скорость. Расчеты показали слишком большое значение — 50 МэВ. протонам необходимую скорость. Она оказалась огромной – порядка 50 МэВ. Из-за малой массы γ-кванты не могли обладать такой энергией. Поэтому Чедвик сделал вывод, что из бериллия под действием α-частиц вылетают не безмассовые γ-кванты, а довольно тяжелые частицы. Эти частицы обладали большой проникающей способностью и не ионизировали газ в счетчике Гейгера. Это значит, что такие частицы были электрически нейтральными. Этой частице дали название — нейтрон.
Нуклонная модель атома
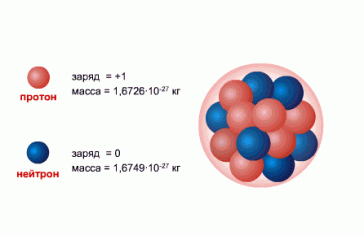
Сразу после открытия нейтрона несколько физиков одновременно высказали идею протонно-нейтронной, или нуклонной, модели ядра. Согласно этой модели ядро состоит из протонов и нейтронов. Будучи «кирпичиками», из которых строится ядро, протоны и нейтроны получили общее название — нуклоны.
Нуклоны — общее название для составляющих атомное ядро протонов и нейтронов.
В рамках нуклонной теории о строении ядра атома ему было дано следующее определение:
Атомное ядро — центральная часть атома, состоящая из протонов и нейтронов.
Массовое число — общее число нуклонов в ядре. Обозначается как A.
Зарядовое число — число протонов в ядре. Обозначается как Z. Зарядовое число всегда соответствует порядковому номеру элемента в периодической таблице Менделеева.
где X — символ химического элемента, Z — число протонов в ядре (порядковый номер элемента в периодической таблице Менделеева), A — массовое число.
Массовое число определяется как сумму протонов и нейтронов, содержащихся в ядре атома:
N – число нейтронов в ядре.
Пример №1. Пользуясь периодической системой элементов Д.И. Менделеева, определите число протонов и число нейтронов в ядрах атомов серы.
Взглянем на периодическую систему Менделеева и найдем серу:
Порядковый номер серы — 16. Следовательно, зарядовое число, или количество протонов в ядре атома серы — 16. Массовое число составляет 32,066 а. е. м. Округлим до целых и получим 32. Количество нейтронов найдем как разность массового и зарядового чисел:
N = A − Z = 32 − 16 = 16
Ядерные силы
Ядерные силы — силы, действующие между протонами и нейтронами.
Ученые установили, что ядерные силы обладают следующими свойствами:
Энергия связи атомных ядер
Нуклоны в ядре прочно удерживаются ядерными силами. Если совершить работу по их преодолению, придется совершить некоторую работу. Энергию, которую нужно затратить для совершения работы по разделению на отдельные нуклоны, называют энергией связи ядра.
Энергия связи ядра атома — энергия, которая необходима для полного расщепления ядра на отдельные протоны и нейтроны.
На основании закона сохранения энергии можно сделать вывод, что энергия связи равна той энергии, которая выделяется при образовании ядра из отдельных частиц.
В настоящее время рассчитать энергию связи теоретически, подобно тому, как это можно сделать для электронов в атоме, не удается. Выполнить соответствующие расчеты можно, лишь применяя соотношение Эйнштейна между массой и энергией:
Измерения масс ядер показали, что масса покоя ядра всегда меньше суммы масс входящих в его состав протонов и нейтронов:
M я — масса покоя ядра, Z — число протонов, N — число нейтронов, m p — масса протона, m n — масса нейтрона.
На основании этого был сделан вывод о существовании дефекта (разности масс). Дефект масс определяется разностью суммы масс протонов и нейтронов, входящих в состав ядра, и массы покоя ядра атома:
Δ M = Z m p + N m n − M я
Это интересно! Масса ядра атома гелия на 0,75% меньше суммы масс двух протонов и двух нейтронов. Соответственно для гелия в количестве вещества один моль ΔM = 0,03 г.
Уменьшение массы при образовании ядра из нуклонов означает, что при этом уменьшается энергия этой системы нуклонов на значение энергии связи Есв.
Энергия связи — это энергия, которая выделяется при образовании ядра из отдельных частиц, и соответственно это та энергия, которая необходима для расщепления ядра на составляющие его частицы.
Энергия связи определяется формулой:
E с в = Δ M с 2 = ( Z m p + N m n − M я ) с 2
Это интересно! Энергия связи настолько велика, что образование 4 г гелия сопровождается выделением такой же энергии, что и при сгорании 1,5—2 вагонов каменного угля.
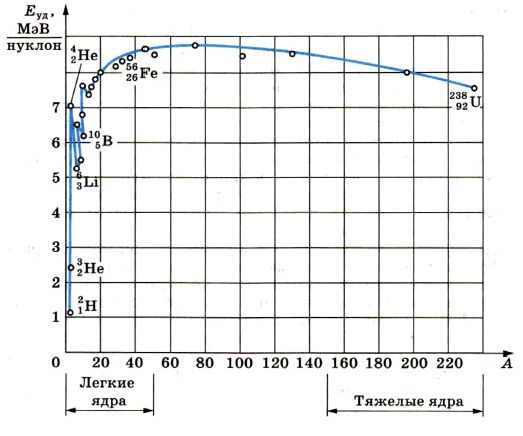
Важную информацию о свойствах ядер содержит зависимость удельной энергии связи от массового числа А.
Удельная энергия связи — энергия связи, приходящаяся на один нуклон ядра.
Удельную энергию связи устанавливают опытным путем. Из рисунка ниже видно, что, не считая самых легких ядер, удельная энергия связи примерно постоянна и равна 8 МэВ/нуклон. Примечательно, что энергия связи электрона и ядра в атоме водорода, равная энергии ионизации, почти в миллион раз меньше этого значения. Кривая на имеет слабо выраженный максимум. Максимальную удельную энергию связи (8,6 МэВ/нуклон) имеют элементы с массовыми числами от 50 до 60, т. е. железо и близкие к нему по порядковому номеру элементы. Ядра этих элементов наиболее устойчивы.
У тяжелых ядер удельная энергия связи уменьшается за счет возрастающей с увеличением Z кулоновской энергии отталкивания протонов. Кулоновские силы стремятся разорвать ядро.
E с в = ( Z m p + N m n − M я ) с 2
Зарядовое число водорода — 1. Количество нейтронов — 1. Чтобы найти суммарную массу всех частиц и ядра, нужно их массу в а. е. м. умножить на массу атома углерода в кг и поделить на 12. Это необходимо потому, что 1 а. е. м. равна 1/12 массы атома углерода. Получим:
Переведем в МэВ, учитывая, что 1 МэВ = 1,6∙10 –13 Дж:
Какая из строчек таблицы правильно отражает структуру ядра 49 115 In?
Алгоритм решения
Решение
Протоны и нейтроны — нуклоны. Общее их количество является массовым числом A, которое указывается слева от обозначения химического элемента в верхнем индексе. В данном случае A = 115.
Зарядовое число — порядковый номер химического элемента в периодической системе Менделеева. Оно обозначается Z и равно количеству протонов в ядре. В нашем случае Z = 49. Значит, протонов 49.
Чтобы посчитать количество нейтронов, нужно из массового числа вычесть зарядовое число: 115 – 49 = 66. Значит, нейтронов 66. Строка 1 подходит.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Связанная система элементарных частиц содержит 14 нейтронов, 13 протонов и 10 электронов. Эта система частиц является
а) ионом алюминия 13 27 Al
б) нейтральным атомом кремния 14 27 Si
в) ионом кремния 14 27 Si
г) нейтральным атомом алюминия 13 27 Al
Алгоритм решения
Решение
Согласно условию задачи, в связанной системе элементарных частиц содержится 14 нейтронов, 13 протонов и 10 электронов. В нейтральном атоме количество электронов равно количеству протонов. В нашем случае электронов на 3 меньше. Значит, перед нами ион.
Зарядовое число соответствует количеству протонов. Их 13.
Массовое число равно сумме количества протонов и электронов: 14 + 13 = 27.
Выходит, перед нами ион алюминия.
pазбирался: Алиса Никитина | обсудить разбор | оценить
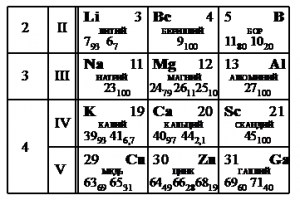
На рисунке представлен фрагмент Периодической системы элементов Д.И. Менделеева. Под названием каждого элемента приведены массовые числа его основных стабильных изотопов. При этом нижний индекс около массового числа указывает (в процентах) распространённость изотопа в природе.
Алгоритм решения
Решения
Наименее распространен изотоп меди Cu-65, поскольку возле его массового числа стоит меньший индекс — 31.
Массовое число этого изотопа — 65. Зарядовое число соответствует порядковому номеру — 29.
Количество протонов соответствует зарядовому числу. Их 29.
Количество нейтронов есть разность массового и зарядовых чисел: 65 – 29 = 36.
Эти числа запишем последовательно: 2936.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Чему равно число нуклонов?
Как определить сколько нуклонов содержит ядро?
Количество нуклонов — это сумма количества протонов и нейтронов. Оно обозначается верхним индексом при написании символа элемента. к главе «IX. СТРОЕНИЕ АТОМА И АТОМНОГО ЯДРА.
Как найти число протонов и нуклонов?
Как найти массу атомного ядра?
Массу ядра можно найти следующим образом: mяд = N·mn + Z·mp. Так как mn ≈ mp ≈ 1.66·10−27 кг, а Z + N = A, получим: mяд = 1.66·10−27·A кг.
Как узнать нуклон?
Как определить электроны?
Вычтите заряд из атомного номера.
Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
Сколько нуклонов содержат ядра Li?
Как можно определить заряд ядра?
Установлено, что число протонов в ядре равно порядковому номеру элемента в Периодической таблице. Заряд ядра определяется числом протонов в нём. Значит, заряд ядра тоже равен порядковому номеру элемента. Атом — электронейтральная частица, поэтому число электронов в нём равно числу протонов.
Что такое нуклон и как его найти?
Нукло́ны (от лат. nucleus «ядро») — общее название для составляющих атомного ядра — протонов и нейтронов. С точки зрения электромагнитного взаимодействия протон и нейтрон — разные частицы, так как протон электрически заряжен, а нейтрон — нет.
Как определить количество нуклонов по таблице Менделеева?
Число нуклонов в ядре атома равно массовому числу атома (относительная атомная масса химического элемента) или сумме протонов и нейтронов.
Как найти число нейтронов?
Масса ядра равна сумме масс протонов и нейтронов. Число протонов определяем по порядковому номеру элемента. Значит, число нейтронов в ядре можно найти, если от относительной атомной массы отнять порядковый номер.
Как определить количество протонов и электронов?
Количество протонов в атоме совпадает с количеством электронов, поскольку атом электрически нейтрален, и совпадает с порядковым номером элемента в периодической таблице Менделеева. Поскольку номер фтора 9, то атом фтора содержит 9 протонов и 9 электронов.
Как рассчитать дефект массы?
Как найти массу урана?
Молярная масса урана равна 238,0289 г/моль.
Данное значение показывает отношение массы вещества (m) е число моль данного вещества (n), обозначается M и может быть рассчитано по формуле: M = m / n.
Чем больше энергия связи ядра?
Чем больше массовое число атомного ядра, тем больше его энергия связи. Важной характеристикой атомного ядра является его удельная энергия связи – отношение энергии связи ядра к его массовому числу. Удельная энергия связи – это энергия связи, приходящаяся на один нуклон.
Число нуклонов в ядре атома элемента равно относительной атомной массе элемента, округленной до целого числа.
Водород Ar = 1,001; 1 нуклон
Углерод Ar = 12,011; 12 нуклонов.
2.1.3.Нуклиды, изотопы, массовое число
Большинство элементов, содержащихся в природе, состоит из нескольких видов атомов, отличающихся значениями относительной атомной массы.
Пример. Хлор в природе встречается как смесь двух видов атомов, один из которых содержит 18, а другой – 20 нейтронов в ядре.
Каждый вид атомов (вид ядер) называется нуклидом. Нуклид – это вид атомов и ядер, отвечающий определенным числам протонов и нейтронов.
Нуклиды, принадлежащие одному элементу и однозначно определяемые числом протонов, но различающиеся по числу нейтронов, называются изотопными нуклидами, или просто изотопами.
Изотопы элемента – это нуклиды, обладающие равным зарядом ядра (числом протонов).Изотопы элемента различаются только числом нейтронов и, следовательно, общим числом нуклонов.
Пример. Ядра двух природных изотопов хлора содержат по 17 протонов, но 18 и 20 нейтронов, т.е. 35 и 37 нуклонов соответственно.
Для нуклидов точные значения относительных атомных масс всегда близки к целочисленным значениям, поэтому массы нуклидов можно сравнивать по этим значениям, называемым массовыми числами.
Массовое число нуклида равно числу содержащихся в нем нуклонов (сумме протонов и нейтронов).
Для обозначения конкретного нуклида применяется специальная символика. Слева от символа химического элемента верхним индексом указывается массовое число, а нижним индексом – заряд ядра (порядковый номер элемента). Например, изотоп хлора-18 записывается как 
Массовое число = Число нуклонов в ядре.
Порядковый номер = Число протонов в ядре или число электронов в оболочке атома.
Разность между массовым числом и порядковым номером = Число нейтронов в ядре.
2.1.4. Строение электронной оболочки атома. Энергетические уровни
Строение электронной оболочки атома определяется различным запасом энергии E отдельных электронов в атоме. В соответствии с моделью атома Бора электроны могут занимать в атоме положения, которым отвечают точно определенные (квантованные) энергетические состояния.
2.2.1. Орбитальная модель атома
Современные квантово-механические представления о строении электронной оболочки атома исходят из того, что движение электрона в атоме нельзя описать определенной траекторией. Можно рассматривать лишь некоторый объем пространства, в котором находится электрон. Поскольку электрон обладает одновременно свойствами частицы и волны, то подходом к объяснению строения электронной оболочки может быть как корпускулярная теория, так и волновая теория; обе они приводят к одинаковому наглядному представлению, сформулированному как орбитальная модель атома.
1. Обоснование орбитальной модели атома, исходящее из корпускулярного характера электрона, состоит в следующем. Как следует из рис. 2, вероятность пребывания электрона в атомном ядре равна нулю, она незначительна вблизи ядра, но быстро возрастает при удалении от ядра. На некотором расстоянии вероятность достигает максимума, а затем медленно уменьшается, ассимптотически приближаясь к нулю на расстоянии, стремящемся к бесконечности. Таким образом, невозможно ограничить то пространство, в котором может находиться электрон, т.е. нельзя (без дополнительных условий) указать размеры атома. Исходя из корпускулярного характера электрона можно говорить о 90 %-ой вероятности его пребывания в ограниченном объеме пространства, которое называется атомная орбиталь.
 |
| Рис. 2. Зависимость электронной плотности (или вероятности пребывания электрона на расстоянии r ядро-электрон) в атоме от расстояния от ядра |
2. Обоснование орбитальной модели атома, исходящее из волнового характера электрона, состоит в следующем. Электрон заполняет пространство вокруг атомного ядра в форме стоячей волны, которую наглядно можно представить как электронное облако. Плотность электронного облака, понимаемого как облако электрического заряда электрона − электронная плотность – окажется различной и зависящей от расстояния ядро-электрон (рис.1). При ограничении электронной плотности до значения
90 % получается та же орбитальная модель атома.
Атомная орбиталь – это геометрический образ, отвечающий объему пространства вокруг атомного ядра, который соответствует 90 %-ой вероятности нахождения в этом объеме электрона (как частицы) и одновременно 90 %-ой плотности заряда электрона (как волны).
Модель атомной орбитали (электронного облака) очень удобна для наглядного описания распределения электронной плотности в пространстве. При этом s-орбиталь имеет сферическую форму, р-орбиталь – форму гантели, d-орбиталь – четырехлепесткового цветка или удвоенной гантели, f-орбиталь – еще более сложную форму (рис. 3).
Если в атомной орбитали находится только один электрон (как в атоме водорода), то говорят об однократно занятой или полузаполненной, полузаселенной атомной орбитали. Если же в атомной орбитали находятся два электрона (как в атоме гелия), то говорят о двукратно занятой или полностью заполненной, полностью заселенной атомной орбитали. Полузаселенные АО играют важнейшую роль при формировании химических связей.
В соответствии с квантово-механическим описанием состояния электрона в атоме каждый электрон является индивидуальной частицей. Такие его свойства, как масса и заряд не выявляют различий между электронами, особенно между теми электронами, которые находятся на одной атомной орбитали (как в атоме гелия). Собственной характеристикой каждого электрона в атоме является спин.
Два электрона, находящиеся в одной атомной орбитали, различаются по спину.
Спин – квантово-механическое свойство электрона, которое невозможно точно объяснить с помощью традиционных представлений на основе механического поведения макрочастиц. Без учета волновых свойств электрона спин можно интерпретировать путем сравнения электрона с шаром, вращающимся вокруг выбранной оси. Спин характеризует направление вращения и, следовательно, при двух возможных направлениях механического вращения должно существовать два разных спина электрона.
Спин – неотъемлемая характеристика электрона в атоме; два электрона на одной атомной орбитали обладают антипараллельными спинами.
Атомную орбиталь удобно изображать в виде квадрата, называемого квантовой ячейкой, а каждый электрон − вертикальной стрелкой, обозначающей один из двух возможных спинов электрона. Квантовая ячейка с одной стрелкой означает атомную орбиталь с одним электроном, т.е. полузаселенную орбиталь, с двумя стрелками − атомную орбиталь с двумя электронами, т.е. полностью заселенную орбиталь, без стрелок – вакантную орбиталь, т. е. без электронов.
Атомную орбиталь, имеющую шаровую симметрию (рис. 3), принято обозначать как s-орбиталь (s-АО), а находящиеся в ней электроны – как s-электроны.
Радиус атомной s-орбитали возрастает при увеличении номера энергетического уровня; 1s-АО расположена внутри 2s-АО, последняя – внутри 3s-АО и т.д. с центром, отвечающим атомному ядру. В целом строение электронной оболочки атома в орбитальной модели представляется слоистым. Каждый энергетический уровень, содержащий электроны, геометрически рассматривается как электронный слой.
Для сокращенного обозначения электрона, занимающего атомную s-орбиталь, используется обозначение самой s-АО с верхним цифровым индексом, указывающим число электронов. Например, 1s 
Номер энергетического уровня отвечает главному квантовому числу, а вид орбитали − орбитальному квантовому числу.
2s 
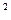


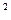
1s 

Электронная формула в сочетании с энергетической диаграммой электронной оболочки атома (рис. 3) отражают его электронную конфигурацию.
Атомную орбиталь, имеющую вращательную (осевую) симметрию принято обозначать как p-орбиталь (p-АО) ; находящиеся в ней электроны – это p-электроны.
Каждая атомная p-орбиталь может принять (при максимальном заполнении) два электрона, подобно любой другой АО. Эти электроны сообща занимают обе половины p-орбитали. На каждом атомном энергетическом уровне (кроме первого) имеется три атомных орбитали, которым отвечает максимальное заселение шестью электронами.
Все три p-АО одного энергетического уровня отличаются друг от друга пространственным расположением; их собственные оси, проходящие через обе половины орбитали и перпендикулярные ее узловой плоскости, образуют систему декартовых координат (обозначения собственных осей x, y, z). Поэтому на каждом энергетическом уровне имеется набор трех атомных p-орбиталей: px-, py— и pz-АО. Буквы x, y, z соответствуют магнитному квантовому числу, позволяющему судить о влиянии внешнего магнитного поля на электронную оболочку атома.
Атомные s-орбитали имеются на всех энергетических уровнях, атомные p-орбитали − на всех уровнях, кроме первого. На третьем и последующих энергетических уровнях к одной s-АО и трем p-АО присоединяется пять атомных орбиталей, получивших название d-орбиталей(рис. 4), а на четвертом и последующих уровнях − еще семь атомных орбиталей, называемых f-орбиталями.
Квантово-механические расчеты показывают, что в многоэлектронных атомах энергия электронов одного уровня не одинакова; электроны заполняют атомные орбитали разных видов и имеют разную энергию.
Энергетический уровень характеризуется главным квантовым числом n. Для всех известных элементов значения n изменяются от 1 до 7. Электроны в многоэлектронном атоме, находящемся в основном (невозбужденном) состоянии, занимают энергетические уровни от первого до седьмого.
Энергетический подуровень характеризуется орбитальным квантовым числом l. Для каждого уровня (n = const) квантовое число l принимает все целочисленные значения от 0 до (n-1), например, при n=3 значениями l будут 0, 1 и 2. Орбитальное квантовое число определяет геометрическую форму (симметрию) орбиталей s-, p-, d-, f-подуровня. Очевидно, что во всех случаях n>l; при n=3 максимальное значение l равно 2.
Существующие подуровни для первых четырех энергетических уровней, числа атомных орбиталей и электронов в них приведены в таблице 1.
Закономерность заполнения электронных оболочек атомов определяется принципом запрета, установленным в 1925 г. швейцарским физиком Паули.
Принцип Паули: в атоме не могут находиться два электрона в тождественных состояниях.
Различие электронов, занимающих разные атомные орбитали одного подуровня (n, l = const), кроме s-подуровня, характеризуется магнитным квантовым числом m