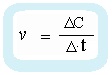Как уменьшить скорость реакции
Химия, Биология, подготовка к ГИА и ЕГЭ
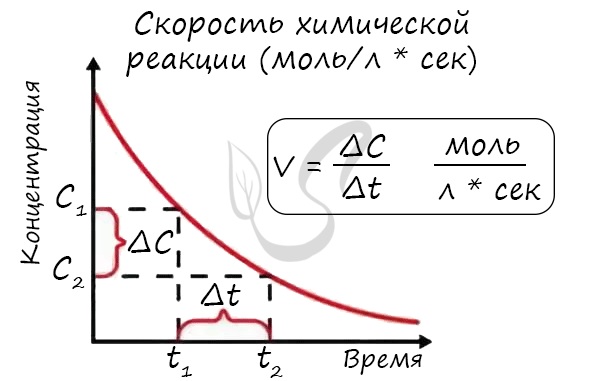
Скоростью химической реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
Тема большая, зачастую в ней присутствуют формулы для расчета скорости, но в этой статье мы разберем все вопросы в формате подготовки к ЕГЭ.
Факторы, влияющие на
изменение скорости реакции
Теперь разберем каждый фактор отдельно.
1. Влияние концентрации на изменение скорости реакции:
По указанному определению можно записать формулу скорости:
ν — скорость реакции
ΔС — изменение концентрации
Если Δt — примем как постоянную, не меняющуюся величину, то изменение скорости реакции напрямую зависит от изменения концентрации
| Изменение скорости реакции прямопропорционально изменению концентрации |
Эта зависимость определяется не только уравнением. Есть простая логика — чем больше вещества, тем больше взаимодействие между частицами — тем быстрее идет реакция.
2. Влияние площади поверхности на изменение скорости реакции.
Есть гетерогенные реакции — реакции, в которых есть больше чем одна фаза:
— твердое вещество \ жидкость: Zn + 2HCl = ZnCl2 + H2
— твердое вещество \ газ: C + O2= CO2
| Изменение скорости реакции прямопропорционально площади поверхности |
Давайте представим, что кусочек цинка бросили в кислоту. Что будет происходить? Слой за слоем металл будет растворяться.
А что будет если мы внесем в кислоту цинк в виде порошка? Конечно, реакция пройдет намного быстрее.
Есть, конечно, определенные нюансы, но в школьном курсе они не рассматриваются…
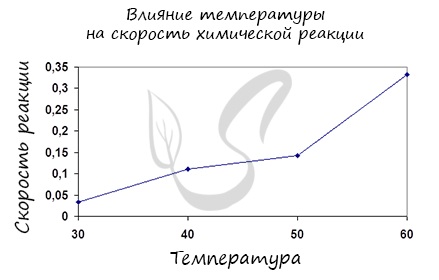
3. Влияние температуры на изменение скорости реакции.
Как и в случае концентрации, увеличение температуры увеличивает количество активных столкновений между частицами, что, естественно, увеличивает скорость реакции.
Изменение скорости реакции при повышении температуры соответствует правилу (приблизительному, для точных определений существует ряд формул) —
— при повышении температуры на 10ºС скорость химической реакции возрастает в два — четыре раза.
4. Влияние катализатора на изменение скорости реакции.
Здесь все очень просто. Определение катализа и катализатора говорит само за себя:
катализаторы — это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождаются в конце реакции.
5. Влияние давления на изменение скорости реакции.
А вот на этот пункт стоит обратить внимание.
Любой газ занимает весь предоставленный объем — молекулы разлетаются, и число их столкновений уменьшается. Если повысить давление, число активных соударений возрастает, соответственно, скорость реакции увеличивается.
Изменение скорости реакции в газовой фазе прямопропорционально изменению давления
Скорость химической реакции
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.
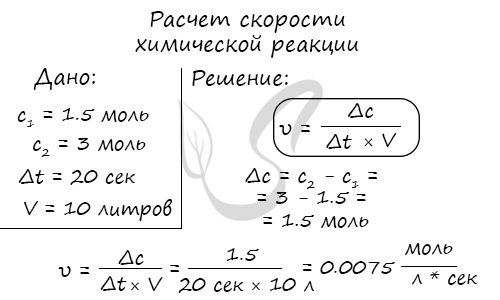
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.
Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Химическая активность также играет важную роль. Например, отвечая на вопрос: какой из металлов Li или K быстрее прореагирует с водой? Мы отдадим предпочтение литию, так как в ряду активности металлов он стоит левее калия, а значит литий активнее калия.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.
Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
Записанное выше следствие закона действующих масс нужно не только «зазубрить», но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?
По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?
В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: «Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет!»
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: «При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза»
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
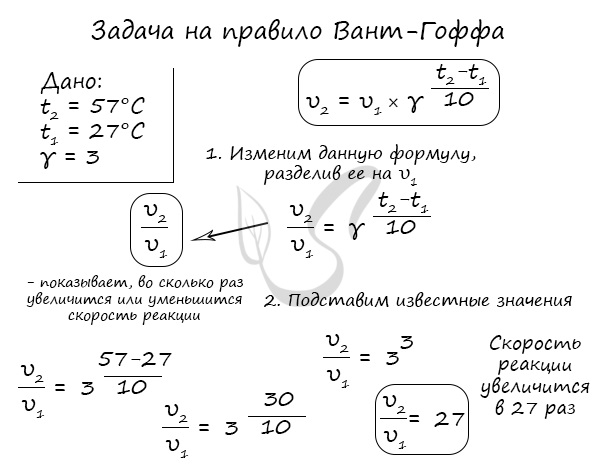
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: «Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз».
Катализаторы и ингибиторы
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Скорость химической реакции
6 советов, как увеличить скорость реакции
Реакция – это способность мозга быстро отвечать на внешние раздражители. Скорость реакции – это время, которое проходит от момента действия внешнего раздражителя до реакции организма на него.
Сначала наши органы чувств воспринимают какой-либо раздражитель и реагируют на него: нервные импульсы передаются от рецепторов (нервных окончаний) в кору головного мозга. Здесь происходит распознавание сигналов, их обработка, классификация и оценка. Затем подключается зона, контролирующая движения тела, и в работу включаются мышцы. Каждый такой этап требует времени.
У всех людей скорость реакции разная. Встречаются и крайности, когда поведение одних напоминает замедленную съемку, а реакция других молниеносна. Например, японская секретарша Миит за одну минуту ставит 100 печатей. Самый быстрый стрелок в мире Дж. Микулек за полсекунды делает 5 выстрелов из револьвера. Японец Макисуми собирает кубик Рубика за 12,5 секунды.
Любопытно, что самая быстрая мышечная реакция – у хладнокровных животных. Например, пальмовая саламандра, заметившая жертву, выбрасывает свой язык со скоростью 15 м в секунду. Быстрой реакцией обладают мангусты – благодаря ей они заслужили славу лучших охотников на змей. Молниеносная реакция и у наших любимых кошек.
Для человека быстрая реакция, казалось бы, утратила былое жизненно важное значение: ему уже не нужно быстро уворачиваться от лап диких животных, чтобы не быть съеденным, или же, наоборот, охотиться за ними, чтобы не остаться без обеда.
Однако думать, что быстрая реакция нам ни к чему, было бы ошибочно. Она необходима спортсменам – футболистам, хоккеистам, теннисистам, боксерам, дзюдоистам и др. И не только для того, чтобы ставить рекорды, но и во избежание травм. Быстрая реакция требуется представителям многих профессий – пилотам, водителям, капитанам, машинистам, хирургам и пр. Людям с быстрой реакцией отдают предпочтение и многие работодатели, например в сферах, где нужно быстро реагировать на изменения рынка.
По сути, быстрая реакция нужна всем, чтобы максимально обезопасить себя на улице и дома: правильно вести себя в критической ситуации, несущей угрозу для здоровья или жизни.
Скорость реакции измеряется в мс – миллисекундах. 1 секунда – это 1 000 мс. Чем меньше будет эта величина, тем выше будет скорость реакции. У большинства людей она составляет 230–270 мс. Показатели от 270 мс и выше говорят о замедленной реакции. Пилоты истребителей, спортивные звезды показывают результаты 150 – 170 мс.
Наиболее быстрая реакция у людей в возрасте примерно от 18 до 40 лет. Ее скорость повышается в середине дня – в период наивысшей работоспособности. У утомленного человека она снижается. Это может быть незаметно, если работа не требует быстрой реакции, но при совершении сложных действий возможность совершить ошибку возрастает.
Замедляется реакция и под воздействием алкоголя и наркотических средств. Кроме того, имеет значение психическое состояние человека: негативные эмоции угнетают нервную деятельность, что неблагоприятно сказывается на его реакциях, позитивные же их значительно ускоряют.
На скорость реакции влияет и вид раздражителя: быстрее всего люди реагируют на тактильные и звуковые раздражители, несколько медленнее – на зрительные.
Как стать быстрее
Есть несколько способов научиться реагировать быстрее:
1. Загружать мозг работой
У людей старшего возраста процесс обработки информации, поступающей в головной мозг от органов чувств, замедляется. Это происходит по разным причинам, в том числе и потому, что большинство из них перестают учиться, не стремятся к познанию нового и не хотят выходить из привычной им зоны комфорта. Безделье, просмотр бессмысленных передач, не заставляющих мозг напрягаться, запускают процесс деградации личности, влияющий и на скорость реакции.
Чтобы мозг со временем не атрофировался, его нужно постоянно загружать работой, ставить перед ним новые задачи, и тогда не придется сетовать на замедленную реакцию.
2. Исключаем вредные привычки
У человека, что называется, «перебравшего» создается ложное впечатление, что под влиянием выпитого он становится более раскованным, свободным и в состоянии сконцентрироваться и управлять своим поведением. Но практика показывает обратное: из-за отсутствия быстрой реакции пьяные очень часто становятся жертвами преступлений и участниками аварий.
3. Высыпаемся
Постоянно находиться в состоянии максимальной сосредоточенности и концентрации невозможно. Непременно наступит сбой, когда мы не сможем вовремя отреагировать на опасность. Поэтому периоды концентрации должны чередоваться с периодами расслабления. И полноценный сон – прекрасная возможность дать нервной системе «перезагрузиться», пополнить свои энергетические запасы. Кроме того, при недостатке сна снижается острота зрения, что также негативно сказывается на скорости реакций.
4. Контролируем эмоции
Прежде всего нужно научиться не поддаваться страху. С одной стороны, страх сигнализирует об опасности. С другой, — он не мобилизует человека, а тормозит процесс обработки информации в мозгу. Многим знакомо чувство, когда в минуты опасности человек ощущает себя словно парализованным и не в силах сдвинуться с места. Его реакции замедленны, и он не способен дать адекватный ответ. Правильно и быстро отреагировать на раздражитель можно лишь в состоянии отсутствия страха.
Благодаря специальным тренировкам, несущим смысловую нагрузку, то есть имитирующим опасность в реальной жизни, можно избавиться от некоторых страхов и приобрести навыки быстрого реагирования, которые пригодятся в сложной ситуации.
К примеру, звук щелчка, произведенного напарником, может имитировать выстрел и служить сигналом к тому, что надо быстро отскочить в сторону, пригнуться или упасть на землю. Эффект должен быть внезапным – мы не должны контролировать раздражитель, то есть действия напарника.
Избавиться от страха, в частности падения при гололеде, поможет заранее разработанный «план». Например, падая на спину, мы должны быстро прижать подбородок к груди, чтобы не травмировать голову. Свои действия в данном случае мы можем проигрывать мысленно. Это ускорит нашу реакцию, благодаря чему если все-таки упадем, то избежим травмы.
5. Играем
Игры в футбол, волейбол, настольный и большой теннис прекрасно развивают быструю реакцию, поэтому стоить выбрать ту, которая по душе, и начать играть. Можно заняться жонглированием.
Любопытно, что скорость реакции развивают и компьютерные игры – это доказали ученые одного из американских университетов. В ходе эксперимента игроки показали высокие результаты по быстрому принятию решений не только в самой игре, но и в тестах на определение скорости реакции.
6. Тренируемся
Упражнения будут целесообразны лишь в том случае, если проводить их ежедневно, а не время от времени.
Наши подсознательные, интуитивные реакции (за них отвечает правое полушарие мозга) быстрее сознательных, аналитических, которыми ведает левое полушарие. Огромная роль последнего несомненна, но в критические моменты первым реагирует подсознание. И поскольку на раздражитель в первую очередь отзывается именно оно, тренировать скорость реакции можно, многократно повторяя одни и те же движения – до 200 за раз.
Приступая к тренировкам, стоит определиться, на что именно мы будем увеличивать скорость реакции: на слух, прикосновение или зрительный раздражитель. Вначале их лучше разделить, а уж потом тренировать все вместе.
Тренируем скорость слуховой реакции. Например, двое сидят за столом, где лежит какой-нибудь предмет. Третий ходит вокруг них и внезапно хлопает в ладоши. По этому сигналу каждый должен стремиться первым схватить данный предмет.
Тренируем скорость реакции на прикосновение. Тот, кто тренируется, не должен видеть своего тренера (можно завязать ему глаза). Один человек сидит за столом, второй, которого он не видит, должен неожиданно дотронуться до его плеча. В ответ тот должен хлопнуть в ладоши, прыгнуть в сторону и т. п.
Тренируем скорость зрительной реакции. Это очень важно, потому что большая часть информации поступает в мозг благодаря зрению.
Игра в «хлопушки». Двое становятся друг против друга, у обоих руки согнуты в локтях и подняты, ладони развернуты в сторону напарника. Один бьет своей ладонью по ладони другого. Его задача – угадать и вовремя убрать руку, по которой хочет ударить напарник.
Как вариант: руки обоих лежат на столе перед собой. Каждый по очереди старается одной рукой накрыть руку другого, а тот должен успеть ее отдернуть.
Кстати, эти игры многим знакомы с детства.
Но, конечно же, самый результативный способ увеличить скорость реакции – это заняться командными видами спорта, теннисом или единоборствами.
1.4.3. Скорость реакции, ее зависимость от различных факторов.
Некоторые химические реакции происходят практически мгновенно (взрыв кислородно-водородной смеси, реакции ионного обмена в водном растворе), вторые — быстро (горение веществ, взаимодействие цинка с кислотой), третьи — медленно (ржавление железа, гниение органических остатков). Известны настолько медленные реакции, что человек их просто не может заметить. Так, например, преобразование гранита в песок и глину происходит в течение тысяч лет.
Другими словами, химические реакции могут протекать с разной скоростью.
Но что же такое скорость реакции? Каково точное определение данной величины и, главное, ее математическое выражение?
Скоростью реакции называют изменение количества вещества за одну единицу времени в одной единице объема. Математически это выражение записывается как:
Где n1 и n2 – количество вещества (моль) в момент времени t1 и t2 соответственно в системе объемом V.
То, какой знак плюс или минус (±) будет стоять перед выражением скорости, зависит от того, на изменение количества какого вещества мы смотрим – продукта или реагента.
Очевидно, что в ходе реакции происходит расход реагентов, то есть их количество уменьшается, следовательно, для реагентов выражение (n2 — n1) всегда имеет значение меньше нуля. Поскольку скорость не может быть отрицательной величиной, в этом случае перед выражением нужно поставить знак «минус».
Если же мы смотрим на изменение количества продукта, а не реагента, то перед выражением для расчета скорости знак «минус» не требуется, поскольку выражение (n2 — n1) в этом случае всегда положительно, т.к. количество продукта в результате реакции может только увеличиваться.
Отношение количества вещества n к объему, в котором это количество вещества находится, называют молярной концентрацией С:
Таким образом, используя понятие молярной концентрации и его математическое выражение, можно записать другой вариант определения скорости реакции:
Скоростью реакции называют изменение молярной концентрации вещества в результате протекания химической реакции за одну единицу времени:
Факторы, влияющие на скорость реакции
Нередко бывает крайне важно знать, от чего зависит скорость той или иной реакции и как на нее повлиять. Например, нефтеперерабатывающая промышленность в буквальном смысле бьется за каждые дополнительные полпроцента продукта в единицу времени. Ведь учитывая огромное количество перерабатываемой нефти, даже полпроцента вытекает в крупную финансовую годовую прибыль. В некоторых же случаях крайне важно какую-либо реакцию замедлить, в частности коррозию металлов.
Так от чего же зависит скорость реакции? Зависит она, как ни странно, от множества различных параметров.
Для того чтобы разобраться в этом вопросе прежде всего давайте представим, что происходит в результате химической реакции, например:
Написанное выше уравнение отражает процесс, в котором молекулы веществ А и В, сталкиваясь друг с другом, образуют молекулы веществ С и D.
То есть, несомненно, для того чтобы реакция прошла, как минимум, необходимо столкновение молекул исходных веществ. Очевидно, если мы повысим количество молекул в единице объема, число столкновений увеличится аналогично тому, как возрастет частота ваших столкновений с пассажирами в переполненном автобусе по сравнению с полупустым.
Другими словами, скорость реакции возрастает при увеличении концентрации реагирующих веществ.
В случае, когда один из реагентов или сразу несколько являются газами, скорость реакции увеличивается при повышении давления, поскольку давление газа всегда прямо пропорционально концентрации составляющих его молекул.
Тем не менее, столкновение частиц является, необходимым, но вовсе недостаточным условием протекания реакции. Дело в том, что согласно расчетам, число столкновений молекул реагирующих веществ при их разумной концентрации настолько велико, что все реакции должны протекать в одно мгновение. Тем не менее, на практике этого не происходит. В чем же дело?
Дело в том, что не всякое соударение молекул реагентов обязательно будет эффективным. Многие соударения являются упругими – молекулы отскакивают друг от друга словно мячи. Для того чтобы реакция прошла, молекулы должны обладать достаточной кинетической энергией. Минимальная энергия, которой должны обладать молекулы реагирующих веществ для того, чтобы реакция прошла, называется энергией активации и обозначается как Еа. В системе, состоящей из большого количества молекул, существует распределение молекул по энергии, часть из них имеет низкую энергию, часть высокую и среднюю. Из всех этих молекул только у небольшой части молекул энергия превышает энергию активации.
Как известно из курса физики, температура фактически есть мера кинетической энергии частиц, из которых состоит вещество. То есть, чем быстрее движутся частицы, составляющие вещество, тем выше его температура. Таким образом, очевидно, повышая температуру мы по сути увеличиваем кинетическую энергию молекул, в результате чего возрастает доля молекул с энергией, превышающей Еа и их столкновение приведет к химической реакции.
Факт положительного влияния температуры на скорость протекания реакции еще в 19м веке эмпирически установил голландский химик Вант Гофф. На основании проведенных им исследований он сформулировал правило, которое до сих пор носит его имя, и звучит оно следующим образом:
Скорость любой химической реакции увеличивается в 2-4 раза при повышении температуры на 10 градусов.
Математическое отображение данного правила записывается как:
где V2 и V1 – скорость при температуре t2 и t1 соответственно, а γ – температурный коэффициент реакции, значение которого чаще всего лежит в диапазоне от 2 до 4.
Часто скорость многих реакций удается повысить, используя катализаторы.
Катализаторы – вещества, ускоряющие протекание какой-либо реакции и при этом не расходующиеся.
Но каким же образом катализаторам удается повысить скорость реакции?
Не смотря на то что катализатор при проведении реакции не расходуется, тем не менее он принимает в ней активное участие, образуя промежуточные соединения с реагентами, но к концу реакции возвращается к своему изначальному состоянию.
Кроме указанных выше факторов, влияющих на скорость реакции, если между реагирующими веществами есть граница раздела (гетерогенная реакция), скорость реакции будет зависеть также и от площади соприкосновения реагентов. Например, представьте себе гранулу металлического алюминия, которую бросили в пробирку с водным раствором соляной кислоты. Алюминий – активный металл, который способен реагировать с кислотами неокислителями. С соляной кислотой уравнение реакции выглядит следующим образом:
Алюминий представляет собой твердое вещество, и это значит, что реакция с соляной кислотой идет только на его поверхности. Очевидно, что если мы увеличим площадь поверхности, предварительно раскатав гранулу алюминия в фольгу, мы тем самым предоставим большее количество доступных для реакции с кислотой атомов алюминия. В результате этого скорость реакции увеличится. Аналогичным образом увеличения поверхности твердого вещества можно добиться измельчением его в порошок.
Также на скорость гетерогенной реакции, в которой реагирует твердое вещество с газообразным или жидким, часто положительно влияет перемешивание, что связано с тем, что в результате перемешивания достигается удаление из зоны реакции скапливающихся молекул продуктов реакции и «подносится» новая порция молекул реагента.
Последним следует отметить также огромное влияние на скорость протекания реакции и природы реагентов. Например, чем ниже в таблице Менделеева находится щелочной металл, тем быстрее он реагирует с водой, фтор среди всех галогенов наиболее быстро реагирует с газообразным водородом и т.д.
Резюмируя все вышесказанное, скорость реакции зависит от следующих факторов:
1) концентрация реагентов: чем выше, тем больше скорость реакции.
2) температура: с ростом температуры скорость любой реакции увеличивается.
3) площадь соприкосновения реагирующих веществ: чем больше площадь контакта реагентов, тем выше скорость реакции.
4) перемешивание, если реакция происходит между твердым веществом и жидкостью или газом перемешивание может ее ускорить.