хлорное железо что это такое
Хлорное железо
Хлорное железо
| Хлорид железа(III) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорид железа(III) |
| Химическая формула | FeCl3 |
| Отн. молек. масса | 162 а. е. м. |
| Молярная масса | 162.2 г/моль |
| Физические свойства | |
| Плотность вещества | 2,8 г/см³ |
| Состояние (ст. усл.) | твердый |
| Термические свойства | |
| Температура плавления | 306 °C |
| Температура кипения | 315 °C |
| Химические свойства | |
| Растворимость в воде | 92 г/100 мл |
| Классификация | |
| номер CAS | 7705-08-0 |
Хлорид железа(III), хлорное железо FeCl3 — средняя соль трёхвалентного железа и соляной кислоты.
Содержание
Физические свойства
Мерцающие, слегка зеленоватые листочки с металлическим блеском. Сильно гигроскопичен, на воздухе превращается в гидрат FeCl3· 6Н2О — гигроскопичные жёлтые кристаллы, хорошо растворимые в воде (при 20 °C в 100 г воды растворяется 91,9 г безводной соли). Tпл 309 °C.
Методы получения
Химические свойства
Применение
См. также
Полезное
Смотреть что такое «Хлорное железо» в других словарях:
ЖЕЛЕЗО — см. ЖЕЛЕЗО (Fe). В поверхностных водах содержание железа колеблется в широких пределах. В подземных водоисточниках и водах болот его концентрация достигает десятков мг/л. Резкое повышение железа в водоемах происходит при загрязнении их сточными… … Болезни рыб: Справочник
Железо — (Ferrum) Металл железо, свойства металла, получение и применение Информация о металле железо, физические и химические свойства металла, добыча и применение железа Содержание Содержание Определение термина Этимология История железа Происхождение… … Энциклопедия инвестора
Железо — 26 Марганец ← Железо → Кобальт … Википедия
ЖЕЛЕЗО — ЖЕЛЕЗО, Ferrum (Fe), тяжелый металл, относящийся к VIII группе периодической системы Менделеева. Ат. в. 55,84(0=16), при чем известны два изотопа с ат. в. в 56 и 54. Чистое Ж. обладает серебристо белым цветом; уд. в. 7,88; оно мягче и более… … Большая медицинская энциклопедия
Железо — (техн.) Ж. есть наиболее распространенный и наиболее употребительный из металлов. Ж. было известно еще египтянам во время постройки пирамид; у греков упоминается о нем в Илиаде Гомера, причем о нем говорится, как о трудно обрабатываемом металле,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Ferric chloride — Хлорное железо, FeCl3 … Краткий толковый словарь по полиграфии
Амальгамация — так называется горнозаводский способ извлечения серебра и золота из руд и заводских продуктов при помощи ртути. Есть два способа: американский, или амальгамация в кучах, и европейский, или амальгамация в бочках. Первый введен в Мексике Бартоломе… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Физиология растений — Содержание: Предмет Ф. Ф. питания. Ф. роста. Ф. формы растений. Ф. размножения. Литература. Ф. растения изучает процессы, совершающиеся в растениях. Эта часть обширной науки о растениях ботаники отличается от ее остальных частей систематики,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
БЕСТУЖЕВА КАПЛИ — БЕСТУЖЕВА КАПЛИ, Tinct. ferri chlo rati aetherea, Spiritus aethereus ferratus (Ф VII), Tinct. nervina Bestuscheffi, предложены в 1725 г. графом А. П. Бестужевым Рюминым, Б. к. представляют спиртно эфир ный раствор хлорного железа, подвергнутый… … Большая медицинская энциклопедия
Хлорид железа. Понятие, свойства и применение
Благодаря своему уникальному составу химический реактив нашел свое широкое применение во многих отраслях промышленности: 
— химической (при изготовлении железных пигментов и других солей железа);
— электронной (при работе с печатными платами);
— экологической (при очистке сточных вод);
— пищевой (улучшитесь муки, при изготовление хлебобулочных изделий);
— издательском производстве (как реактив в фотографии);
— ювелирном производстве;
— металлургии (при металлообработке);
— пивоваренной.
Хлорное железо в фармакологии и медицине
Меры предосторожности при работе с хлоридом железа
Также нужно помнить, что данный химический реактив пожаро- и взрывоопасен. Хранить хлорное железо нужно в закрытой упаковке вдали от солнечных лучей и нагревательных приборов.
Получение хлорида железа в домашних или лабораторных условиях
1 способ. В лабораторную посуду или лабораторную посуду из стекла положить обыкновенной ржавчины и разбавить соляной кислотой в соотношении 1:3. Полученный химический реактив (характерный признак – желтовато-коричневый цвет) через 2-3 дня сливают и при необходимости пропускают через фильтровальную бумагу.

После проведенных лабораторных работ помещение следует хорошо проветрить, так как пары железа могут вызвать поражения органов дыхания, зрения и кожных покровов.
Где хлорное железо купить в Москве?
Идеальным магазином, где можно хлорное железо купить в Москве, является магазин химических реактивов Москва розница «Прайм Кемискалс Групп». В нашем интернет-магазине представлены все виды лабораторного оборудования и приборов, лабораторной посуды, лабораторной посуды из стекла, резинотехнических изделий, лабораторного стекла. Вся продукция прошла контроль качества на заводе-изготовителе и отвечает всем стандартам ГОСТ.
У нас качественная продукция по доступным ценам.
Хлорное железо купить в Москве всего за 80 руб.
Хлорид железа
Хлорное железо — порошок ярко-оранжевого или черного цвета, данная субстанция представляет собой кристаллическую массу с выраженным запахом металла. Самой популярной основой в производстве, является трехвалетное железо и соляная кислота, выделяется ядовито бурый дым. Безводная соль в свою очередь служит осушителем, при контакте с водой выделяет большую температуру.
Химические свойства хлорного железа
Делиться на два вида, это шести водное и безводное хлорное железо. Основным отличием от двух этих видов является кол-во молекул воды в составе, а также валентность железа при производстве. В случае достижения температуры плавления, начинается образование дихлорида и молекулярного хлора.
Применение железо хлорида в быту и промышленности
Широкое распространение хлорид железа нашел в электронике, автомастерских, водоснабжении, кузнечном деле и т.д.
Основные направления применения трёхвалентного железа:
Хлорное железо является довольно-таки разносторонним реактивом, он используется в самых разных и неожиданных областях промышленности и быта.
Хлорное железо — реактив, полезный для промышленности и радиолюбителей
Хлорное железо — неорганическое вещество, соль соляной кислоты 
Получают соединение различными способами, в том числе экономически дешевым методом — из отходов при производстве хлорида титана и хлорида алюминия.
Темные кристаллы с красновато-коричневым металлическим блеском, которые на воздухе быстро приобретают ржаво-коричневый цвет. Очень гигроскопичные, легко растворяются в воде, образуют несколько видов кристаллогидратов. Самый востребованный из них — железо хлорное 6-водное FeCl3 ∙ 6H2O. Растворение в воде сопровождается выделением тепла. Реактив растворяется в спиртах, ацетоне. При нагревании теряет часть хлора, превращаясь в хлорид двухвалентного железа.
Трихлорид железа обладает окислительными свойствами, вступает в реакции с медью и другими металлами, йодоводородом, оксидом железа (III), некоторыми хлоридами металлов. Качественной реакцией на реагент является реакция с фенолом. Несколько капель FeCl3 окрашивают раствор фенола в фиолетовый цвет.

Попадание брызг в глаза приводит к химическому ожогу. Если это произошло, следует немедленно их промыть и обратиться к врачу. Очень опасно проглатывание хлорного железа. Рабочее место должно быть оборудовано вентиляцией, так как вдыхать пары опасно.
Перевозить реактив можно любым видом транспорта. Хранят его в прохладных складах без отопления, без доступа солнечных лучей, в герметичной таре, защищающей от контакта с воздухом.
Раствор трихлорида железа коррозионно активен, поэтому его хранят в стойких к коррозии емкостях.
В продажу хлорное железо поступает в виде твердого вещества и в виде раствора. В магазине «ПраймКемикалсГрупп» вы можете купить 6-водное хлорное железо в виде кусков или кристаллов, оптом и в розницу. Есть скидки, возможность самовывоза и доставка.
Что такое хлорида железа (ІІІ), свойства и применение
Хлорид железа (III) (хлорное железо, трихлорид железа) – это средняя соль 3-х валентного Fe и хлороводородной кислоты с окислительными свойствами. На вид – мягкая масса с варьирующейся цветовой гаммой: черно-коричневая, фиолетовая или темно-красная в проходящем световом излучении и зеленая в отраженном. Кроме того, ей присущ металлический отблеск и мерцание.
Данное вещество характеризуется значительной гигроскопичностью, хорошо растворяется в H2O (92 г/100 мл) и гидролизуется ею. Также растворению поддается в жидких диоксиде серы и хлоре, хлориде мышьяка (III), трибромиде фосфора и сероуглероде.
При пребывании на воздухе трансформируется в гидрат – желтый кристаллический материал, также отлично растворяющийся в воде. Так как трихлорид железа является, по Льюису, сильной кислотой, он взаимодействует с рядом иных хлоридов, образуя соли-комплексы тетрахлорферратной кислоты. Вступает в реакцию с HI. При нагреве в давлении атмосферы до t плавления постепенно разлагается, образуя дихлорид и молекулярный Cl. А нагрев до 350 °C совместно с оксидом железа приводит к появлению оксид-хлорида железа. Соли рассматриваемого вещества – продукты со слабыми окислительными свойствами, поэтому ему под силу, к примеру, осуществлять окисление металлической Cu, трансформируя ее в хлориды, поддающиеся растворению.
Молярная масса – 162,2 г/моль, плотность – 2,8 г/см³. Термосвойства: t плавления – 306 °C, t кипения – 315 °C. Формула: FeCl3.
Получение этого соединения возможно следующими способами:
Применение
Хлорид железа (III) чаще всего используют в таких направлениях:
При работе с хлорным железом важно знать, что оно токсично и обладает высоким коррозионным воздействием. Безводной соли характерно осушение. Выпуск, транспортировка и хранение должны осуществляться с соблюдением специальных технических условий. Ввиду гигроскопичности, хранить данный реактив необходимо в плотно закрытой таре. Для перевозок подходят канистры и цистерны.
Физические свойства безводного вещества и гексагидрата, соответственно: молярная масса – 162,2 и 270,3 г/моль, плотность – 2,8 и 1,82 г/см³. Термосвойства: t плавления – 306 и 37 °C, t кипения – 315 °C. Формула: FeCl3. Получают хлорид железа:
Железо хлорное техническое производят при синтезировании Br2.
Применение хлорного железа (ІІІ)
Вещество в твердом виде, а также его водные и тех. растворы находят широчайшее применение в промышленности. К главным направлениям можно зачислить химическую отрасль, приборостроение и организации с водоочистительной спецификой. Железо хлорное используют для очищения, осветления и смягчения воды, как той, что предназначена для употребления людьми, так и отработанной, сточной. С его участием осуществляют подготовительные мероприятия, связанные с пром. и хоз. водами, которые необходимо далее эксплуатировать тем или иным образом. Растворяясь в водной среде, железо хлорное (цена которого, кстати, на сегодняшний день доступная) поддается разложению, в результате чего происходит отдача тепла. Получается раствор бурого цвета, кислого вкуса и с коррозионным воздействием – тот самый флокулянт для очищения стоков и изготовления воды для питья. Слабощелочная среда при этом становится предусловием реагирования с гидроксильным ионом и формирования осадка железа (III) гидроксида.
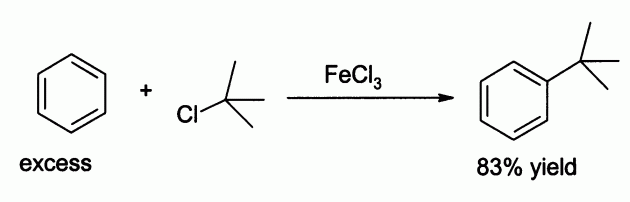
Рассматриваемый материал используют и для изъятия масел из стоков масложировых предприятий, хромовых соединений из сточных вод кожевенно-меховых производств. Часто не обходится без данного вещества и коагуляция осадков городских стоков. В качестве коагулянта железа хлорид, по сравнению с иными коагулирующими агентами, обладает неоспоримыми плюсами, среди которых, главным образом: осаждение разного рода примесей с большой скоростью и положительное воздействие на разложение иловых пластов. Немалое значение он имеет для хлорорганического синтеза (например, для обеспечения реагирования Cl2 и C2H4 с возникновением хлористого этилена), процессов изготовления термостойких смол и оксидации таких материалов, как нефтяные битумы. Здесь использование хлорного железа как катализатора основывается на его кислотных характеристиках, поскольку в безводном состоянии вещество является весьма мощным хим. соединением, принадлежащим к кислотам Льюиса. Кроме того, выступает реагентом при сушении в ряде химических процессов, помогает выявлять фенол-соединения в орган. синтезе. Железо (ІІІ) хлорное принимает участие в:
Техника безопасности. Если хлорид железа купить для более или менее активного применения в любом из упомянутых направлений, важно знать о возможных последствиях несоблюдения условий использования. Данное вещество зачислено к представителям восьмого класса опасности, поэтому требует задействования СИЗ, а именно резиновых перчаток, респиратора и защитных очков. Такие несложные меры обеспечат отсутствие контакта железа хлорного с кожными покровами и слизистыми оболочками, предотвратят ожоги. К тому же, не исключен вред для дыхательной и пищеварительной систем. Чтобы избежать прижигающего влияния и рвоты, стоит не допустить попадание этой соли в организм. Дополнительно важно позаботиться о приточно-вытяжном вентилировании рабочего помещения. Что касается хранения, то для этого подойдут сухие крытые склады. Хлорид железа хорошо чувствует себя и не является источником опасности в упаковке производителя при комнатной температуре, но не переносит нахождения вблизи K и Na.