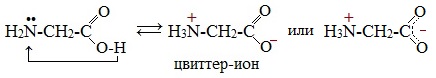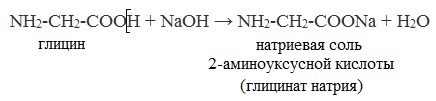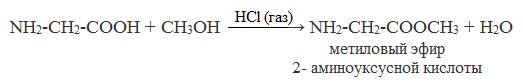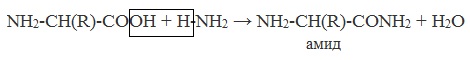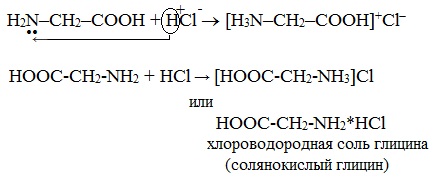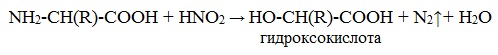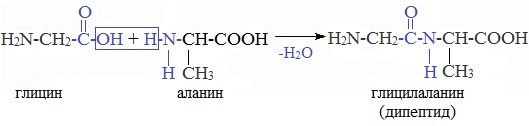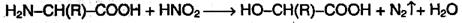Докажите что аминокислоты являются амфотерными соединениями
Докажите что аминокислоты являются амфотерными соединениями
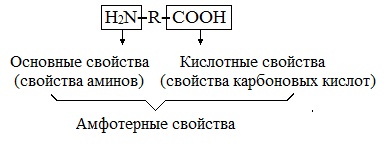
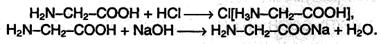
Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
Кислотно-основное равновесие в водных растворах
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
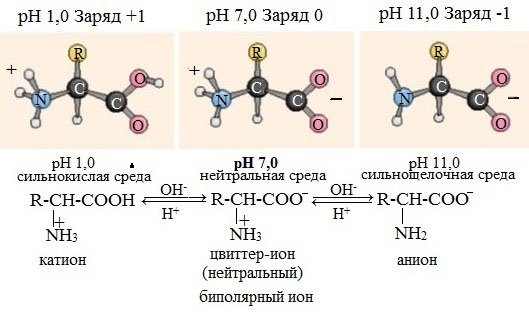
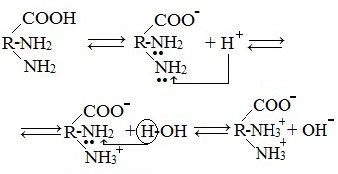
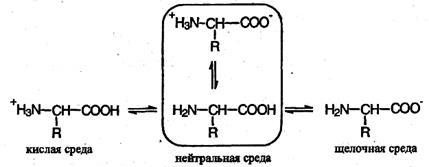
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
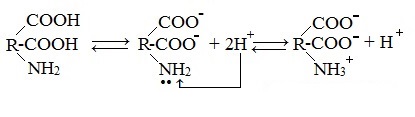
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
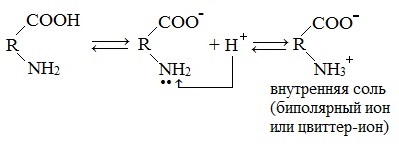
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
в) диаминомонокарбоновые кислоты (основные аминокислоты)
2. Взаимодействие с основаниями и кислотами
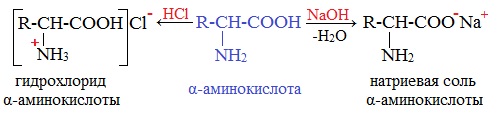
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
в) взаимодействие с аммиаком
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
5. Качественные реакции!
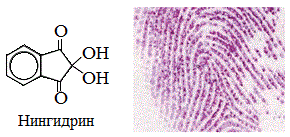
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
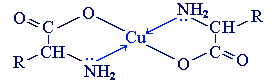
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Видеоопыт «Образование медной соли аминоуксусной кислоты»
Почему аминокислоты амфотерные органические соединения?
Для начала давайте выясним, что собой представляют аминокислоты. Это органические соединения, молекулярная структура которых представлена карбоксильной и аминной группами. В состав аминокислот входят такие элементы, как: водород, углерод, кислород, азот. Некоторые их виды представлены в генетическом коде человека.
Аминокислоты являются вторичным продуктом карбоновых кислот, в которых атомы водорода заменены аминогруппами. В итоге мы имеем соединение, которое содержит две группы — карбоксильную и аминогруппу. Аминогруппа определяет основные свойства аминокислот, а карбоксильная отвечает за их кислотные характеристики. Получается, что аминокислоты обладают как основными, так и кислотными свойствами, что характерно для амфотерных соединений. По этой причине они и называются амфотерными.
Кислотные свойства аминокислот обусловлены наличием в них карбоксильных групп. Основные же свойства определяются входящими в их состав аминогруппами, которые могут соединяться с ионами водорода, что приводит к образованию групп замещенного аммония. В данном случае амфотерные свойства аминокислот будут обусловлены взаимодействием карбоксильных групп с аминогруппами.
Примером амфотерных соединений являются белки, в состав которых входят аминокислоты, обладающие, одновременно, свойствами кислот и оснований. По этой причине они способны образовывать соли двух разных видов. Если говорить проще, то при соединении со щелочами аминокислоты будут проявлять свойства кислот, а при взаимодействии с кислотами, будут вести себя как основания. В этом и выражаются их амфотерные свойства.
Белки являются основным строительным материалом живых организмов, будь то человек, животное, или растение. Они несут ответственность за все его основные функции. В свою очередь, в состав белков входят аминокислоты, представленные карбоновыми кислотами, органическими соединениями, карбоксильными группами. По этой причине белки также обладают амфотерными свойствами.
Амфотерные свойства аминокислот. Ответ подтвердите реакциями с цистеином.



(не те реакции)
65. Заменимые и незаменимые аминокислоты. Приведите примеры. Напишите уравнения реакции образования цистина и цистеина.
Аланин способствует восстановлению после травм. Регулирует уровень сахара в крови. Участвует в энергообразовании. Способствует запасанию гликогена мышцами и печенью.
Аспарагин участвует в метаболизме нервной системы. Участвует в синтезе аминокислот в печени. Способствует выработке аспарагиновой кислоты, которая участвует в синтезе ДНК и РНК.
Аспарагиновая кислота активизирует иммунную систему. Снижает утомляемость. Способствует превращению углеводов в мышечную энергию. Образует лизин и метионин.
Глутамин стимулирует память и мышление. Участвует в синтезе протеина. Повышает выносливость. Нейтрализует токсические соединения в организме. Снижает тягу к алкоголю и сладостям.
Глутаминовая кислота участвует в метаболизме аминокислот. Выполняет функции нейромедиатора в ЦНС. Играет важную роль в углеводном обмене.
Пролин укрепляет суставы и связки. Участвует в выработке энергии. Способствует заживлению ран.
Серин укрепляет иммунную систему. Необходим для нормального обмена жиров и жирных кислот. Участвует в биосинтезе глицина, метионина, цистеина, и триптофана.
Цистеин ускоряет заживление тканей. Стимулирует рост волос. Активизирует иммунную систему. Улучшает мозговую деятельность. Переносит аминокислоты по организму. Антиоксидант.
Валин содержится в моркови, свекле, зерновых, мясе, грибах, молочных продуктах, арахисе. Валин метаболизируется в мышечную ткань, стимулирует умственную деятельность. Валин необходим организму для поддержания нужного уровня обмена азота.
Изолейцин содержится в рыбе, курином мясе, печени, миндале, кешью, в соевых белках. Изолейцин регулирует уровень сахара в крови. Участвует в синтезе гемоглобина. Повышает выносливость организма. Участвует в синтезе метаболизма в мышцах. Расщепляет холестерин.
Лейцин содержится в бобах, буром рисе, пшеничной муке и орехах. Лейцин является источником энергии, способствует восстановлению мышц и костей. Снижает повышенный уровень сахара в крови при диабетах.
Лизин содержат сельдерей, зеленые овощи, молоко, яйца, дрожжевые продукты, мясо. Лизин необходим для роста костной ткани, поддержания женской половой функции. Поддерживает обмен азота в организме. Оказывает противовирусное действие. Стимулирует умственную деятельность.
Метионин содержат в себе яйца, бобовые, лук, чеснок, мясо, йогурты. Метионин улучшает пищеварение, помогает перерабатывать жир. Расщепляет холестерин. Предотвращает выпадение волос. Антиоксидант.
Треонин содержится в листовых овощах, моркови. Треонин активизирует иммунную систему. Детоксикатор. Способствует росту тканей. Помогает усваивать пищевой белок.
Триптофан есть в бананах, помидорах, редьке, фенхеле.
Триптофан регулирует функции иммунной и центральной нервной системы. Способствует хорошему сну. Стимулирует рост кожи и волос. Улучшает пищеварение.
Фенилаланин можно найти в свекле, моркови, яблоках и шпинате. Фенилаланин стимулирует ЦНС. Антидепрессант. Улучшает память и внимание. Повышает работоспособность. Снижает аппетит.
Конспект лекции по теме «Аминокислоты как амфотерные бифункциональные соединения»
Тема: Аминокислоты как амфотерные бифункциональные
Аминокислоты — это органические соединения, содержащие две функциональные группы — аминогруппу (— NH 2 ) и карбоксилъную группу (- СООН).
Их можно рассматривать как производное карбоновых кислот, в радикале которых атом водорода замещен на аминогруппу рис.
уксусная кислота аминоуксусная кислота
Количество функциональных групп, которые могут входить в состав аминокислот, различно.
Простейшими аминокислотами являются одноосновные моноаминокислоты, состав которых выражают общей формулой
Номенклатура. Названия аминокислот образуют от названий соответствующих карбоновых кислот с добавлением слова «амино-» и указанием места расположения аминогруппы:
по рациональной номенклатуре атом углерода, расположенный рядом (соседний) с карбоксильной группой, обозначают буквой а;
по систематической номенклатуре нумеруют углеродную цепь, начиная с атома углерода карбоксильной группы. Многие аминокислоты имеют тривиальное название. На практике чаще используют тривиальную номенклатуру. Наибольшее значение имеют а-аминокислоты, так как они участвуют в построении белковых молекул.
Состав а-аминокислот можно выразить общей формулой:
Физические свойства. Аминокислоты представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде и малорастворимые в органических растворителях. Многие кислоты имеют сладкий вкус. При температуре 250—300 °С они разлагаются.
Химические свойства. Аминокислоты содержат в своем составе две функциональные группы противоположного характера. Аминогруппа обуславливает основные свойства аминокислот, а карбоксильная группа — кислотные. Следовательно, по аналогии с неорганическими веществами (гидроксиды алюминия, цинка), аминокислоты — это органические амфотерные соединения.
основные свойства кислотные свойства
(свойства аминов) (свойства карбоновых кислот)
Как кислоты они взаимодействуют с активными металлами, оксидами и гидроксидами металлов, солями слабых летучих кислот, а также со спиртами (реакция этерификации):
Реакции с участием аминогруппы
Как основания аминокислоты реагируют с кислотами
гидрохлорид (хлороводородная соль)
Особые свойства аминокислот. Наличие в молекуле аминокислоты двух функциональных групп приводит к появлению новых свойств.
Взаимодействие внутри молекулы. Водные растворы аминокислот могут иметь нейтральную, щелочную или кислую среду в зависимости от того, сколько они содержат амино- и карбоксильных групп. Это объясняется тем, что при растворении в воде карбоксильная группа отщепляет ион водорода, который присоединяется к аминогруппе, т. е. протекает внутримолекулярная нейтрализация (кислота + основание). Это приводит к образованию внутренней соли, молекула которой представляет собой биполярный ион:
внутренняя соль (биполярный ион)
Взаимодействие аминокислот друг с другом (реакции конденсации). Молекулы аминокислот могут реагировать друг с другом. При этом происходит взаимодействие карбоксильной группы одной молекулы и аминогруппы другой молекулы. Реакция конденсации сопровождается отщеплением молекулы воды и образованием пептида. При конденсации двух молекул аминокислоты образуется дипептид:
Пептиды — это органические соединения, состоящие из остатков а-аминокислот, соединенных между собой пептидными (амидными) связями — CO — NH — и имеющие невысокие значения относительных молекулярных масс (до 10000).
Например, природный пептид окситоцин (стимулирует выделение молока молочными железами) имеет относительную молекулярную массу 1007, а инсулин (регулирует содержание сахара в крови) — 5734.
Пептиды являются продуктами частичного гидролиза белков, т. е. это простейшие полипептиды. Они, в кислой или щелочной среде, а также под действием ферментов, подвергаются дальнейшему гидролизу с образованием пептидов с меньшей относительной молекулярной массой или а-аминокислот.
Пептиды, как и белки, играют важную роль в процессах жизнедеятельности. Пептидами являются многие гормоны, некоторые антибиотики и токсины, ферменты. Многие пептиды применяют в медицине и сельском хозяйстве.
Получение аминокислот. Биологически важные (природные) а-аминокислоты получают гидролизом белков.
Значение аминокислот. Биологическое значение а-аминокислот определяется тем, что они являются структурными единицами («кирпичиками»), из которых построены все растительные и животные белки. Поступая вместе с пищей в организм, белки расщепляются на составные а-аминокислоты, которые используются организмом для синтеза белков, свойственных данному организму.
В связи с этим аминокислоты делят на заменимые и незаменимые.
Заменимые — это аминокислоты, которые синтезируются в организме . К ним относятся: глицин, аланин, глутаминовая кислота, серин, аспарагиновая кислота и др.
Незаменимые — это аминокислоты, которые не синтезируются в организме и поступают только с пищей . Это лизин, валин, фенилаланин, триптофан, лейцин и др. Их недостаток в пище приводит к нарушению многих функций организма и может быть причиной прекращения роста организма, истощения, несмотря на достаточную калорийность питания.
Например, белок кукурузы зеин не содержит лизина. В опытах с животными, которые получали с пищей один только этот белок, наблюдалась, несмотря на обильное кормление, потер веса. Отсутствие в пище триптофана может быть причиной тяжелого заболевания глаз — катаракты.
Поэтому эти аминокислоты нужно добавлять в пищу, так как организм может усваивать их в свободном виде. Необходимо добавлять недостающие аминокислоты и в корм животным. Даже малые их дозы позволяют ускорить рост животных и снизит расход кормов.
Аминокислоты находят применение и в пищевой промышленности. Например, глутаминовую кислоту добавляют в консервы и пищевые концентраты для улучшения вкуса.
Напишите уравнение реакции поликонденсации этой кислоты.
Отличие этих полимеров от белков (полипептидов) заключается в том, что здесь цепь образована не а-аминокислотами.
1. Составьте структурные формулы изомерных аминокислот состава C 4 H 9 О 2 N назовите их.
2. Докажите амфотерность а-аминопропионовой кислоты (напишите не мене трех уравнений).
4. Напишите уравнения реакций получения:
а) хлороводородной соли а-аминомасляной кислоты;
б) аминоуксусной кислоты из ацетилена.
5. При взаимодействии четырех молекул аминокислот выделяется молекул воды:
а) три; б) две; в) четыре; г) одна.
6. Определите формулу одноосновной моноаминокарбоновой кислоты, входящей в состав белков, для полной нейтрализации которой потребовался раствор, содержащий 16,2 г бромоводородной кислоты.
7. Для полной нейтрализации смеси уксусной и аминоуксусной кислот требуется 150 мл 2М раствора гидроксида натрия. Исходная смесь может прореагировать с 73 г 10%-ного раствора соляной кислоты. Определите массовые доли (%) веществ в исходной смеси.
Химические свойства. Аминокислоты – это органические амфотерные соединения
Аминокислоты – это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями:
В твердом состоянии и в водных растворах аминокислоты существуют в виде биполярных ионов (внутренних солей), которые образуются при переносе протона от карбоксильной группы к аминогруппе:
В твердом состоянии аминокислоты имеют структуру цвиттер-иона (биполярного иона), который в кислом растворе превращается в катион, а в щелочном растворе – в анион:
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. Так, глутаминовая кислота образует кислый раствор (две группы –СООН, одна –NH2), лизин – щелочной (одна группа –СООН, две –NН2).
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
Измерение объема выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир (точнее, в хлороводородную соль эфира):
Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
1) Все аминокислоты окисляются нингидрином с образованием продуктов, окрашенных в сине-фиолетовый цвет.
Иминокислота пролин дает с нингидрином желтое окрашивание. Эта реакция может быть использована для количественного определения аминокислот спектрофотометрическим методом.
2) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца, и образуются соединения, окрашенные в желтый цвет. Эту реакцию называют ксантопротеиновой(от греч. ксантос – желтый).
Дата добавления: 2015-08-08 ; просмотров: 1432 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ