Докажите что амфотерность подтверждает
§ 2. Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Существенным отличительным признаком элементов является кислотный или основный характер соответствующих им оксидов и гидроксидов. Вы уже знаете, что металлы в степени окисления +1 и +2 образуют, как правило, основные оксиды, а в качестве гидроксидов — основания. Металлы с большим значением степени окисления (+6, +7) и неметаллы образуют кислотные оксиды, которым соответствуют кислородсодержащие кислоты.
Проведём небольшой лабораторный опыт. Получим гидроксид цинка и исследуем его химические свойства.
Лабораторный опыт № 1
Получение гидроксида цинка и исследование его свойств
| В две пробирки налейте по 1 мл раствора соли цинка (хлорида, сульфата или нитрата), а затем добавьте в каждую с помощью пипетки по 5 капель раствора щёлочи (гидроксида натрия или калия). Что наблюдаете? Прилейте к содержимому одной пробирки раствор кислоты (соляной, серной или азотной), а к другой — раствор щёлочи. Что наблюдаете? О каком свойстве гидроксида цинка свидетельствует вторая часть опыта? Запишите уравнение проделанных реакций в молекулярной и ионной формах. |
В чём причина такого необычного поведения Zn(OH)2 как нерастворимого основания? Опыт показывает, что гидроксид цинка проявляет свойства оснований, взаимодействуя с кислотой, но он также ведёт себя и как нерастворимая кислота, взаимодействуя с щёлочью.
| Вещества, которые в зависимости от условий реакций проявляют кислотные или основные свойства, называют амфотерными (от греч. амфотеро — и тот, и другой). |
Таким образом, гидроксиду цинка присущи амфотерные свойства: он может реагировать с кислотами как основание и с щелочами как кислота. Соответственно формулу этого соединения можно представить двояко:
Тогда уравнения реакций гидроксида цинка с кислотой и с щёлочью можно записать так:
В обоих случаях образуется растворимая соль.
Аналогично гидроксиду цинка и соответствующий ему оксид цинка проявляет амфотерные свойства — образует соли при взаимодействии как с кислотами, так и с основаниями, например:
В первой реакции оксид цинка ведёт себя как основный оксид, а во второй реакции выступает в роли кислотного оксида — образует соль, в которой цинк входит в состав кислотного остатка.
Амфотерными являются оксиды и гидроксиды многих элементов, например бериллия, алюминия, хрома (III).
Если элемент-металл проявляет несколько степеней окисления, то его оксид и гидроксид с низшей степенью окисления будут проявлять, как правило, основные свойства, с высшей — кислотные, а с промежуточной — амфотерные. Например, для хрома:
Амфотерные оксиды и гидроксиды образуют чаще всего те элементы, которые составляют побочные подгруппы Периодической системы Д. И. Менделеева. Эти элементы называют переходными элементами или переходными металлами.
Новые слова и понятия
Задания для самостоятельной работы
§ 2. Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Существенным отличительным признаком элементов является кислотный или основный характер соответствующих им оксидов и гидроксидов. Вы уже знаете, что металлы в степени окисления +1 и +2 образуют, как правило, основные оксиды, а в качестве гидроксидов — основания. Металлы с большим значением степени окисления (+6, +7) и неметаллы образуют кислотные оксиды, которым соответствуют кислородсодержащие кислоты.
Проведём небольшой лабораторный опыт. Получим гидроксид цинка и исследуем его химические свойства.
В чём причина такого необычного поведения Zn(OH)2 как нерастворимого основания? Опыт показывает, что гидроксид цинка проявляет свойства оснований, взаимодействуя с кислотой, но он также ведёт себя и как нерастворимая кислота, взаимодействуя с щёлочью.
Таким образом, гидроксиду цинка присущи амфотерные свойства: он может реагировать с кислотами как основание и с щелочами как кислота. Соответственно формулу этого соединения можно представить двояко:
Тогда уравнения реакций гидроксида цинка с кислотой и с щёлочью можно записать так:
В обоих случаях образуется растворимая соль.
Аналогично гидроксиду цинка и соответствующий ему оксид цинка проявляет амфотерные свойства — образует соли при взаимодействии как с кислотами, так и с основаниями, например:
В первой реакции оксид цинка ведёт себя как основный оксид, а во второй реакции выступает в роли кислотного оксида — образует соль, в которой цинк входит в состав кислотного остатка.
Амфотерными являются оксиды и гидроксиды многих элементов, например бериллия, алюминия, хрома (III).
Если элемент-металл проявляет несколько степеней окисления, то его оксид и гидроксид с низшей степенью окисления будут проявлять, как правило, основные свойства, с высшей — кислотные, а с промежуточной — амфотерные. Например, для хрома:
Амфотерные оксиды и гидроксиды образуют чаще всего те элементы, которые составляют побочные подгруппы Периодической системы Д. И. Менделеева. Эти элементы называют переходными элементами или переходными металлами.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
1. Почему для получения амфотерного гидроксида из раствора соли переходного элемента раствор щёлочи к ней приливают по каплям?
2. Запишите уравнения реакций для следующих превращений:
Первую реакцию рассмотрите с позиций окисления-восстановления.
3. Приведите по два молекулярных уравнения реакций, соответствующих сокращённым ионным уравнениям:
Докажите что амфотерность подтверждает
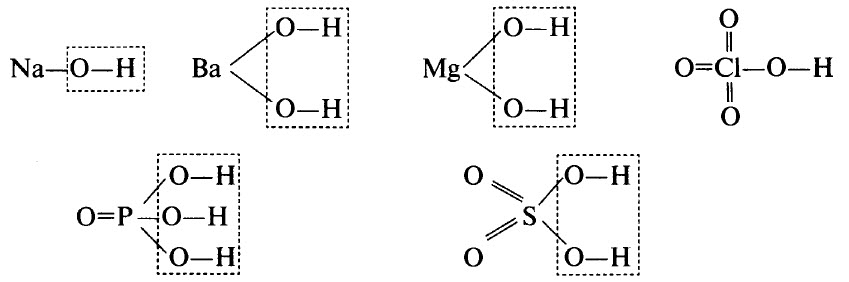
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н + = Al 3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
В образовавшейся соли алюминий образует анион AlO2 – (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4] – :
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока по химии для 8 класса «Амфотерные оксиды и гидроксиды». Выберите дальнейшее действие: