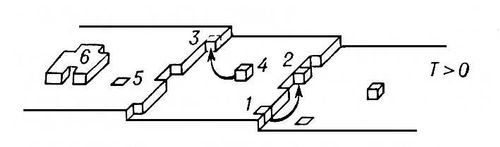
Для чего применяется кристаллизация
Кристаллизация
1) Процесс кристаллизации начинается только после охлаждения жидкости к определённой температуре.
2) Во время кристаллизации температура не меняется.
3) Температура кристаллизации равна температуре плавления.
При образовании кристаллов происходит фазовый переход, то есть переход вещества из одной термодинамической фазы в другую. Образование кристаллов из газов, растворов, расплавов или стёкол представляет собой фазовый переход первого рода, а кристаллизация при полиморфных превращениях может быть фазовым переходом второго рода.
Кристаллизация начинается при достижении некоторого предельного условия, например, переохлаждения жидкости или пересыщения пара, когда практически мгновенно возникает множество мелких кристалликов — центров кристаллизации. Кристаллики растут, присоединяя атомы или молекулы из жидкости или пара. Рост граней кристалла происходит послойно, края незавершённых атомных слоев (ступени) при росте движутся вдоль грани. Зависимость скорости роста от условий кристаллизации приводит к разнообразию форм роста и структуры кристаллов (многогранные, пластинчатые, игольчатые, скелетные, дендритные и другие формы, карандашные структуры и т. д.). В процессе кристаллизации неизбежно возникают различные дефекты.
На число центров кристаллизации и скорость роста значительно влияет степень переохлаждения.
Степень переохлаждения — уровень охлаждения жидкого металла ниже температуры перехода его в кристаллическую (твёрдую) модификацию. Переохлаждение необходимо для компенсации энергии скрытой теплоты кристаллизации.
Первичной кристаллизацией называется образование кристаллов в металлах (сплавах и жидкостях) при переходе из жидкого состояния в твёрдое.
Кристаллизация
Из Википедии — свободной энциклопедии
Кристаллизация начинается при достижении некоторого предельного условия, например, переохлаждения жидкости или пересыщения пара, когда практически мгновенно возникает множество мелких кристалликов — центров кристаллизации. Кристаллики растут, присоединяя атомы или молекулы из жидкости или пара. Рост граней кристалла происходит послойно, края незавершённых атомных слоев (ступени) при росте движутся вдоль грани. Зависимость скорости роста от условий кристаллизации приводит к разнообразию форм роста и структуры кристаллов (многогранные, пластинчатые, игольчатые, скелетные, дендритные и другие формы, карандашные структуры и т. д.). В процессе кристаллизации неизбежно возникают различные дефекты.
На число центров кристаллизации и скорость роста значительно влияет степень переохлаждения.
Степень переохлаждения — уровень охлаждения жидкого металла ниже температуры перехода его в кристаллическую (твёрдую) модификацию. Переохлаждение необходимо для компенсации энергии скрытой теплоты кристаллизации. Первичной кристаллизацией называется образование кристаллов в металлах (сплавах и жидкостях) при переходе из жидкого состояния в твёрдое.
Кристаллизация
Кристаллиз а ция, образование кристаллов из паров, растворов, расплавов, вещества в твёрдом состоянии (аморфном или другом кристаллическом), в процессе электролиза и при химических реакциях. Кристаллизация приводит к образованию минералов. Кристаллизация воды играет важную роль в атмосферных и почвенных явлениях. Кристаллизация лежит в основе металлургии, получения полупроводниковых, оптических, пьезоэлектрических и др. материалов, плёнок для микроэлектроники, металлических покрытий, широко используется в химической, пищевой, медицинской промышленности (очистка веществ, производство удобрений, соли, сахара, химикалиев, лекарств).
Условия кристаллизации. Если кристалл не плавится, не растворяется, не испаряется и не растет, то он находится в термодинамическом равновесии с маточной средой (расплавом, раствором или паром). Равновесие кристалла с расплавом того же вещества возможно лишь при температуре плавления Тпл, а равновесие с раствором и паром — если последние насыщены. Пересыщение или переохлаждение среды — необходимое условие для роста погруженного в неё кристалла, причём скорость роста кристалла тем больше, чем больше отклонение от равновесия.
Выделение скрытой теплоты кристаллизации ведёт к нагреванию расплава, уменьшению переохлаждения и замедлению кристаллизации, которая заканчивается исчерпанием вещества или достижением равновесных значений температуры, концентрации и давления.
Зародыши кристаллизации. Переохлажденная среда может долго сохранять, не кристаллизуясь, неустойчивое метастабильное состояние (например, мелкие, диаметром 0,1 мм капли хорошо очищенных металлов можно переохладить до температуры
0,8 Тпл). Однако при достижении некоторого предельного для данных условий критического переохлаждения в жидкости или паре почти мгновенно возникает множество мелких кристалликов (зародышей). Происходит спонтанная кристаллизация. Возникшие кристаллики растут и, т. к. переохлаждение уменьшается, новые зародыши, как правило, больше не возникают. Критическое переохлаждение зависит от температуры, концентрации, состава среды, её объёма, от присутствия посторонних частиц (например, пылинок, на которых образуются зародыши, кристалликов др. веществ и т. п.), от материала и состояния поверхности стенок сосуда, от интенсивности перемешивания, действия излучений и ультразвука.
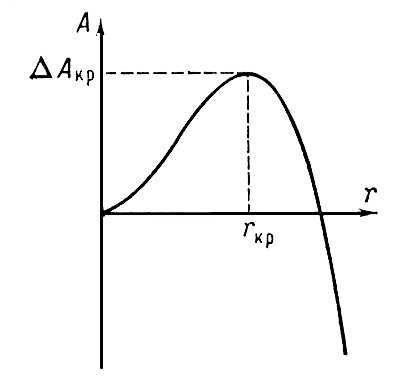
При зарождении атомы или молекулы кристаллизующегося вещества объединяются в кристаллические агрегаты. Объединение частиц в агрегат уменьшает свободную энергию системы, а появление новой поверхности — увеличивает. Чем меньше агрегат, тем большая доля его частиц лежит на поверхности, тем больше роль поверхностной энергии. Поэтому с увеличением размера r агрегата работа А, требующаяся для его образования, вначале увеличивается, а затем падает (рис. 1). Агрегат, для которого работа образования максимальна, называется критическим зародышем (rкр). Чем меньше работа образования зародыша, тем вероятнее его появление. С этим связано преимущественное зарождение на посторонних частицах (в особенности заряженных), на поверхностях твёрдых тел и на их дефектах. Такое зарождение называется гетерогенным. При кристаллизации на поверхности твёрдого тела зарождение происходит преимущественно на неоднородностях поверхности. При этом кристаллики «декорируют» дефекты и неоднородности. Гомогенное зарождение в объёме чистой жидкости возможно лишь при очень глубоких переохлаждениях. С понижением температуры и с ростом переохлаждения уменьшается работа образования зародыша, но одновременно падает и вязкость жидкости, а с нею и частота присоединения новых частиц к кристаллическим агрегатам. Поэтому зависимость скорости зарождения от температуры имеет максимум (рис. 2). При низких температурах подвижность частиц жидкости столь мала, что расплав твердеет, оставаясь аморфным, — возникает стекло.
Выращивание крупных совершенных монокристаллов часто ведут из метастабильных растворов и расплавов, вводя в них небольшие затравочные кристаллы и избегая самопроизвольного зарождения. Наоборот, в металлургических процессах стремятся иметь максимальное число зародышей.
Эпитаксия. Кристаллы, возникающие на поверхностях др. кристаллов, ориентированы относительно них закономерно. Например, при кристаллизации Au (из атомарного пучка) на поверхности кристалла NaCl кристаллики Au ориентированы параллельно грани NaCl либо гранями куба, либо гранями октаэдра. Явление ориентированного нарастания называется эпитаксией Эпитаксия из газовой фазы происходит, если температура подложки выше некоторой критической (если температура ниже, то кристаллики ориентированы хаотично) и сильно зависит от чистоты и дефектности подложки, состава окружающей среды, а также от предварительного облучения подложки электронами или рентгеновскими лучами. Подложка ориентирует кристаллики даже через тонкие (
1000 Ǻ ) плёнки угля, поливинилхлорида, окиси цинка, селена, если последние нанесены не в сверхвысоком вакууме.
Эпитаксия используется для получения монокристаллических плёнок, применяемых, в частности, в микроэлектронике. При этом на монокристальной подложке образуются отдельные, одинаково ориентированные кристаллики, которые затем срастаются в сплошную плёнку. Чистота и совершенство подложки сильно влияют на качество плёнки и её структуру. Дефекты плёнки возникают на примесях, а также в местах срастания отдельных кристалликов.
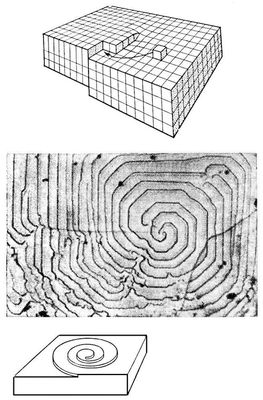
Если кристалл содержит винтовую дислокацию, то его атомные слои подобны этажам гаража с винтовым выездом в середине. Надстройка такого кристалла происходит присоединением атомов к торцу последней ступени (рис. 4, а). В результате кристаллический слой растет, непрерывно накручиваясь сам на себя, надстраивая дислокацию, а ступень в процессе роста принимает форму спирали (рис. 4, б, в). Дислокация обеспечивает при малых переохлаждениях квадратичную зависимость скорости роста грани от переохлаждения (пересыщения), т. е. заметную скорость роста уже при малых отклонениях от равновесия.
В случае бездислокационного кристалла отложению каждого нового слоя должно предшествовать его зарождение. При малых пересыщениях новые слои зарождаются лишь около дефектов поверхности, а при больших отклонениях от равновесия и на совершенных кристаллах зарождение слоев возможно в любых точках поверхности. При больших отклонениях от равновесия как зародышевый, так и дислокационный механизмы создают высокую плотность ступеней, а скорость роста увеличивается с переохлаждением линейно.
Ступени, расходящиеся по грани от уколов, царапин, а при больших пересыщениях от вершин кристалла, образуют холмики роста. Поверхность растущей грани целиком состоит из них. Склоны холмиков отклонены от грани на углы порядка нескольких градусов, причём тем меньше, чем меньше пересыщение.
Из расплава кристаллы (например, для большинства металлов) часто растут не огранёнными, а округлыми. Округлые поверхности растут не послойно (тангенциально), а нормально, когда присоединение новых частиц к кристаллу происходит практически в любой точке его поверхности.
Поверхности кристаллов, растущих послойно, являются атомно гладкими. Это означает, что основная масса возможных атомных положений в слое занята (рис. 5). Поверхности, растущие нормально, в атомном масштабе являются шероховатыми. В них количество вакансии и атомов, адсорбированных на поверхности и занимающих отдельные места, подлежащие заполнению в следующем слое, соизмеримо с полным числом возможных атомных положений (рис. 6). Атомно шероховатые поверхности, а часто и торцы ступеней на атомно гладких поверхностях содержат множество изломов. На изломах атомы могут переходить в кристаллическую фазу поодиночке, не объединяясь в агрегаты и потому не преодолевая связанных с этой коллективностью потенциальных барьеров. Поэтому рост шероховатой поверхности и ступеней обусловлен главным образом присоединением отдельных частиц к изломам. В результате скорости роста шероховатых поверхностей почти одинаковы во всех направлениях и форма растущего кристалла — округлая, а атомно гладкие поверхности растут послойно.
Заполнение каждого нового атомного места в кристалле происходит не сразу, а после многочисленных «проб и ошибок» — присоединений и отрывов атомов или молекул. Характерное число попыток на одно «прочное», необратимое присоединение тем больше, чем меньше отклонение от равновесия. Вероятность появления дефектов при кристаллизации падает с ростом числа попыток, т. е. уменьшением пересыщения. Частицы кристаллизующегося вещества поступают к изломам из раствора за счёт диффузии, а при послойном росте из паров — также из адсорбционного слоя благодаря диффузии по поверхности. Скорость роста кристалла из растворов определяется степенью лёгкости отделения строительной частицы от молекул или ионов растворителя и пристройки их к изломам. Скорость роста из расплавов обусловлена лёгкостью изменения относительных положений соседних частиц жидкости, т. е. её вязкостью.
Формы роста кристаллов. Простейшая форма роста — многогранник, причём размеры граней сильно зависят от условий роста. Отсюда пластинчатые, игольчатые и др. формы кристаллов. При росте больших огранённых кристаллов из неподвижного раствора пересыщение выше у вершин и рёбер кристалла и меньше в центральных частях грани. Поэтому вершины становятся ведущими источниками слоев роста. Если пересыщение над центральными участками граней достаточно мало, то грань уже не может больше расти, и вершины обгоняют центры граней. В результате возникают скелетные формы кристаллов (рис. 7). Поэтому совершенные кристаллы выращивают из хорошо перемешиваемых растворов и расплавов.
Примесь, содержащаяся в маточной среде, входит в состав кристалла. Отношение концентрации примеси в кристалле и в среде называется коэффициентом распределения примеси. Захват примеси зависит от скорости роста. Разные грани захватывают при кристаллизации разные количества примесей. Поэтому кристалл оказывается как бы сложенным из пирамид, имеющих своими основаниями грани кристалла и сходящимися своими вершинами к его центру (рис. 8). Такой секториальный захват примеси вызван различным строением разных граней.
Если кристалл плохо захватывает примесь, то избыток её скапливается перед фронтом роста и растёт. Обогащенный примесью пограничный слой, из которого идёт кристаллизация, не успевает перестраиваться, в результате чего возникает зонарная структура (полосы на рис. 8). Аналогичная картина возникает, если кристалл обогащается примесью, а пограничный слой обедняется.
При росте кристаллов в достаточно больших объёмах (десятки, сотни см 3 и более) перемешивание растворов и расплавов возникает самопроизвольно. В случае раствора слой жидкости вблизи скоро растущих граней обедняется веществом, его плотность уменьшается, что приводит к перемещению вещества вверх (концентрационные потоки). По-разному омывая различные грани, концентрационные потоки изменяют скорости роста граней и облик кристалла. В расплаве из-за нагревания примыкающей к растущему кристаллу жидкости скрытой теплотой кристаллизации возникают конвекционные потоки. Скорость, температура и концентрация примесей в конвекционных потоках хаотически колеблются около средних значений. Соответственно меняются скорость роста и состав растущего кристалла, в теле которого остаются «отпечатки» последовательных положений фронта кристаллизации. Образуется зонарная структура кристалла. В металлических расплавах магнитное поле останавливает конвекцию и уничтожает зонарность.
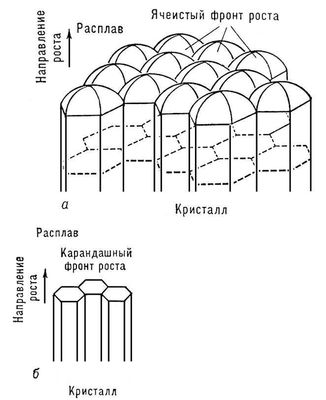
Если расплав перед фронтом роста переохлажден, то выступ, случайно возникший на поверхности, попадает в область большего переохлаждения, скорость роста его вершины увеличивается ещё больше и т. д. В результате плоский фронт роста разбивается на округлые купола, имеющие в плоскости фронта форму полос или шестиугольников,— возникает ячеистая структура (рис. 9, а). Линии сопряжения ячеек (канавки) оставляют в теле растущего кристалла дефектные и обогащенные примесью слои, так что весь кристалл оказывается как бы сложенным из гексагональных палочек или пластинок (карандашная структура; рис. 9, б).
Если в переохлажденном расплаве (растворе) оказывается не плоская поверхность, а маленький кристалл, то выступы на нём развиваются в различных кристаллографических направлениях, отвечающих максимальной скорости роста, и образуют многолучевую звезду. Затем на этих главных отростках появляются боковые ветви, на них — ветви следующего порядка, — возникает дендритная форма кристаллов (рис. 10). Несмотря на причудливую древовидную форму, кристаллографическая ориентация дендритного кристалла одинакова для всех его ветвей. Необходимые условия для развития дендритов у кристаллов, растущих послойно, — большое переохлаждение и плохое перемешивание.
При очень малых скоростях роста кристалла из расплава коэффициент распределения вещества перестаёт зависеть от направления и скорости роста и приближаются к равновесному значению, определяемому диаграммой состояния.
Образование дефектов при кристаллизации. Реальные кристаллы всегда имеют неоднородное распределение примеси (секториальная, зонарная, карандашная структуры). Примесь меняет параметр решётки, и на границах областей разного состава возникают внутренние напряжения. Это приводит к образованию дислокаций и трещин. Дислокации при кристаллизации из расплава возникают и как результат упругих напряжений в неравномерно нагретом кристалле, а также при нарастании более горячих новых слоев на более холодную поверхность. Дислокации могут «наследоваться», переходя из затравки в выращиваемый кристалл.
Посторонние газы, хорошо растворимые в маточной среде, но плохо захватываемые растущим кристаллом, образуют на фронте роста пузырьки, которые захватываются кристаллом, если скорость роста превосходит некоторую критическую. Так же захватываются и посторонние твёрдые частицы из маточной среды, становящиеся затем в кристалле источниками внутренних напряжений.
Массовая кристаллизация — одновременный рост множества кристаллов — широко используется в промышленности. Для получения кристаллов примерно одинаковой величины и формы используются мельчайшие (
0,1 мм) затравочные кристаллы; процесс ведётся в той области температур, где новые зародыши самопроизвольно не возникают.
Спонтанное массовое появление зародышей и их рост происходят при затвердевании отливок металлов. Кристаллы зарождаются прежде всего на охлаждаемых стенках изложницы, куда заливается перегретый металл. Зародыши на стенках ориентированы хаотично, однако в процессе роста «выживают» те из них, у которых направление максимальной скорости роста перпендикулярно к стенке. В результате у поверхности возникает столбчатая зона, состоящая из почти параллельных узких кристаллов, вытянутых вдоль нормали к поверхности. Конвекционные потоки в расплаве могут обламывать ветви дендритов, поставляя новые затравки. Аналогично действует ультразвук, а также добавление порошков, частицы которых служат центрами кристаллизации, и поверхностно-активных веществ, облегчающих образование зародышей.
Лит.: Шубников А. В., Как растут кристаллы, М.— Л., 1935; его же. Образование кристаллов, М.— Л., 1947; Леммлейн Г. Г., Секториальное строение кристаллов, М.— Л., 1948; Кузнецов В. Д., Кристаллы и кристаллизация, М., 1953; Маллин Д ж., Кристаллизация, пер. с англ., М., 1965; Хонигман Б., Рост и форма кристаллов, пер. с нем., М., 1961; Чернов А. А., Слоисто-спиральный рост кристаллов, «Успехи физических наук», 1961, т. 73, в. 2, с. 277; его же, Рост цепей сополимеров и смешанных кристаллов — статистика проб и ошибок, там же, 1970, т. 100, в. 2, с. 277; Матусевич Л. Н., Кристаллизация из растворов в химической промышленности, М., 1968; Палатник Л. С., Папиров И. И., Эпитаксиальные пленки, М., 1971.
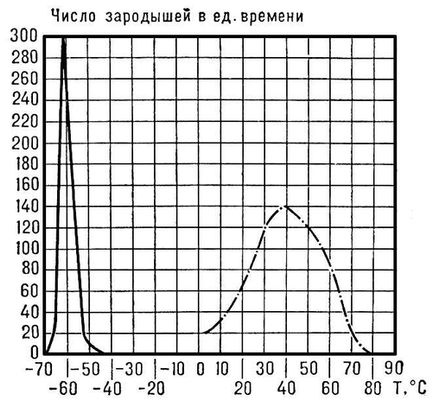
Рис. 2. Сплошная кривая — зависимость числа зародышей кристаллов глицерина, возникающих в 1 см 3 расплава в единицу времени, от температуры; пунктирная кривая — то же для 1,2 см 3 расплава пиперина.
Рис. 8. Зонарное и секториальное строение кристалла алюмокалиевых квасцов.
Рис. 9. а — ячеистая структура; б — карандашная структура.
Рис. 1. Зависимость работы А, требующейся для образования кристаллического агрегата, от размера r зародыша.
Рис. 6. Атомно шероховатая поверхность.
Рис. 5. Характерные положения атома на атомно гладкой поверхности кристалла со ступенями: 1 — в торце ступени; 2 — адсорбция на ступени; 3 — в изломе; 4 — адсорбция на поверхности; 5 — в поверхностном слое кристалла; 6 — двумерный зародыш на атомно гладкой грани.
Рис. 10. Начальная стадия дендритного роста кристалла иодоформа.
Рис. 4. а — схема роста кристалла на винтовой дислокации; б — спиральный рост на грани (100) синтетического алмаза; в — форма ступени при спиральном росте.
Рис. 3. Пластинчатый кристалл паратолуидина в поляризованном свете; каждая линия — ступень на поверхности кристалла. По разные стороны от ступени толщина кристалла, а следовательно, и интенсивность прошедшего света и окраска (в скрещенных николях) различны.
Кристаллизация в чем состоит, метод разделения, типы и примеры
кристаллизация это процесс, в котором твердое тело образуется с атомами или молекулами в организованных структурах, которые называются кристаллическими сетями. Кристаллы и кристаллические сети могут образовываться в результате осаждения раствора, путем синтеза и, в некоторых случаях, путем прямого осаждения газа..
Структура и природа этой кристаллической сети будет зависеть от условий, в которых происходит процесс, включая время, прошедшее до достижения этого нового состояния. Кристаллизация как процесс разделения чрезвычайно полезна, поскольку она позволяет гарантировать, что структуры получаются только из желаемого соединения..
Кроме того, этот процесс гарантирует, что прохождение других частиц не будет разрешено, учитывая упорядоченную природу кристалла, что делает этот метод отличной альтернативой для очистки растворов. Много раз в химии и химическом машиностроении необходимо использовать процесс разделения смешения.
Эта потребность возникает либо для повышения чистоты смеси, либо для получения ее конкретного компонента, и по этой причине существует несколько методов, которые можно использовать в зависимости от фаз, в которых обнаружена эта комбинация веществ..
Из чего состоит кристаллизация??
Кристаллизация требует двух шагов, которые должны произойти, прежде чем может быть образование кристаллической сети: во-первых, должно быть достаточно накопления атомов или молекул на микроскопическом уровне, чтобы началось так называемое зародышеобразование.
Эта стадия кристаллизации может происходить только в переохлажденных жидкостях (т. Е. Охлажденных ниже точки замерзания, не делая их твердыми) или перенасыщенных растворах..
После начала зародышеобразования в системе ядра могут быть сформированы достаточно стабильными и достаточно большими, чтобы начать второй этап кристаллизации: рост кристаллов.
зарождение
На этом первом этапе определяется расположение частиц, которые будут образовывать кристаллы, и наблюдается влияние факторов окружающей среды на образовавшиеся кристаллы; например, время, необходимое для появления первого кристалла, называется временем зарождения.
Существует две стадии нуклеации: первичная и вторичная нуклеация. В первом случае новые ядра образуются, когда в середине нет других кристаллов или когда другие существующие кристаллы не влияют на их образование..
Первичное зародышеобразование может быть гомогенным, при котором нет влияния на часть твердых веществ, присутствующих в среде; или он может быть гетерогенным, когда твердые частицы внешних веществ вызывают увеличение скорости нуклеации, которое обычно не происходит.
При вторичном зародышеобразовании новые кристаллы образуются под воздействием других существующих кристаллов; это может произойти из-за сил резания, которые делают сегменты существующих кристаллов новыми кристаллами, которые также растут с собственной скоростью.
Этот тип зародышеобразования выгоден в системах с высокой энергией или в потоке, где вовлеченная жидкость вызывает столкновения между кристаллами.
Рост кристаллов
Это процесс, в котором кристалл увеличивает свой размер путем агрегации большего количества молекул или ионов в промежуточные положения своей кристаллической сети..
В отличие от жидкостей, кристаллы растут равномерно только тогда, когда молекулы или ионы входят в эти положения, хотя их форма будет зависеть от природы рассматриваемого соединения. Любое неправильное расположение этой структуры называется дефектом кристалла..
Рост кристалла зависит от ряда факторов, среди которых, среди прочего, поверхностное натяжение раствора, давление, температура, относительная скорость кристаллов в растворе и число Рейнольдса..
Кроме того, важно отметить, что с маленькими кристаллами намного сложнее манипулировать, хранить и перемещать, и их фильтрация из раствора стоит дороже, чем более крупные. В подавляющем большинстве случаев самые крупные кристаллы будут наиболее желательными по этим и другим причинам..
Как метод разделения
Необходимость в очистке растворов является общей в химии и химической инженерии, поскольку может возникнуть необходимость в получении продукта, который гомогенно смешан с другими или другими растворенными веществами..
Вот почему было разработано оборудование и методы для проведения кристаллизации как процесса промышленного разделения..
Существуют различные уровни кристаллизации, в зависимости от требований, и могут быть выполнены в небольшом или крупном масштабе. Следовательно, его можно разделить на две основные классификации:
перекристаллизация
Это называется перекристаллизацией в технику, которая используется для очистки химикатов в меньших масштабах, обычно в лаборатории.
Это делается с помощью раствора желаемого соединения вместе с его примесями в подходящем растворителе, стремясь тем самым осаждать в виде кристаллов некоторые из двух частиц, которые впоследствии будут удалены..
Существует несколько способов перекристаллизации растворов, среди которых перекристаллизация с растворителем, с несколькими растворителями или с горячей фильтрацией..
-Единый растворитель
Когда используется один растворитель, для получения насыщенного раствора готовят раствор соединения «А», примеси «В» и минимально необходимого количества растворителя (при высокой температуре)..
Затем раствор охлаждают, что приводит к падению растворимости обоих соединений и перекристаллизации соединения «А» или примеси «В». В идеале желательно, чтобы кристаллы были из чистого соединения «А». Может быть необходимо добавить ядро, чтобы начать этот процесс, который может даже быть осколком стекла.
-Различные растворители
При перекристаллизации нескольких растворителей используют два или более растворителей, и проводят тот же процесс, что и с растворителем. Преимущество этого процесса состоит в том, что соединение или примесь будут осаждаться при добавлении второго растворителя, поскольку они не растворимы в нем. В этом методе перекристаллизации нет необходимости нагревать смесь.
-Горячая фильтрация
Наконец, рекристаллизация с горячей фильтрацией используется, когда есть нерастворимое вещество «С», которое удаляется с помощью высокотемпературного фильтра после выполнения той же процедуры перекристаллизации одного растворителя..
В промышленной сфере
В промышленной области мы хотим осуществить процесс, называемый фракционной кристаллизацией, который представляет собой метод, который очищает вещества в соответствии с их различиями в растворимости..
Эти процессы напоминают процессы перекристаллизации, но используют разные технологии для обработки больших количеств продукта.
Применяются два метода, которые будут лучше объяснены в следующем утверждении: кристаллизация охлаждением и кристаллизация испарением.
Будучи крупномасштабным, этот процесс генерирует отходы, но они обычно рециркулируются системой для обеспечения абсолютной чистоты конечного продукта..
Типы кристаллизации
Как указано выше, существует два типа крупномасштабной кристаллизации: охлаждение и испарение. Также были созданы гибридные системы, где оба явления происходят одновременно.
Кристаллизация при охлаждении
В этом методе раствор охлаждают, чтобы уменьшить растворимость желаемого соединения, заставляя его начать осаждаться с желаемой скоростью..
В химическом машиностроении (или процессах) кристаллизаторы используются в форме резервуаров со смесителями, которые циркулируют хладагенты в отсеках, которые окружают смесь, так что оба вещества не вступают в контакт, пока происходит теплопередача хладагента в раствор..
Для удаления кристаллов используются скребки, которые толкают твердые фрагменты в яму.
Кристаллизация выпариванием
Это еще один вариант достижения осаждения кристаллов растворенного вещества с использованием процесса испарения растворителя (при постоянной температуре, в отличие от предыдущего метода), чтобы концентрация растворенного вещества превышала уровень растворимости..
Наиболее распространенными моделями являются так называемые модели с принудительной циркуляцией, которые удерживают раствор кристаллов в однородной суспензии через резервуар, управляя их потоком и скоростью, и обычно генерируют кристаллы большего размера, чем те, которые образуются при кристаллизации. охлаждением.
примеров
— При добыче соли из морской воды.
— В производстве сахара.
— При образовании сульфата натрия (Na2SW4).
— В фармацевтической промышленности.
— При изготовлении шоколада, мороженого, масла и маргарина, в дополнение ко многим другим продуктам.