Для чего применяется фенол
ФЕНОЛ (PHENOL) ОПИСАНИЕ
Фармакологическое действие
Фармакокинетика
Показания активного вещества ФЕНОЛ
Открыть список кодов МКБ-10
| Код МКБ-10 | Показание |
| A63.0 | Аногенитальные [венерические] бородавки (остроконечные кондиломы) |
| H66 | Гнойный и неуточненный средний отит |
| L01 | Импетиго |
| L08.0 | Пиодермия |
| L73.8 | Другие уточненные болезни фолликулов (сикоз бороды) |
| L73.9 | Болезнь волосяных фолликулов неуточненная |
| Z29.8 | Другие уточненные профилактические меры |
Режим дозирования
Наружно в виде 2% мази: при гнойных заболеваниях кожи после удаления гноя и некротических масс мазь тонким слоем наносят на ограниченные пораженные участки кожи 1-2 раза в день.
При остром неперфоративном гнойном среднем отите (в составе комплексной терапии): 5% раствор фенола в глицерине закапывают по 8-10 кап в теплом виде в слуховой проход на 10 мин (затем удаляют при помощи ваты) 2 раза в сутки в течение 3-4 дней (при отсутствии положительной динамики через 4 дня производят парацентез).
Генитальные остроконечные кондиломы: обрабатывают раствором, состоящим из 60% фенола и 40% трикрезола, с интервалом в 1 нед.
В фармацевтической практике для консервирования лекарственных средств, сывороток, свечей используют 0.5-0.1% растворы.
Для дезинфекции белья используют 1-2% мыльно-фенольные растворы (100-200 г жидкого фенола на 1 ведро воды); белье замачивают и выдерживают в течение 2 ч.
Для дезинсекции применяют фенольно-керосиновые, фенольно-скипидарные смеси.
Побочное действие
Зуд, жжение и/или раздражение кожи в месте аппликации, аллергические реакции.
Противопоказания к применению
Применение при беременности и кормлении грудью
Противопоказан при беременности, в период лактации.
Применение у детей
Особые указания
При при попадании большого количества вещества на кожу наблюдаются жжение, гиперемия, анестезия пораженного участка. Лечение: обработка кожи тампоном с растительным маслом или полиэтиленгликолем (нельзя использовать вазелиновое масло), симптоматическая терапия.
Нельзя обрабатывать обширные участки тела.
Рекомендуется предварительно механически очистить сильнозагрязненные обеззараживаемые предметы, поскольку фенол адсорбирует органические соединения и при этом снижается его бактерицидная активность. Обеззараживаемые предметы длительное время сохраняют запах фенола. Не применяют для дезинфекции помещений, используемых для приготовления и хранения пищевых продуктов и кухонной посуды. Не портит ткани, не меняет их окраску. При нанесении на поверхности, покрытые лаком, вызывает их изменение.
Что такое фенол? Свойства и применение
Фенол – это самое простое соединение из класса фенолов, производное аренов, в молекуле которого непосредственно реализуется связь гидроксильных групп и бензольного кольца. По сути, это слабая кислота, что и есть главным отличием между фенолами и спиртами, являющимися неэлектролитами. Выпускается мировой промышленностью в миллионах тонн ежегодно. По объемах среди всех химических веществ занимает 33 место, среди органических – 17. Характеризуется токсичностью и достаточно большой едкостью, способно обжигать кожу и выступает мощным ирритантом. Может выполнять роль антисептика в виде 5 %-го водного раствора, и не просто может, а выполняет и активно с этой целью используется в медицине.
Названия-синонимы: гидроксибензол, карболовая кислота (устар.).
Свойства
Выглядит это вещество как бесцветная прозрачная твердая масса, сформированная игольчатыми кристаллами. Запах – специфический, у большинства ассоциируется с запахом гуаши, так как в ее составе присутствует фенол.
Растворяется в воде в стандартных условиях ограниченно: в соотношении 6,5 г на 100 мл. При температуре 66 °C и более смешивается с H2O в различных пропорциях. Именно к водным растворам чаще используют наименование «кислота карболовая». Кроме того, растворению поддается в щелочах, спиртах, бензене и диметилкетоне.
Пребывая на воздухе, данное соединение окисляется и приобретает розоватый окрас. Появление цветных компонентов объясняется промежуточным формированием хинонов.
Молярная масса – 94,11 г/моль, плотность – 1,07 г/см³. Термосвойства: t плавления – 40,9 °C, t кипения – 181,84 °C, t вспышки – 79/85 °C (в закрытом и открытом тигле, соответственно). Формула: C6H5OH.
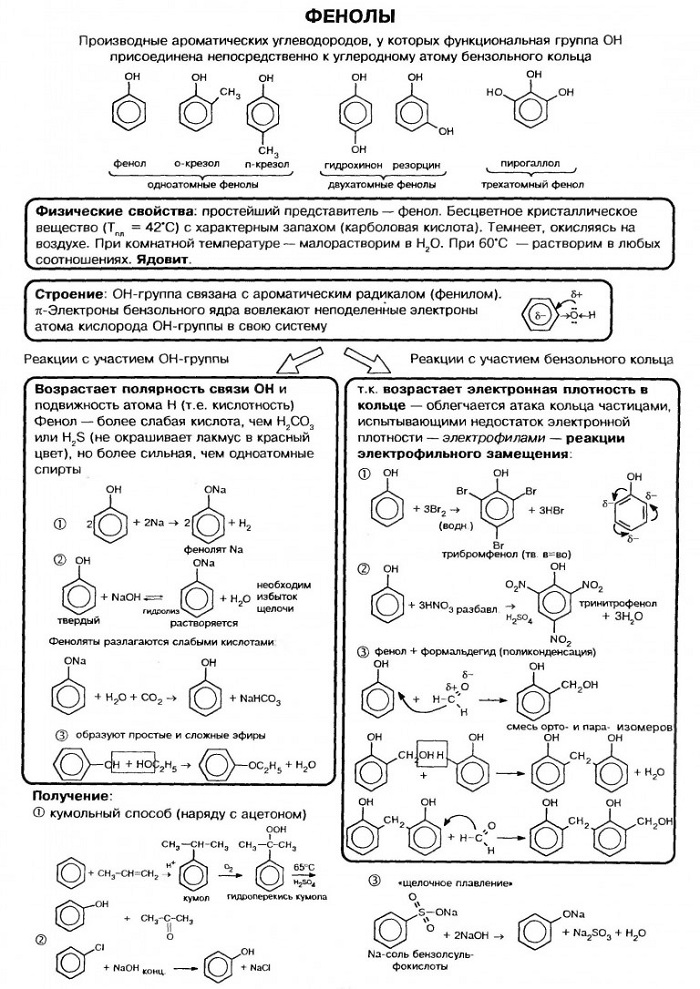
Химическим свойствам гидроксибензола характерна двуплановость. С одной стороны, у них присутствует ароматическое кольцо, с другой – гидроксильная группа. Поэтому фенол обладает свойствами и спиртов, и аренов:
— по гидроксильной группе. Небольшие кислотные качества (сильнее, по сравнению со спиртами). Формирование солей, именуемых фенолятами, в частности натрия фенолята, при воздействии щелочей. В виду очень слабых свойств кислоты, из фенолятов ее может вытеснить даже угольная к-та. А более интенсивное разложение фенолятов характерно при влиянии сильных кислот, к примеру, H2SO4 (сульфатной кислоты).
Кроме того, C6H5OH реагирует с металлическим натрием. Этерификации карбоновыми кислотами не поддается. Для получения эфиров может задействоваться реакция между фенолятами и ангидридами/галогенангидридами кислот.
Этеры появляются тогда, когда на фенол воздействуют алкилгалогениды, либо же на феноляты – галогенпроизводные ароматических углеводородов. Итог первого варианта воздействия – сочетания жирных ароматических простых эфиров, второго – чисто-ароматические эфиры. Для обеспечения реакции необходимо присутствие катализатора, которым выступает медь в форме порошка.
Перегонка совокупности «фенол + цинковая пыль» приводит к тому, что гидроксильную группу замещает водород.
— по ароматическому кольцу. Данному соединению свойственно вступление в реакции электрофильного замещения. Оно легко поддается таким воздействиям, как алкилирование, ацилирование, галогенирование, нитрование и сульфирование.
В этом ракурсе стоит упомянуть также реагирование с водным раствором брома, хлорным железом (качественные реакции на гидроксибензол) и концентрированной HNO3 (нитратной кислотой).
Гидрируя фенол в ходе присоединительной реакции и при условии наличия катализирующих металлических компонентов, создают гексалин и циклогексанон.
Что касается окисления карболовой кислоты, то так как в фенольной молекуле присутствует гидроксильная группа, стойкость к окислению значительно слабее, по сравнению с бензолом. Продукт на выходе зависит от природы окисляющего материала и условий, при которых проводилась реакция.
Получение
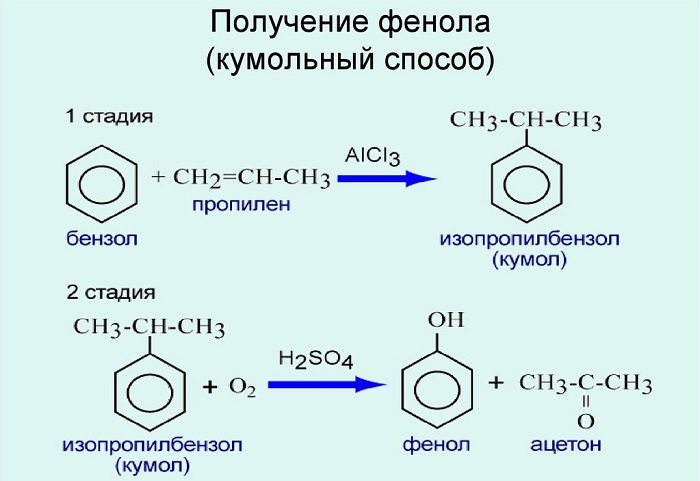
На сегодняшний день пром. изготовление фенола происходит 3-мя способами:
— кумол (изопропилбензол) помещают в каскад барботажных колонн и выполняют некаталитическое окисление с помощью воздуха, при этом формируется гидропероксид кумола (2-гидроксипропан-2-илбензол);
— полученный ГПК при воздействии H2SO4 катализируется и разлагается на фенол и диметилкетон.
Кстати, в ходе данного процесса в качестве побочного продукта выделяется еще одно ценное вещество, а именно α-метилстирол (изопренилбензол).
Кстати, сейчас подвергаются испытаниям установки, с помощью которых предполагается синтез фенола в ходе прямого окисления бензола оксид диазотом и кислотного разложения гидропероксида втор-бутилбензола. Кроме того, это вещество может быть получено при восстановлении хинона.
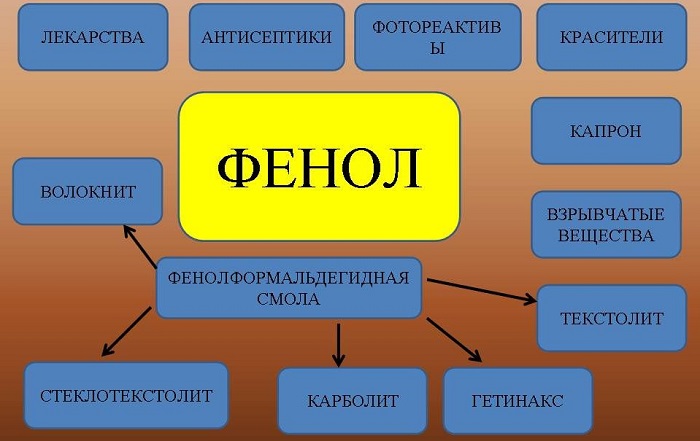
Применение
Рассматриваемый материал имеет очень широкий спектр использования. Без него не обходятся в разноплановых процессах, о которых не помешает знать.
Фенол – это соединение, которое было выведено искусственным путем. Ему характерна низкая t плавления, растворение в средах и органической, и неорганической природы. Оно – ценная основа для создания различных материалов, важных в пром. масштабах. Ввиду антисептических свойств, применяется для дезинфекционных мероприятий, направленных на белье, помещения и т.д. Но если раньше для этих целей вещество использовалось активно, то сегодня его задействование ограничено, из-за высокотоксичности.
Сферы применения фенола:
— изготовление красителей (указанную субстанцию берут для этого направления, поскольку она под влиянием воздуха способна менять свой окрас);
— производство пластических масс, а именно фенолформальдегидных смол и ДФП, используемого, в свою очередь, при создании поликарбонатов и эпоксидных смол;
— переработка нефти (селективное маслоочищение, очистка ортокрезола и создание присадок для масел). Фенол характеризуется значительной эффективностью, если нужно удалить смолистые вещества, серосодержащие соединения и прочее из масел;
— молекулярная биология и генная инженерия (участие в очищении ДНК и в выделении ДНК из клетки совместно с метилтрихлоридом);
— медицина и фармацевтика, а именно создание популярных и востребованных медикаментов, в частности производных фенольной к-ты. Это, прежде всего, аспирин, или ацетилсалициловая кислота – средство для понижения жара. Это также салол – дезинфицирующий препарат, используемый при болезнях кишечника и мочевой системы. Это и ПАСК, показанная при туберкулезе, и хорошо известный пурген (фенолфталеин) – лекарство со слабительным эффектом, и орасепт – препарат для обезболивания и антисептической обработки;
— химия, а если быть точнее, то производство искусственного волокна, в частности капрона и нейлона;
— легкая промышленность (дезинфекционная обработка шкур животных в составе кожно-меховых дубителей);
— производство пластифицирующих составов для полимеров;
— парфюмерная отрасль (изготовление парфюмерии);
— косметология (задействуется как средство для глубокого хим. пилинга);
— аналитическая химия (служит реагентом);
— обработка с/х насаждений (выступает защитным средством для растений, входит в состав пестицидов);
— скотоводство (дезинфекционные мероприятия, направленные на животных).
Раньше фенол активно использовали при изготовлении стройматериалов, товаров бытового назначения, пластика для различных изделий, в том числе игрушек. Сегодня же это либо максимально сокращено, либо вообще запрещено, ввиду опасного воздействия на человеческий организм, в частности на нервную систему, сердце и сосуды, почки и печень, а также на иные внутренние органы. Хотя до сих пор есть производители, которые, не смотря на все запреты и ограничения, используют фенол даже при создании игрушек для детей.
На заметку! Фенол как отдельное соединение используется в разных сферах, но еще в больших объемах в работу берутся его различные производные.
Опасность фенола
Данный реактив токсичен (принадлежит ко 2-му классу опасности хим. продуктов), является одним из пром. загрязнителей, способен наносить вред людям и животным. Кроме того, губительно воздействует на большое число микроорганизмов, как результат – биоочистка промышленных стоков, содержащих много фенола, сопровождается немалыми сложностями.
Контактируя с кожей, не только обжигает (а ожоги после могут еще и трансформироваться в язвы), но и всасывается внутрь, провоцируя отравления и пагубное воздействие на головной мозг. Попадая в организм сквозь органы дыхания, раздражает и опять же обжигает. Если площадь хим. ожога будет составлять 25 % и более, не исключен летальный исход.
Негативное воздействие фенола на организм может заключаться также в следующем: кашле, чихании, мигренях и головокружениях, побледнении, тошноте, потере сил, мышечной атрофии, язве желудка и двенадцатиперстной кишки.
Это не значит, что указанное вещество следует полностью вычеркнуть из жизни. Нужно правильно с ним обращаться, чтобы минимизировать риски, и тогда эффект, который с его помощью можно получить, порадует во всех смыслах. Используйте фенол правильно, соблюдая нормы, правила и технику безопасности, чтобы ни вам, ни другим людям, ни окружающей среде не было нанесено ни малейшего вреда.
Фенол
Историческая справка
Фенол был открыт Фридлибом Фердинандом Рунге в 1834 году при перегонке каменноугольной смолы. Он назвал ее карболовой кислотой или угольной кислотой (карбон = уголь, олеум = масло) из-за ее кислотного действия в водном растворе.
Первое значительное применение фенола принадлежит английскому хирургу Джозефу Листеру (1827-1921). Листера вдохновила микробная теория болезней Луи Пастера (1822–1895) и он начал использовать антисептические методы во время своих операций в 1860-х годах. В своей борьбе с раневыми инфекциями, которые часто возникали после операций, он применил так называемую «карболовую повязку» в 1865 году. Это позволило ему в значительной степени предотвратить серьезные и опасные для жизни нагноения хирургических ран. Листер также разработал основы больничной гигиены. Частое мытье рук врачами и медперсоналом раствором фенола и использование резиновых перчаток дали прекрасные результаты и смертность пациентов резко упала. В истории медицины Листер считается «отцом антисептики».
В молекулярной биологии экстракция органических тканей смесями фенола, хлороформа и изоамилового спирта была одним из первых методов получения ДНК высокой чистоты.
Производство фенола
Есть три важных технических процесса для синтеза фенола:
Характеристики и свойства фенола
Фенол (гидроксибензол) — самый простой представитель класса фенолов. Фенол токсичен и редко встречается в природе в чистом виде, и поэтому в основном производится синтетическим путем. Содержится в каменноугольной смоле, которая образуется при дегазации угля (коксовании), в небольших количествах в древесине сосны и хвое.
Фенолы формально являются производными бензола. Его основная структура представляет собой ароматическое бензольное кольцо, в котором один или несколько атомов водорода бензола замещены гидроксильной группой. В воде фенол слабо диссоциирует на протоны и фенолят-анион. Это также объясняет хорошую растворимость фенола в разбавленном щелоке.
Фенол ядовит, образует бесцветные кристаллические иглы, которые на воздухе становятся красноватыми и постепенно растворяются. Молярная масса 94,1 г / моль. Плавится при 43 C, кипит при 182 C и имеет плотность 1,132 (при 25 С). Обладает характерным резким запахом. Очень хорошо растворяется в эфире, хлороформе, эфирных маслах и спирте, умеренно в бензоле и воде и очень трудно в алифатических углеводородах.
Токсичность фенола основана на его повреждающем действии на протоплазму клеток. Из-за этого бактерицидного свойства фенол или растворы, содержащие фенол (макс. 5% фенола), ранее использовались в качестве дезинфицирующих средств в хирургии.
В отличие от спиртов фенол реагирует характерным образом с разбавленным раствором хлорида железа (III). Раствор становится сине-фиолетовым. Эта цветная реакция используется в качестве доказательства присутствия фенола. Фенол можно заставить реагировать со многими другими соединениями, и поэтому он является важным исходным материалом в синтетической органической химии.
В отличие от алифатических спиртов фенолы не подвергаются реакциям нуклеофильного замещения с заменой гидроксильной группы другими нуклеофилами. Из-за электронодонорной природы гидроксигруппы фенол примерно в тысячу раз более активен, чем бензол.
Порог запаха в воздухе составляет 0,04 частей на миллион, а в воде — 7,9 частей на миллион.
Соли фенола
При взаимодействии с щелочными металлами образуются феноляты (соли). Феноляты (в отличие от алкоголятов) достаточно устойчивы в воде. Кроме того, в ароматическом кольце могут протекать реакции с образованием различных производных фенола.
Одним из примеров является образование салициловой кислоты (2-гидроксибензойной кислоты) в результате реакции фенола с диоксидом углерода при интенсивном нагревании. Салициловая кислота является промежуточным продуктом для производства известного лекарственного препарата аспирин (ацетилсалициловая кислота), в котором фенольная гидроксильная группа все еще ацетилирована.
Производные фенола
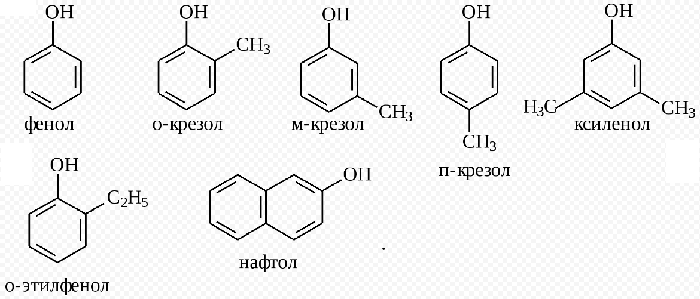
Важное значение имеют не только сам фенол, но и его производные. Это соединения, которые имеют другие функциональные группы в ароматическом кольце помимо группы ОН, такие как уже упомянутая салициловая кислота.
Эти вещества (например, ванилин) как правило, имеют довольно приятный запах и широко распространены в природе. Их используют в парфюмерной промышленности в качестве ароматизаторов.
Многоатомные фенолы
Содержание в продуктах
Применение
В настоящее время фенол преимущественно используется для изготовления фенольных смол, которые находят самое широкое применение в строительной отрасли. Они используются в качестве связующих веществ и наполнителей в деревянных изделиях, таких как фанера, ДСП, мебель и панели. Феноловые смолы пропитываются бумагой, которая после затвердевания дает листы, которые можно склеивать, чтобы сформировать ламинат для использования в стеновых панелях и столешницах.
Как мощный бактерицид, фенол можно найти во многих потребительских товарах, включая жидкости для полоскания рта, антисептические мази, леденцы для горла, освежители воздуха, ушные капли и бальзамы для губ.
Фенол продолжает оставаться основным химическим веществом, используемым для производства термореактивных смол. Эти смолы производятся путем объединения фенола с альдегидами, такими как формальдегид.
Помимо строительной промышленности, фенол находит множество других применений. Он используется в фармацевтике, в гербицидах, пестицидах и красках. Его можно использовать для производства капролактама, который является мономером, используемым при производстве нейлона. Другим важным промышленным соединением, получаемым из фенола, является бисфенол А, который производится из фенола и ацетона. Бисфенол А используется при производстве поликарбонатных смол, для дпльнейшего использования в различных продуктах, таких как автомобильные детали, электротехнические изделия и потребительские товары: компакт-диски, очки для чтения, солнцезащитные очки и бутылки с водой.
Фенол используется для производства множества органических соединений, таких как пирокатехин, резорцин, анилин, салициловая кислота, пикриновая кислота, адипиновая кислота, пластмасс, фенольных смол, фенолфталеина (индикатор), пикриновой кислоты, фармацевтических препаратов, инсектицидов, консервантов для древесины, взрывчатых веществ, дубильных веществ и многого другого.
Широко используется в качестве дезинфицирующего средства в нефтяной, кожевенной, бумажной, мыльной, игрушечной, кожевенной, красильной и сельскохозяйственной промышленности.
В микроскопии он используется для производства фенольной воды, состоящей из десяти частей фенола и одной части воды.
Опасность для здоровья
Фенол очень токсичен: вероятная летальная доза при пероральном приеме (для человека) составляет 50-500 мг / кг. Проглатывание всего 1 грамма уже является смертельной дозой. Люди, страдающие заболеваниями печени или почек, подвергаются большему риску.
Фенол очень быстро всасывается через поверхность кожи, легких и желудка. Симптомы отравления включают, помимо прочего, рвоту, затруднение глотания, диарею, отсутствие аппетита, головную боль, обмороки, головокружение, психические расстройства и кожную сыпь. Прямой контакт с фенолом вызывает жжение во рту, раздражение глаз, носа и дерматит, изменение цвета кожи и повреждение печени и почек. Известно, что воздействие фенола в различных концентрациях вызывает психические расстройства, угнетение ЦНС и кому.
Фенол раздражает кожу, но обладает местным анестезирующим действием, поэтому при первом контакте с ним боль не ощущается. Обычно происходит побеление области контакта, а позже могут развиться тяжелые ожоги. Фенол быстро всасывается через кожу, и токсичные или даже смертельные количества могут абсорбироваться через относительно небольшие участки. Воздействие паров фенола может вызвать сильное раздражение глаз, носа, горла и дыхательных путей.
Острое воздействие может привести к тошноте, рвоте, мышечной слабости и коме. Попадание фенола в глаза может вызвать серьезные повреждения и, возможно, слепоту.
Исследования на животных показали, что фенол может быть репродуктивным токсином.
Абсорбция фенола через неповрежденную кожу, как определено по уровням фенола в крови у подопытных животных, зависела от поверхности нанесения, а не от его концентрации в исследуемых растворах. Животные (свиньи) проявляли признаки подергивания и тремора в течение нескольких минут после нанесения, за которыми следовало слюноотделение, выделения из носа и затрудненное дыхание.
Пожароопасность
Фенол — твердое горючее вещество. При нагревании фенол выделяет пары, которые являются взрывоопасными при концентрации от 3 до 10% в воздухе. Для тушения фенольных пожаров следует использовать углекислотные или сухие химические огнетушители, т.к. сток воды для пожаротушения может выделять ядовитые газы и вызывать загрязнение.
Фенолы – органические соединения. Они в небольших количествах есть в природе. Основную массу фенола и производных на его основе получают синтетическим путём.
Что такое фенол
К фенолам относят производные ароматических углеводородов, в молекулах которых гидроксильные группы связаны с фенил радикалом. Они могут иметь одну или несколько гидроксогрупп.
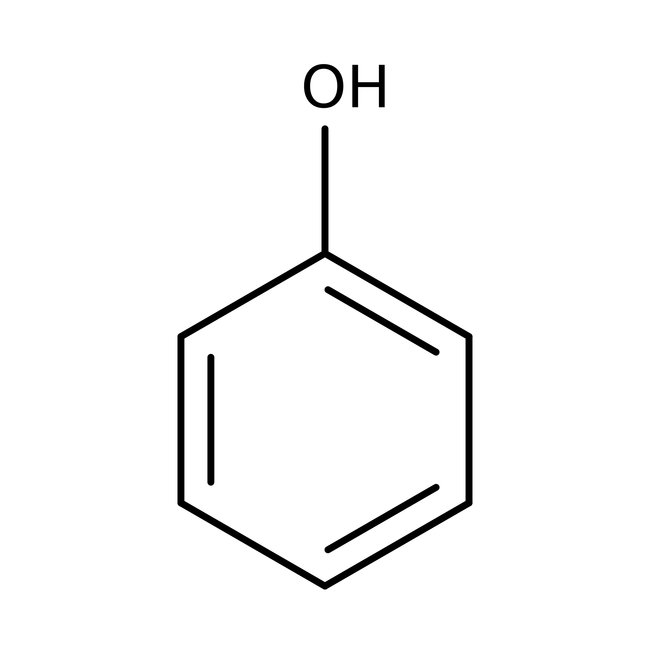
Самым простым представителем этой группы соединений считают фенол. Он и дал название классу веществ. Это же соединение называют гидроксибензолом.
Общая и структурная формулы
Простейший представитель класса имеет 1 гидроксогруппу. Его молекулярная формула С6Н5ОН. Структурная формула — ОН.
Если в молекуле фенола 1 атом водорода заместить на метильный радикал, получим метилфенол. Если к нему прибавить ещё одно бензольное ядро, получим нафтол.
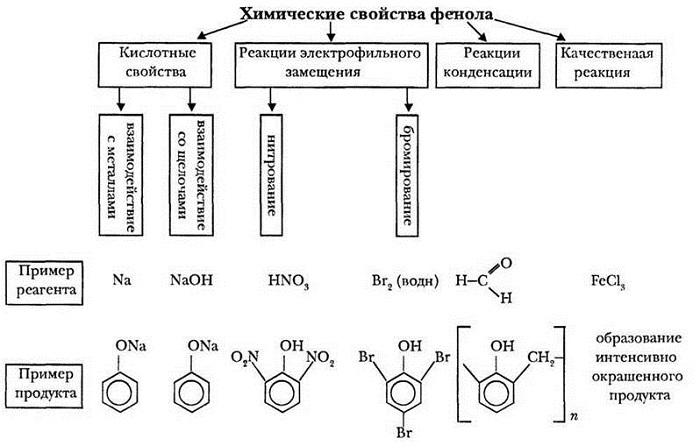
Химические свойства фенола
Так как гидроксибензол содержит в своём составе 2 группы атомов, выделяют две группы химических свойств.
Свойства, идущие за счет фенил радикала:
Свойства, протекающие за счёт гидроксильной группы (кислотные свойства):
взаимодействие с активными металлами;
взаимодействие со щелочами.
Не следует понимать, что фенол, имея в своем составе черты строения бензола и спиртов, просто повторяет их свойства. На самом деле все сложнее. Чтобы понять особенность его химических взаимодействий, необходимо знать строение вещества. В молекуле фенола наблюдается взаимное влияние атомов.
На атоме кислорода гидроксильной группы есть 2 неподелённые электронные пары. Они взаимодействуют с π – электронной системой фенил радикала.
Результат взаимодействия следующий:
Нарушается равномерное распределение электронной плотности в фенил радикале. Она возрастает на атомах 2,4,6, то есть в орто– и параположениях. Именно в этих положениях водород будет легко замещаться на другие атомы.
Атом водорода гидроксогруппы, из-за влияния фенил радикала, приобретает положительный заряд и становится более подвижным.
Результатом влияния служат своеобразные свойства фенола. Он реагирует с активными металлами и щелочами. Спирты – только с металлами. В то же время и бензол, и гидроксибензол реагируют с бромной водой. Но у фенола, в отличие от бензола, идет замещение сразу по 3 атомам.
Физические свойства
С6Н5ОН – это белое кристаллическое вещество. В результате окисления кристаллы могут приобретать розовый цвет. Температура плавления 40,9 0 С. Молярная масса 94 г/моль.
В холодной воде фенол является малорастворимым веществом. При температуре выше +70 0 С растворяется хорошо. Карболовая кислота – так называют водный раствор фенола. Лучше растворяется в органических растворителях.
Отличается характерным резким запахом. Вещество ядовито. Проникая в организм человека, вызывает тяжёлое отравление.
С чем реагирует фенол
Гидроксибензол вступает в реакцию с активными металлами. С натрием даёт фенолят натрия. Уравнение выглядит следующим образом:
В реакциях со щелочами также образует феноляты. Реагируя с гидроксидом калия, образует фенолят калия:
Взаимодействуя со спиртами, образует эфиры. Например, в реакции с бутанолом, получают простой эфир:
Из свойств, протекающих за счёт фенил радикала, можно отметить реакцию нитрования. Взаимодействие с HNO3 даёт 2,4,6 тринитрофенол (пикриновую кислоту):
Реагируя с формальдегидом, фенол образует фенолформальдегидную смолу. Это реакция поликонденсации – получение высокомолекулярного вещества из низкомолекулярных веществ с отщеплением побочного продукта. В данном случае – это вода.
Качественные реакции на фенол
К качественным реакциям относят взаимодействие с бромной водой. В результате получают осадок белого цвета:
Ещё одной качественной реакцией является взаимодействие с хлоридом железа(III). Получается фиолетовое окрашивание. Качественные реакции позволяют разделить и определить органические вещества.
Реакция присоединения
К реакциям присоединения относят гидрирование ароматического ядра. Гидрирование – это реакции присоединения водорода. Превращение протекает легко, в присутствии катализатора. В результате разрушается π – электронная система, образуется циклогексанол и циклогексанон:
Окисление
Фенол не устойчив к окислению. Продукты реакции могут быть разными. Это зависит от самого окислителя и от условий, в которых протекает реакция. При окислении перекисью водорода получается двухатомный фенол:
К реакции окисления относят и реакцию горения. Образуется углекислый газ и вода.
Получение фенола
Фенол в небольшом количестве содержится в каменноугольной смоле. Но потребности в веществе настолько велики, что этого источника недостаточно.
Разработаны разные способы получения:
Используют для получения бензол и пропилен, в результате чего получают кумол. Затем кумол окисляют, в результате получают ценные продукты – фенол, ацетон.
Применение
Вещество применяют для производства разнообразной продукции:
фенолформальдегидных смол и пластмасс;
раствор фенола в воде обладает антисептическими свойствами;
искусственных волокон и другой продукции.
Заключение
Фенол и фенольные соединения – очень важная группа веществ. Не следует забывать, что многие из них являются ядами. Все отходы промышленности, содержащие вещество, тщательно очищаются. Их подвергают каталитическому окислению, обработке озоном и другим способам очистки.