Большое количество митозов в опухоли что это значит
Изучение количества митозов в опухоли
Хорошо подготовленный патолог может определить при просмотре срезов, окрашенных гематоксилин-эозином, фигуры митоза и вычислить индекс митотической активности. Многие исследователи считают, что индекс митотической активности является наиболее важным прогностическим показателем РМЖ [25]. I. Jannink и соавторы утверждают, что классическая техника определения индекса митотической активности остается быстрым, простым и наиболее точным методом. Фигуры митоза подсчитывают в большом количестве клеток по периферии опухоли, в наиболее пролиферирующем участке, избегая зон воспаления, некрозов, кальфикации, карцином in situ и крупных сосудов. Индекс митотической активности определяют подсчетом митозов в десяти полях зрения, начиная с зон наивысшей их плотности при х 400 с диаметром поля зрения 0,45 или 0,16 мм 2 [26]. Однако возникают сложности при изучении опухоли с большим количеством стромы, выраженном полиморфизме опухолевых клеток с наличием крупных аномальных ядер и опухоли, содержащей значительное количество клеток в состоянии апоптоза. Очень сложно подсчитать фигуры митоза в опухоли с незначительной митотической активностью. Этот метод подвергался критике в связи с тем, что подобный подсчет субъективный. Кроме того, запоздалая фиксация может привести к потере митотических фигур [21, 25, 26].
Однако Р.J. van Diest и соавторы показали, что жесткое соблюдение критериев подсчета индекса митотической активности приводит к высокой точности исследования.
Однако преимуществом иммуногистохимичского метода является то, что антитела к белкам, участвующим в митотическом цикле, позволяют дифференцировать клетки в состоянии митоза и не окрашивают клетки в состоянии апоптоза.
Большое количество митозов в опухоли что это значит
Цель исследования, исходя из вышеизложенного, ‒ определить клинико-морфологические и молекулярно-биологические характеристики ЛМС тела матки с большим количеством многоядерных клеток в своем составе и прогноз больных с таким типом неоплазии.
Материалы и методы исследования
Результаты исследования и их обсуждение
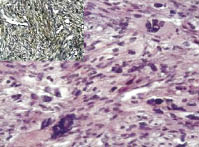
Рис. 1. Лейомиосаркома с большим
количеством многоядерных клеток, степень злокачественности G1. Окраска гематоксилин и эозин; ув. х200; в левом верхнем углу
позитивная иммуногистохимическая
реакция к SMA
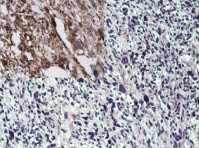
Рис. 2. Лейомиосаркома с большим
количеством многоядерных клеток, степень злокачественности G2. Окраска гематоксилин и эозин; ув. х100; в левом верхнем углу
позитивная иммуногистохимическая
реакция к SMA
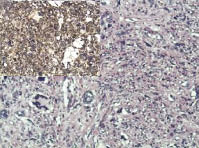
Рис. 3. Лейомиосаркома с большим
количеством многоядерных клеток, степень злокачественности G3. Сложно
дифференцировать с фиброзной
гистиоцитомой. Окраска гематоксилин
и эозин; ув. х200; в левом верхнем углу
позитивная иммуногистохимическая
реакция к SMA
Сравнительные молекулярно-биологические характеристики лейомиосаркомы тела матки и 10-летняя выживаемость при гистологической форме веретеноклеточной
лейомиосаркомы и с большим количеством многоядерных клеток
Современная лучевая диагностика, тактика ведения неорганных забрюшинных опухолей
Журнал «SonoAce Ultrasound»
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Введение
Забрюшинное пространство ограничено спереди задним листком брюшины, сзади – позвоночным столбом и мышцами спины, сверху – диафрагмой, снизу – мышцами тазового дна, латерально – мышцами брюшной стенки от уровня передней верхней ости гребня подвздошной кости до переднего конца XII ребра. В этом потенциально большом пространстве опухоли достигают значительных размеров, прежде чем приводят к возникновению каких-либо клинических проявлений, что обусловливает неблагоприятный прогноз злокачественных забрюшинных опухолей.
Неорганные забрюшинные опухоли (НЗО) являются достаточно редкими и встречаются менее чем в 1% случаев среди всех новообразований человека. Данные опухоли относятся к первичным, развивающимся из ретикулярной, жировой и соединительной тканей, фасций, мышц, кровеносных и лимфатических сосудов, лимфатических узлов, расположенных забрюшинно. Метастатические поражения забрюшинных лимфатических узлов, а также образования, органная принадлежность которых определена, не относятся к НЗО [1, 5, 8, 9].
В основном данная группа образований развивается у людей в возрасте от 40 до 60 лет. Наиболее часто встречается среди женщин.
Злокачественный характер образования носят в 60–85% случаев. Одной из особенностей данных опухолей является склонность к рецидивированию, которая, в свою очередь, может достигать 55%, при этом метастазирование имеет место лишь в 33% случаев. Наиболее часто НЗО метастазируют в легкие, печень, значительно реже – в лимфатические узлы, яичники [1, 2, 16].
Случаи малигнизации доброкачественного образования составляют, по данным литературы, менее 1% случаев.
Этиология забрюшинных опухолей мало изучена. К факторам, предрасполагающим к развитию данной группы новообразований, относят воздействие ионизирующего излучения, подтверждением чего служат случаи развития опухолей у пациентов, которым проводилась лучевая терапия по поводу других заболеваний.
В последние десятилетия опубликованы работы, связывающие возникновение сарком, в частности забрюшинного пространства, с использованием в сельском хозяйстве пестицидов и гербицидов.
Классификация
В клинической практике применяются несколько морфологических классификаций НЗО, но чаще всего используется классификация американского врача Лорена Акермана, предложенная в 1954 г. Данная классификация до сих пор сохраняет свою актуальность.
Забрюшинные неорганные новообразования представляют собой гетерогенную группу опухолей, которые подразделяют в зависимости от микроскопических признаков, степени дифференцировки тканей и биологического потенциала.
В целом гистогенетически забрюшинные опухоли можно разделить на три основные группы (внутри которых различают доброкачественные и злокачественные):
Из симпатической нервной системы могут развиваться ганглионевромы, симпатикобластомы или нейробластомы.
Основную массу забрюшинных опухолей составляют первые две группы. Наиболее часто встречаются липосаркома (41%), лейомиосаркома (28%), злокачественная фиброзная гистиоцитома (7%), фибросаркома (6%) [6, 14].
Гистологическая верификация
Клиническое течение забрюшинных опухолей характеризуется большим разнообразием и зависит не только от гистологического строения, но и от степени дифференцировки клеток. Параметрами, определяющими степень дифференцировки новообразования, являются клеточное строение, плеоморфизм клеток, митотическая активность, наличие некрозов и характер роста (экспансивный или инвазивный). Наибольшее значение имеют количество митозов и распространенность некрозов. В соответствии с одной из классификаций принято различать I степень (высокодифференцированные опухоли), II степень (умеренно дифференцированные опухоли) и III степень дифференцировки (низкодифференцированные опухоли). Для наиболее часто используемой четырехуровневой характеристики степени дифференцировки опухоли характерны минимальные отличия между опухолями высокой (I и II степени) и низкой (III и IV степени) дифференцировок. С практической точки зрения оправдана бинарная система, при которой все забрюшинные саркомы делят на опухоли низкой и высокой степени дифференцировки. К первым относятся агрессивные опухоли с высокой частотой развития метастазов [1, 12, 16].
Таким образом, для оценки прогноза заболевания, кроме гистологического типа, имеют значение степень дифференцировки и стадия развития опухоли.
Клиническая картина
Из-за анатомических особенностей забрюшинного пространства опухоль может никак не проявлять себя, пока не достигнет больших размеров. Близлежащие органы не являются препятствием для быстрого роста образования, а рыхлая структура клетчатки забрюшинного пространства позволяет опухолевому процессу беспрепятственно распространяться.
Клинические проявления НЗО характеризуются рядом особенностей. Опухоли не имеют патогномоничных признаков и проявляются обычно симптомами поражения различных органов, нервных стволов и сосудов, вовлекаемых в процесс вторично. Большое разнообразие клинических признаков заболевания объясняется тем, что данные опухоли могут располагаться в забрюшинном пространстве от диафрагмы до малого таза. Именно локализация и размеры новообразования обусловливают те или иные клинические симптомы.
Обнаруживаются опухоли, как правило, случайно. Образования большого размера определяются при осмотре и пальпации больного.
Характер боли тесно связан с местом локализации НЗО. Больные предъявляют жалобы на частые боли в области живота, различные диспепсические расстройства: тошноту, рвоту, задержку стула, вздутие живота. При расположении образования в области таза могут наблюдаться симптомы, характерные для нарушения функции нижних мочевых путей: затруднение, учащение мочеиспускания, императивные (трудно сдерживаемые) позывы к мочеиспусканию, императивное недержание мочи, в поздних стадиях отмечаются гематурия, боли, усиливающиеся при наполнении мочевого пузыря. В свою очередь компрессия магистральных кровеносных и лимфатических сосудов приводит к одышке, отеку и увеличению нижней конечности на поражённой стороне. Более поздние стадии заболевания характеризуются развитием признаков интоксикации: слабость, снижение массы тела, необъяснимый субфебрилитет. Неврологические синдромы, обусловленные компрессией нервных стволов, наблюдаются примерно у 25–30% [2, 7].
Характерной особенностью злокачественных НЗО является высокая склонность к рецидивированию при низком метастатическом потенциале опухоли. Чаще всего метастазируют дизэмбриогенетические опухоли (тератомы, хордомы), реже – гладкомышечные, нейрогенные и ангиогенные саркомы.
Диагностика неорганных забрюшинных опухолей
Диагностика НЗО основывается на данных физикального осмотра, лабораторных и инструментальных методов [7, 9, 13].
Первый этап включает тщательный сбор анамнеза, осмотр и пальпацию. При осмотре больного следует обратить внимание на форму живота, объем нижних конечностей, наличие расширенных вен семенных канатиков с обеих сторон. Все эти симптомы не являются специфичными для НЗО и могут лишь дать основание заподозрить наличие образования, расположенного забрюшинно. НЗО, локализующиеся в малом тазу, характеризуются рядом особенностей, что даtт основание выделять их в группу “тазовых внеорганных забрюшинных опухолей”. Эти опухоли чаще недоступны пальпации через переднюю брюшную стенку и определяются лишь при вагинальном или ректальном исследовании.
Лабораторные методы. Из лабораторных методов исследования наибольшее значение имеет определение уровня человеческого хорионического гонадотропина и α-фетопротеина для идентификации первичной герминогенной опухоли забрюшинного пространства.
Компьютерная томография и магнитно-резонансная томография. КТ и МРТ являются наиболее ценными методами исследования в диагностике забрюшинных опухолей, позволяющими не только уточнить локализацию опухоли, точные размеры новообразования и соотношение его с окружающими тканями, но и выявить метастатические очаги в печени и брюшной полости. Смещение забрюшинно расположенных органов кпереди позволит более точно определить локализацию образования. При этом необходимо исключить его органное происхождение, чему способствует правильная интерпретация ряда признаков. К таким признакам относятся: характер деформации органа, признак фантомного органа (если опухоль исходит из небольшого по размерам органа, то выявление этого органа не представляется возможным), источник васкуляризации забрюшинного новообразования. Некоторые ретроперитонеальные опухоли обладают рядом КТ- и МРТ-признаков, которые позволяют установить правильный диагноз.
Так, характерной особенностью лимфангиом и ганглионевром является рост между структурами и сосудами забрюшинного пространства без компрессии их просвета, а опухоли симпатической нервной системы растут вдоль симпатической цепочки и имеют продолговатую форму. Выявление источника и интенсивности васкуляризации опухоли – важная задача при КТ- и МРТ-исследовании. К гиперваскуляризованным опухолям относятся гемангиоперицитомы, к умеренно васкуляризованным – злокачественная фиброзная гистиоцитома, лейомиосаркома и, в несколько меньшей степени, другие виды сарком. Липосаркома, лимфома и многие доброкачественные опухоли характеризуются слабой васкуляризацией. Большое значение КТ и МРТ имеют при локализации опухоли в малом тазу для выявления опухолевой инвазии в кости.
Возможность определения характера и плотности содержимого опухоли еще больше суживает диагностический ряд. Липосаркомы и липомы чаще всего встречаются в забрюшинном пространстве. КТ и МРТ позволяют выявить жировую ткань по плотности сигнала, при этом гомогенность и четкие контуры опухоли свидетельствуют о липоме, гетерогенность и отсутствие четких контуров – о липосаркоме. Тератомы также имеют включения, близкие по плотности к жировой ткани, при этом установлению правильного диагноза способствует выявление жидкости и кальцинатов [2, 13]. Нейрогенные опухоли и миксоидные липосаркомы характеризуются наличием миксоидной стромы, богатой кислыми мукополисахаридами, обусловливающей гиперинтенсивные сигналы при МРТ. В опухолях с высокой степенью дифференцировки (например, лейомиосаркомах) обнаруживаются очаги некроза.
Преимуществом КТ по сравнению с МРТ является меньшее количество артефактов, обусловленных движением пациента во время исследования. Неинвазивный характер данных видов исследований, возможность проведения в амбулаторных условиях, небольшое коли- чество противопоказаний являются критериями, позволяющими рассматривать их как основной метод диагностики данной патологии в рутинной практике.
Ультразвуковое исследование. Ультразвуковая диагностика НЗО обладает многими достоинствами, свойственными КТ и МРТ. Преимуществами исследования являются сравнительно небольшая стоимость, доступность и информативность [7, 9, 12].
Биопсия. Биопсия первичных неорганных опухолей, подлежащих оперативному лечению (с учетом данных инструментальных методов обследования), нецелесообразна, поскольку гистологический диагноз не влияет на тактику лечения.
Рентгенологическое исследование. В настоящее время рутинная экскреторная урография используется несколько реже для выявления сдавления или смещения мочеточников, свидетельствующих именно о забрюшинной локализации процесса.
Рентгеноскопия желудочно-кишечного тракта, дополненная ирригоскопией, может выявить смещение, сдавление или прорастание стенки желудка и различных отделов кишечника.
Большую помощь хирургу при выполнении оперативного вмешательства могут оказать данные ангиографии, рентгеноконтрастного исследования сосудов. Анатомической предпосылкой ангиографии являются атипизм ангиоархитектоники и избыточная васкуляризация, которые свойственны многим новообразованиям и отличают их от нормальных тканей. Исследование позволяет выявить как прямые, так и косвенные признаки забрюшинных опухолей.
К прямым ангиографическим признакам относятся:
Илеокаваграфия – контрастное исследование вен, которое имеет большое значение в диагностике НЗО. Тонкая стенка вены и низкое давление в ней обусловливают возникновение деформации контуров сосуда даже при небольших прилежащих образованиях. Этот метод, как и аортография, помогает при решении вопроса о возможности и объеме оперативного лечения опухоли. Зная уровень блокады и степень развития коллатералей, возможно заранее планировать перевязку магистральных вен, в том числе и нижней полой вены [4].
Эндоскопическое исследование. Эндоскопические методы исследования в диагностике забрюшинных опухолей позволяют исключить первичное поражение внутренних органов, а также установить вторичное вовлечение их в процесс за счет прорастания извне. Для диагностики НЗО возможно применение лапароскопии, с помощью которой удается выявить расположение опухоли и диагностировать метастатическое поражение органов брюшной полости.
Лечение
Основным и единственно радикальным методом лечения забрюшинных неорганных опухолей является хирургическое лечение. По данным литературы, хирургическое лечение увеличивает пятилетнюю выживаемость до 50%. Примерно в 60–80% случаев приходится выполнять резекции прилежащих структур, чаще всего почки, толстой и тонкой кишки, поджелудочной железы и мочевого пузыря. Основными принципами вмешательства по поводу забрюшинных опухолей являются удаление опухоли с вовлеченными органами, резекция в пределах здоровых тканей для того, чтобы избежать оставления резидуальной опухоли.
Эффективность хирургического лечения, по данным литературы, колеблется в широких пределах – от 25 до 95%. Даже после радикального хирургического лечения, по данным некоторых авторов, рецидивы продолжают возникать через 5 и 10 лет после выполненной операции, при этом частота локальных рецидивов достигает 50%. Данная цифра может свидетельствовать не только о большой площади поражения опухолевым процессом к моменту выполнения хирургического вмешательства, но и о неэффективности адъювантной лучевой и химиотерапии. Однако, например, забрюшинные липосаркомы характеризуются низкой склонностью к развитию отдаленных метастазов (7%) по сравнению с другими гистологическими подтипами (15-34%), поэтому хирургические вмешательства, выполненные даже с наличием опухолевых клеток по краю резекции, приводят к улучшению выживаемости этих пациентов [10, 11, 15].
Прогноз
В целом забрюшинные неорганные опухоли характеризуются неблагоприятным прогнозом: общая пятилетняя выживаемость, по данным различных авторов, колеблется от 15 до 30% [1, 3].
Клиническое наблюдение 1
Пациентка Д., 72 года, считает себя больной с апреля 2015 г., когда впервые обратила внимание на стойкую потерю массы тела. При обследовании выявлена неорганная опухоль забрюшинного пространства. Со слов пациентки оперирована в декабре 2015 г. В настоящее время поступает для утончения диагноза и определения дальнейшей тактики ведения. Пациентке выполнены УЗИ и КТ (рис. 1, 2).
а) B-режим. Забрюшинно справа определяется мягкотканное образование до 8 см в диаметре, с бугристыми контурами, внеорганное, состоящее из множества узлов. Образование оттесняет и сдавливает нижнюю полую вену, распространяясь до правой почечной вены, деформируя нижнюю стенку последней.
б) Режим ЦДК. Определяется неравномерный кровоток в образовании с преимущественным контрастированием по периферии.
а) Артериальная фаза. Нижняя полая вена на уровне тела позвонка LII (средние отделы) до уровня LIV (верхняя кортикальная пластинка) неравномерно «мешковидно» расширена на протяжении 7,3 см, диаметр на аксиальных срезах 5,1 см, неизмененный диаметр выше расширения 1,4 см, ниже 1,5 см. При введении контрастного вещества в артериальную фазу определяется неоднородная заполняемость просвета за свет наличия заброса из правой почечной вены.
в) Отсроченная фаза. Определяется тугое заполнение полостной системы почек. Признаков сдавления объемным образованием не выявлено.
Рис. 3. Макропрепарат. Опухоль желтого цвета 25 х 40 см. Опухоль плотноватой консистенции, на разрезе серовато-жёлтого цвета.
Лечение включало: резекцию объемного образования и правостороннюю нефрэктомию. При гистологическом обследовании опухоль оказалась лейомиомой с минимальным склерозом. Почка с мелкоочаговым склерозом, гиалинозом сосудов, в канальцах микрокальцинаты (рис. 3).
Клиническое наблюдение 2
Пациент К., 63 года, жалоб не предъявляет. Обследован в ходе проведения диспансеризации. При ультразвуковом исследовании выявлено образование в забрюшинном пространстве (рис. 4, 5).
а) В-режим. Визуализируется образование забрюшинно справа, внеорганное, мягкотканное, размером 4,5 см, с кальцинатом (синяя стрелка), оттесняет нижнюю полую вену (красная стрелка).
б) Режим ЦДК. В образовании определяется неравномерный кровоток.
а) В-режим. Забрюшинное образование справа (зеленые стрелки).
б) В-режим. Забрюшинные лимфатические узлы (красные стрелки).
При КТ (рис. 6) установлено: парасагиттально справа, проекционно забрюшинно, преимущественно парааортально, с интимным прилежанием к СI и СVIII печени, оттесняя нижнюю полую вену, определяется неоднородное образование с включением жидкостной плотности, с наличием единичного кальцификата в структуре размер 5,1 х 4,7 х 4,3 см, при внутривенном контрастировании неравномерно накапливает контрастное вещество своим тканевым компонентом. Процесс оттесняет правую почечную вену, последняя без убедительных признаков дефектов наполнения, рядом (в структуре процесса) проходит левая почечная вена. Определяются множественные разнокалиберные парааортальные и паракавальные лимфатические узлы, размерами приблизительно 3,2 х 2,8 см. Заключение: КТ-признаки забрюшинного внеорганного образования справа. Лимфаденопатия.
а) Нативная фаза. Забрюшинное образование справа (красные стрелки), кальцинат в нем (синяя стрелка).
б) Артериальная фаза. Образование (отмечено красными стрелками) неравномерно накапливает контраст.
Выполнено оперативное вмешательство в объеме удаления опухоли. Макропрепарат (рис. 7) представлен бугристой рыхлой опухолью желтоватого цвета до 20 см в диаметре. Гистологически выявлена фибролипосаркома.
Рис. 7. Макропрепарат. Опухоль имеет форму узла плотной консистенции, на разрезе желтовато-белого цвета с многочисленными кровоизлияниями.
Клиническое наблюдение 3
Пациентка П., 43 года, жалоб не предъявляет. Обследована в ходе диспансеризации. При ультразвуковом исследовании малого таза выявлено внеорганное образование (рис. 8). При КТ (рис. 9) в области малого таза справа определяется вне органное объемное образование размером до 8 см, при введении контрастного вещества плотность повышается до +56 ед.H. Проведенная биопсия образования позволила установить диагноз лейомиомы. Учитывая категорический отказ пациентки от оперативного лечения, было решено продолжить динамическое наблюдение.
а) B-режим. Забрюшинно справа определяется внеорганное гипоэхогенное мягкотканное образование неправильной формы, неоднородной эхоструктуры, размером до 8 см.
б) Режим ЦДК. Образование кровоснабжается.
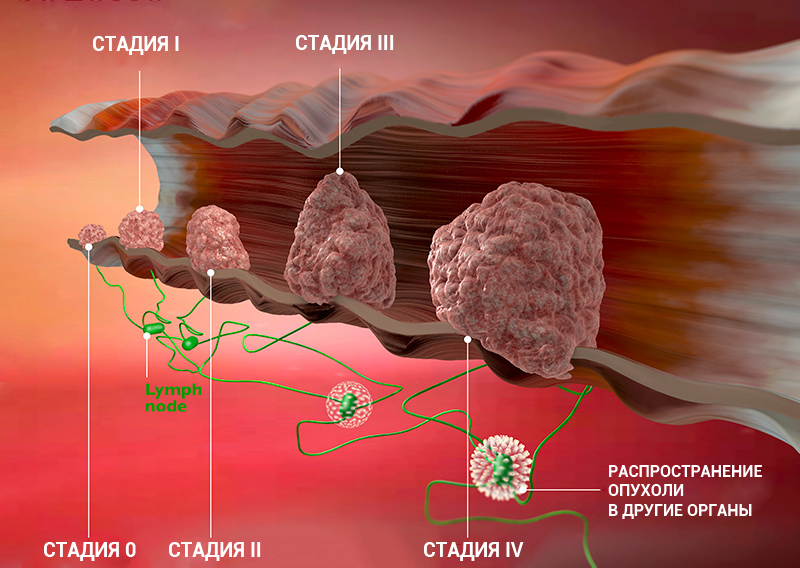
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора: