Боли в кишечнике после химиотерапии что принимать
Осложнения противоопухолевой терапии на желудочно-кишечный тракт
В данной статье рассматриваются следующие осложнения противоопухолевого лечения со стороны желудочно-кишечного тракта:
Снижение массы тела (недостаточность питания)
Снижение массы тела у онкологического пациента возникает вследствие многих факторов: необходимо учитывать лечение пациента сейчас и в прошлом, состояние больного, объем операционных вмешательств и т.д.
Причины потери массы тела:
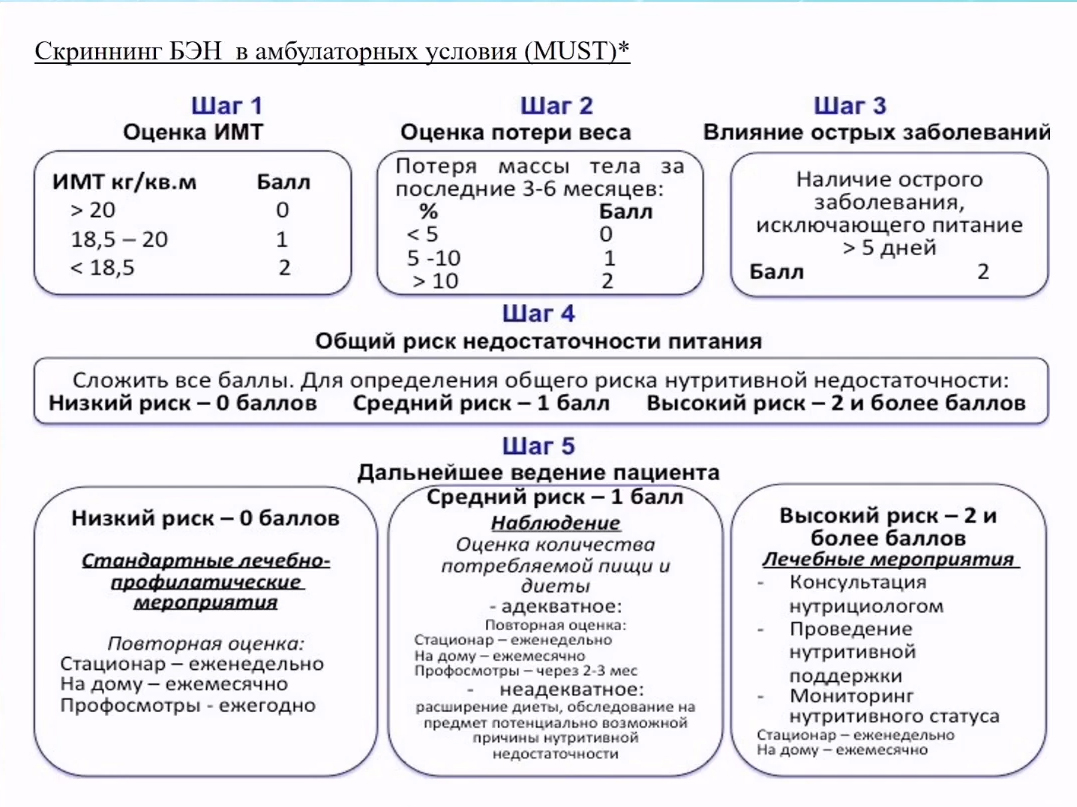
Оценка недостаточности питания
В амбулаторной практике используются различные шкалы для оценки недостаточности питания.
Оценка ситуации должна включать в себя как минимум следующие вопросы:
Алгоритм назначения нутриционной поддержки
Данный алгоритм должен разрабатываться совместно со специалистом, поскольку пациент не может самостоятельно подобрать для себя адекватную терапию, которая поспособствует улучшению самочувствия и облегчению симптоматики.
Для алгоритма назначения нутриционной поддержки необходимо ответить на следующие вопросы:
Для расчета энергетических потребностей пациента необходимо оценить имеющуюся недостаточность питания, риски прогрессирования недостаточности питания.
Осуществляется выбор оптимального пути введения лечебного питания. Возможны следующие варианты: сиппинг (лечебное питание, которое пациент может употреблять самостоятельно), зондовое питание, комбинированная нутриционовая поддержка (совмещение парентерального и энтерального питания). Отдельно стоит рассматривать ситуации, когда у пациента есть стома (гастростома, энтеростома, эзофагостома): в этом случае введение препаратов лечебного питания может осуществляться через нее.
Определяется режим кормления, режим введения препаратов лечебного питания.
Определяются сроки нутриционной поддержки пациента.
Осуществляется выбор препаратов для конкретной ситуации.
Методы оценки эффективности проводимой нутриционной поддержки
Эти методы часто используются в рутинной практике. Они позволяют оценить изменение состава тела на фоне нутриционной поддержки, оценить объем жировой массы, внеклеточной и внутриклеточной жидкости, косвенно оценить количество мышечной массы.
Эти методы редко используются в рутинной практике. Однако их достоинство в доступности – врач может осуществить оценку состояния тела прямо во время приема.
Пострезекционные синдромы
Синдромы оперированного желудка
К ним относятся – депминг-синдром, гипогликемический синдром, анемический синдром, синдром приводящей петли, рефлюкс-эзофагит, недостаточность питания, моторные нарушения культи желудка, анастомоза.
Чаще всего с этими синдромами сталкиваются пациенты, которые перенесли операции на желудке, пищеводе или поджелудочной железе. Данные симптомы могут развиваться, как в раннем, так и в более отсроченном периоде.
Демпинг-синдром. Как правило, проявляется слабостью, потливостью после приема пищи, головокружением, зачастую возникает при приеме углеводистой пищи. Развивается, как в раннем, так и в позднем послеоперационном периоде. Синдром обусловлен быстрой эвакуацией пищи из пищевода в тонкую кишку с последующим развитием гипергликемии, то есть пища быстро попадает из пищевода в тонкую кишку, что вызывает повышение уровня глюкозы (сахара) в крови.
Обычно регулируется подбором режима питания и рациона, а также медикаментозными препаратами.
Пациентам, страдающим демпинг-синдромом, необходимо вести пищевой дневник. Это поможет отследить причины синдрома (определенное время суток, определенная еда и т.д.).
Гипогликемический синдром. Проявляется недостаточным уровнем сахара в крови. Является разновидностью позднего демпинг-синдрома.
Анемия. Обусловлена дефицитом железа и витамина В-12 после удаления желудка. Данное состояние необходимо корректировать и компенсировать препаратами.
Рефлюкс-эзофагит. Это заброс пищи из тонкой кишки в пищевод. Самыми частыми проявлениями рефлюкс-эзофагита является изжога, горечь во рту, тяжесть после приема пищи, ощущение жжения по ходу пищевода. Реже симптом проявляется жжением в области языка, кислым привкусом во рту. Корректируется режимом питания, новыми жизненными привычками и назначением медикаментозной терапии.
Недостаточность питания или потеря массы тела. Данный синдром требует коррекции рациона и режима питания, а также назначения дополнительной нутриционной поддержки.
Важно знать, сколько массы пациент потерял до операции, после операции, во время химио/лучевой терапии. Исходя из этого подбираются препараты лечебного питания.
Нарушение культи желудка, анастомоза (т.е. места соединения органов). Осложнение, которое относится к моторно-эвакуаторным нарушениям. Корректируется медикаментозно.
Болевой синдром. Может быть обусловлен разными факторами. При обращении к врачу важно описать, когда возникают боли, связаны ли они с приемом пищи, через какое время и в каком месте после приема пищи возникают, проходят самостоятельно или требуют применения препаратов, сопровождаются ли тошнотой, рвотой, нарушением стула.
Астения. Состояние общей слабости и утомляемости.
Эти и другие симптомы, которые могут беспокоить пациента в послеоперационном периоде или на фоне проводимого лечения. Любые жалобы требуют обращения к врачу.
Диагностика синдромов оперированного желудка
Обследования позволяют подобрать терапию, дать точные рекомендации по образу жизни.
Как установить причину рефлюкса (заброса пищи обратно в пищевод)?
В сложных случаях для оценки характера рефлюктата и оценки того, что именно забрасывается в пищевод, используется суточная импеданс-pH-метрия. Данное исследование особенно актуально для пациентов, которые перенесли гастрэктомию (удаление желудка), резекцию пищевода.
Обследование выполняется в тех клинических ситуациях, когда пациент получает медикаментозное лечение, но улучшения не наблюдаются. Либо, когда жалобы не соответствуют характеру проведенного оперативного вмешательства.
Консервативная терапия после оперативного вмешательства на желудке
Последствия оперативного вмешательства на поджелудочной железе
Хирургические вмешательства на поджелудочной железе зачастую влекут за собой недостаточность выработки ряда ферментов и гормонов в организме. Нехватка данных веществ может привести к потере массы тела, вторичному диабету, диарее, синдрому избыточного бактериального роста. Вторичной проблемой становится боль в животе.
Чтобы оценить недостаточность ферментов проводится анализ кала на панкреатическую эластазу.
Основное лечение патологии заключается в заместительной ферментативной терапии, подбор питания.
Нарушение стула на фоне лечения (диарея/запор)
Диарея
Основные факторы, которые вызывают диарею (в зависимости от них подбирается терапия):
Любой из вышеперечисленных симптомов требует обращения к врачу для назначения терапии.
Если на фоне диареи, у пациента отмечается подъемы температуры, интоксикация, то необходимо дополнительное обследование на псевдомембранозный колит.
Диарея и недержание кала
После операций на органах, расположенных в малом тазу, у пациента может наблюдаться комбинация сразу двух синдромов – диареи и недержания кала. Чаще всего данное расстройство наблюдается у пациентов гинекологического профиля.
У больного может наблюдаться неоформленный или полуоформленный стул, а также фрагментная дефекация в течение дня, трудности с удержанием кала и газов после возникновения позывов на дефекацию. Иногда бывает ночное недержание кала.
Чтобы оценить состояние анального сфинктера специалисты назначают сфинктерометрию.
При лечении патологии применяется комбинация методов – лекарственная терапия, физиотерапия, физические упражнения.
Запор / задержка стула
Симптом может сопровождаться такими жалобами, как напряжение и/или боли в животе, натуживание, вздутие живота, твердый кал, ощущение неполного опорожнения кишечника, необходимость ручного пособия при опорожнении, отсутствие позывов на дефекацию или ложные позывы на дефекацию без опорожнения кишечника.
Причинами запора/задержки стула могут послужить:
Если пациент наблюдает у себя запор или задержку стула, необходима консультация специалиста.
Методы диагностики, которые помогут установить причину запоров:
Если на фоне лечения задержка стула длится от 4 суток, а также отмечаются повышенное газообразование, тошнота и/или рвота, боли в кишечнике, то необходима срочная консультация специалиста!
Терапия запора/задержки стула
Традиционным методом лечения является медикаментозная терапия. В случае спаечного процесса может потребоваться хирургическое лечение.
Отметим, что противоболевая терапия может усугубить ситуацию.
Лучевые поражения кишечника
Лучевые поражения кишечника проявляются в виде колитов – воспалительного заболевания слизистой оболочки кишечника. Колиты преимущественно развиваются у пациентов, получающих терапию на область малого таза (матка, цервикальный канал, простата, прямая кишка, мочевой пузырь).
Колиты могут возникнуть на любом этапе лечения: во время начала лучевой терапии и в течении 3 месяцев после окончания лечения. Существуют и позднеотстроченные лучевые колиты, которые возникают в течение первого года после проведенной лучевой терапии.
Симптомы
К основным симптомам лучевого поражения кишечника относят: нарушение стула, диарея, ложные позывы к дефекации, боли по ходу кишечника и боли в заднем проходе, в зависимости от зоны, куда пациент получает лучевую терапию. При достаточно выраженном воспалении появляются следующие симптомы — недержание кала и газов, диспепсия, метеоризм, рвота, тошнота, снижение массы тела на фоне диареи.
Если в начале лучевой терапии, во время нее, после нее у пациента отмечается выделение крови с каловыми массами – стоит немедленно обратиться к врачу! Он назначит необходимые обследования и лечение.
Диагностика лучевых поражений кишечника
Исследования, которые позволяют определить степень поражения и назначить терапию:
Терапия
При лучевых поражениях желудочно-кишечного тракта терапия зависит от локализации патологического процесса. В основном используются:
Срок лечения определяется специалистом. Стоит отметить, что лучевой колит невозможно вылечить за 2-3 недели, терапия должна быть длительной и систематической.
Авторская статья:
Захарова П.А.
Гастроэнтеролог, гепатолог НМИЦ онкологии им. Н.Н. Петрова
Боли в кишечнике после химиотерапии что принимать
В настоящее время онкологические заболевания перестали считаться фатальными. Основной целью терапии является поддержание наилучшего качества жизни онкологических больных. Это достигается с помощью разумного баланса между пользой и вредом противоопухолевого лечения.
Зачастую люди вообще не слышат сигналов своего организма. Мы так воспитаны. Не улавливаем порой своих чувств и живем в борьбе со своей интуицией. Отсюда проблемы со здоровьем. Почему так много говорят сейчас об осознанности, медитациях, энергии? Это выход из тяжёлых, кризисных ситуаций в жизни. Поэтому надо развивать в себе эту подавленную интуицию в отношениях со своим телом: ну не хочешь ты есть эту кашу на завтрак, и не ешь. Душевное равновесие нужно поддерживать медитациями, прогулками на природе. Ведь до 90 процентов информации в наш мозг льётся через глаза, и какие настройки мы получим, так и встретим новый день. Это и есть информационная гигиена — позитивный, благодарный настрой, склонность к анализу своих ощущений и работа по коррекции своей психики. Ежедневный планомерный душевный труд.
Известно, что некоторые виды противоопухолевого лечения могут оказывать столь выраженное токсическое влияние, что ухудшают качество жизни даже в большей степени, чем сама болезнь. Поэтому важно провести правильную и последовательную детоксикацию организма после лечения.
Если беспокоит кишечник
Одним из частых последствий комбинированного онкологического лечения являются болезненные ощущения в области живота: вздутие, спазмы кишечника, проблемы с моторикой; нередко эта болезненность развивается после еды. В первые дни после введения химиопрепаратов возникают проявления диспепсии — расстройства стула, тошнота и рвота. Со временем, обычно через 2-3 месяца, присоединяются симптомы гиповитаминоза — это могут быть проблемы со зрением, ухудшение состояния ногтей и волос, сбои в работе сердечно-сосудистой системы. Появляется чувство хронической усталости. Затем присоединяются изменения внешнего вида кожи — начинают появляться воспаления, высыпания и т. д. Ухудшение работы кишечника может также отражаться на деятельности нервной системы и изменять эмоциональный настрой. Такие состояния теперь называют синдромом «дырявого» кишечника, как отмечают специалисты, — это просторечное название синдрома проницаемого или раздраженного кишечника. В норме через его стенки всасывается жидкость и попадает в кровеносную систему. При этом различные бактерии, шлаки и токсины выхода наружу не имеют. Однако при таком синдроме они могут выбираться наружу, попадать в кровь и разноситься по всему организму. Одной из главных причин такого состояния считается хроническое воспаление в кишечнике, которое и приводит к повреждению стенок. Кроме того, стенки могут страдать и из-за отека на фоне аллергии на лекарства. Для профилактики используется премедикация — противовоспалительные лекарства перед введением химиотерапевтических препаратов, об этом вы должны спросить своего лечащего врача. Организм реагирует на «кишечное вторжение», запуская мощный иммунный ответ. Формируется замкнутый круг, который проявляется в заболеваниях пищеварительной системы, аллергии и астме, аутоиммунных заболеваниях (вроде ревматоидного артрита), гормональных нарушениях (вроде предменструального синдрома), хронической усталости, депрессии и проблемах с кожей (вроде прыщей или розацеа).
А еще проблемы с кишечником нередко возникают на фоне хронических стрессов. Само по себе осознание своего диагноза — это и есть стресс. Мы не всегда можем его убрать, но в наших силах поменять к нему отношение и сделать все возможное, чтобы его стало меньше. Для этого каждый человек должен стать сам себе психологом или обращаться за помощью к специалистам в области психологии.
Чтобы минимизировать действие химиотерапии на кишечник необходимо:
Гастрит после химиолучевого лечения
Следующим моментом, с которым часто сталкиваются пациенты, которые прошли химиолучевое лечение — это гастрит. Он может быть скорее с пониженной, чем с повышенной кислотностью. Здесь помогут обволакивающие средства (алмагель, фосфолюгель, маалокс и т. п.) — особенно ночью. Они сорбируют желудочный сок и желчь из кишечника, а также токсины, чувство голода и боль отступают. Большую роль также играет правильный режим питания и периодическое голодание с элементами палеодиеты и кетодиеты. При периодическом голодании погибают условно патогенные дрожжеподобные грибки Candida albicans в микрофлоре, освобождая нишу для полезных бифидо- и лактобактерий, что способствует повышению иммунитета. Отмечено снижение токсических эффектов химиотерапии при таком режиме питания, даже снижение показателей крови (лейкоцитов и тромбоцитов) происходит в меньшей степени. Если возник любой дискомфорт, это значит что-то не так и нужно обязательно разобраться и устранить причину с врачом, а не ходить годами со вздутым кишечником и/или гастритом.
Восстановление печени
Безусловно основным работником в процессе очищения и выведения токсических веществ после окончания химиотерапевтического лечения является печень. Следует провести последовательное восстановление этого важного органа. Каждой весной и осенью желательно проводить профилактику по схеме:
Расторопша (шрот) или в таблетках препарат Карсил — 1 т. или 1 ч. л. шрота за 30-60 мин. до еды 2-3 раза в день 3-4 недели. Затем (с 40 лет) — Урсосан (Урсофальк) — 1 к. 250 мг. за 30 мин. до еды 2 раза в день 50 дней — два раза в год. Яичная скорлупа на кончике ложки с лимонным соком и витамином D (5.000 ед. — 125 мг).
Важно запомнить, что спирт и лекарственные вещества являются субстратами одной и той же ферментативной системы, их совместное воздействие на организм может быть опасным для жизни. Отказ от алкоголя — первое условие для успешного восстановления печени. Миф о пользе красного вина давно развеян. Алкоголь в любом количестве токсичен для организма. Танины красного вина можно купить отдельно в виде добавки, полезна добавка Винный камень, также можно употреблять безалкогольное вино.
Общие рекомендации для восстановления организма
Особое значение для восстановления организма после стресса или токсического лечения имеет компенсация дефицита витаминов и микроэлементов. Сейчас существуют анализы, выявляющие подобные состояния: по составу сыворотки крови и даже — в коже и волосах. Уже доказано влияние питания на риск развития или рецидивирования опухолей. В частности, в растениях, особенно водорослях, как крестоцветных (брокколи, цветная капуста, брюссельская капуста), содержится много полезных веществ. Существуют пищевые добавки, содержащие микро- и макроэлементы: железо, магний, йод, селен, цинк, медь и другие полезные вещества, снижающие токсичность химиотерапии. Например, биологически активная добавка с доказанной эффективностью Промисан, способствующая подавлению процесса раковых клеток, их естественной гибели и восстановлению противоопухолевой защиты организма.
Также, в состав Промисана входит минеральный премикс: цинка сульфат моногидрат, меди сульфат моногидрат, йодид калия, железа (II) лактат дигидрат, марганец сульфат моногидрат, селенит натрия. Каждый микроэлемент обладает дополнительными эффектами, которые усиливают действие основных. Не стоит забывать, что пищевые добавки, как и лекарства, имеют противопоказания. Дозировку и продолжительность приёма препаратов следует подбирать индивидуально с врачом.
В рационе должно быть много зелени, фиолетовых ягод, киви, авокадо и салатов, морепродуктов, водорослей, орехов. Орехи перед употреблением необходимо замачивать на 5-6 часов. Мясо желательно покупать в проверенных местах и лучше индейку, чем курицу. Можно есть говядину и баранину без жира, свинину тоже не очень жирную, костные бульоны. Особенно важно употреблять квашеные продукты как малосольные огурцы и т. п. (можно просто пить разведённый в полстакане воды сок квашеной капусты 1-2 ст. ложки до еды и через час после еды). Из десертов — тёмный шоколад, конфеты и печенье для диабетиков. При готовке и в кофе использовать полезные сахарозаменители: Фитпарад, ксилитол, стевию, сироп топинамбура, в котором содержится полезный для микрофлоры пребиотик — инулин. Мёд, фруктозу и сладкие фрукты минимизировать до 1-2 фрукта в день.
И не забывайте, что сон также очень важен для восстановления организма. Для ночного восстановления организма огромную роль играет мелатонин. Он модулирует работы дневных гормонов, участвует в формировании памяти, восстанавливает иммунитет после дневной работы, регулирует аппетит и массу тела и пр. Мелатонин начинает вырабатываться около 20:00 до часа ночи. Если человек ложится в час ночи, то он пропустил синтез этого важного гормона, а значит и все его эффекты. Можно в такой ситуации принять 1-3 мг мелатонина в виде пищевой добавки.
Еще одной рекомендацией на пути к восстановлению организма после химиолучевого лечения является контроль состояния здоровья. Ниже дан базовый список исследований, который следует повторять ежегодно. Список может расширяться в зависимости от исходного состояния и сопутствующих заболеваний, но база такова:
Лабораторные анализы:
Инструментальные методы:
После 40 лет список расширяется за счет дополнительных исследований 1 раз в 2 года:
Иванова Ирина Николаевна, кандидат медицинских наук, врач-радиотерапевт и гастроэнтеролог. Проводит личные консультации как врач-радиотерапевт и гастроэнтеролог. Консультирует относительно результатов радиологического обследования или лечения. Консультация радиотерапевта может понадобиться на этапе постановки диагноза, в процессе обследования. Ирина Николаевна рассмотрит ваши анализы, результаты исследований, ответит на вопросы и даст рекомендации по дальнейшему наблюдению.
Диагностика и лечение гастроэнтерологических осложнений химиотерапии у онкогематологических больных в педиатрической практике

Мукозит является потенциальным осложнением системного противоопухолевого лечения. Рассмотрены подходы к диагностике, а также лечению и профилактике мукозита у онкологических больных. Тщательный контроль за пациентами и своевременное начало адекватной тера
Mucositis is a potential complication of systemic anti-tumor treatment. Approaches to the diagnostics were considered, as well as treatment and prevention of mucositis in oncologic patients. Thorough supervision over the patients and timely beginning of the relevant therapy allow to relief the developed complications quickly and completely, and continue anti-tumor treatment.
Злокачественные новообразования занимают одно из ведущих мест среди причин смерти людей во всех странах мира. Распространенность злокачественных новообразований среди детей и подростков в России высока, при этом она нарастала на протяжении прошлых лет (увеличившись, в частности, с 10,3 на 100 000 детей в 2002 г. до 12,3 в 2012 г.) и имеет тенденцию к дальнейшему росту [1]. Первое место в структуре онкологической заболеваемости у детей в России занимают лейкозы (35,6%), далее следуют опухоли центральной нервной системы (17,0%), лимфомы (11,0%), опухоли почек (7,1%), мягких тканей (5,5%), костей и суставных хрящей (4,6%) [2].
В современной педиатрической онкологии химиотерапия наряду с хирургическими методами и лучевым воздействием является одним из важнейших компонентов лечения больных. Ее совершенствование идет по пути как повышения воздействия на опухолевые клетки, так и снижения повреждающего действия цитостатических препаратов на нормальные ткани и физиологические функции организма.
Изменения со стороны желудочно-кишечного тракта (ЖКТ) на фоне полихимиотерапии являются самым частым осложнением данного метода лечения у пациентов с онкогематологическими заболеваниями. Эти осложнения в большинстве случаев изменяют состояние больных, являются предрасполагающим фактором для развития инфекций за счет нарушения барьерных функций слизистых оболочек, могут служить причиной летальных исходов [3].
Термин «химиотерапия» означает использование цитотоксических агентов, т. е. лекарств, токсичных для клеток. Химиотерапевтические средства назначаются или по одному (режим монохимиотерапии), или в комбинациях (полихимиотерапия). Эти медикаменты могут использоваться или как единственный метод лечения злокачественных опухолей, или в сочетании с другими методами противоопухолевой терапии (хирургическим или лучевой терапией). Назначение химиотерапии требует от врача и всего медперсонала знаний механизмов действия цитостатиков, правил их хранения и применения, а также знаний о непосредственных, отсроченных и отдаленных последствиях их использования [4].
В профессиональной среде онкогематологов для обозначения изменений ЖКТ на фоне химиотерапии часто используется термин «мукозит ЖКТ» [5].
Термин «мукозит» обозначает воспалительную реакцию со стороны слизистой оболочки на протяжении всего ЖКТ, возникающую при проведении химиотерапии и/или лучевого лечения, в результате которой происходит нарушение процесса непрерывного деления эпителиальных клеток, выстилающих ЖКТ, что делает ткань слизистой оболочки открытой для изъязвления и инфицирования. Образовавшиеся обширные язвенные дефекты являются причиной выраженного болевого синдрома, нередко требующего введения наркотических анальгетиков, приводят к синдрому мальабсорбции, нутритивной недостаточности, диктуют необходимость перехода на парентеральное питание больного [6].
Миелосупрессия может быть как следствием самого опухолевого процесса (лейкемии, метастазов в костный мозг), так и результатом цитостатического лечения. При использовании современных программ интенсивной химиотерапии это осложнение встречается практически у каждого второго леченого ребенка. Практически все цитостатики (за исключением аспарагиназы, винкаалкалоидов и блеомицина) являются миелотоксичными. Самым опасным проявлением миелосупрессии является нейтропения [4].
Нейтропения у больных, получающих химиотерапию, является одним из основных факторов, способствующих развитию инфекции. Нейтропения диагностируется при абсолютном количестве нейтрофилов в периферической крови менее 1,5 × 10 9 /л, а тяжелая нейтропения — менее 0,5 × 10 9 /л. Кроме того, больные в состоянии нейтропении с явлениями мукозита становятся чрезвычайно уязвимыми для инфекции, которая может оказаться фатальной. Все это требует продления госпитализации и существенно ухудшает качество жизни пациента [3].
Распознавание инфекций у больных с нейтропенией затруднено из-за извращения классической клинической картины в силу отсутствия у этих больных «нормального» воспалительного ответа [4].
Развитие побочных эффектов полихимиотерапии значительно ухудшает качество жизни больного и нередко представляет угрозу для жизни, что требует тщательного контроля состояния пациента на всем протяжении лечения, профилактики возможных осложнений, а при необходимости — осуществления деэскалации доз препаратов и проведения своевременной коррекции развившихся побочных эффектов.
Наиболее чувствительны к повреждающему действию химиопрепаратов быстро делящиеся ткани организма, к числу которых относится эпителий ЖКТ. Частота случаев гастроинтестинальной токсичности у больных, получающих полихимиотерапию, составляет 90%. Повреждение слизистой оболочки может развиться в любом отделе пищеварительного тракта (стоматит, эзофагит, гастроэнтерит, энтероколит, панкреатит, гепатит и реакция «трансплантат против хозяина (РТПХ)»). Наиболее часто отмечаются при проведении лучевой терапии опухолей головы и шеи, режима высокодозной химиотерапии (85–100%), реже при введении стандартных доз цитостатиков (5–40%). Наиболее часто мукозиты развиваются при применении препаратов фторпиримидинового ряда (5-фторурацил, капецитабин), метотрексата, этопозида, мелфалана, липосомального доксорубицина, бусульфана и др. [7].
В пределах 7–10 дня после химиотерапии или химиорадиотерапии у пациентов почти всегда развивается ороэзофагеальный мукозит или токсическое поражение ЖКТ [1, 8, 9].
Хотя гастроинтестинальная токсичность имеет индивидуальные особенности и в тяжести, и в продолжительности, это состояние достоверно приводит к нарушению приема пищи и мальабсорбции на срок до 2–3 недель после трансплантации костного мозга (ТКМ) [1, 9–11]. М. А. Кучер с соавт., опираясь на данные многих исследований, отмечают, что интестинальная токсичность возникает примерно у 99% больных, а мукозит 3–4 стадии — у 70% пациентов после трансплантации гемопоэтических клеток (ТГСК) [8, 12, 13].
Факт наличия мукозита способствует повышению риска возникновения инфекционных осложнений, увеличению продолжительности лихорадки, длительности использования парентерального питания, наркотических анальгетиков, увеличению смертности в первые 100 дней после ТКМ и ТГСК и затрат на лечение [13–16].
Единой общепринятой классификации мукозитов, развивающихся на фоне полихимиотерапии, нет [17].
M. Davila и R. S. Bresalier отмечают, что воспаление слизистой оболочки ЖКТ у пациентов с онкологическими заболеваниями может быть вызвано цитотоксическими эффектами химиотерапии и/или излучения или путем инфекции (вирусной, грибковой или бактериальной инфекции). Риск развития нередко повышается у ослабленных онкологических пациентов [18]. Другие причины мукозита, которые встречается у пациентов с раком, включают ГЭРБ, воспалительные заболевания кишечника (ВЗК), воспаление, индуцированное препаратами и РТПХ после ТГСК.
Учитывая имеющиеся данные, можно выделить следующую классификацию мукозитов у пациентов, получающих полихимиотерапию.
По этиологическим факторам выделяют:
Развитие мукозитов ранее связывалось с непосредственным цитотоксическим действием химиопрепаратов или лучевой терапии не только на опухолевые клетки, но и на быстро делящиеся нормальные клетки (в частности, эпителиальные клетки). Патогенез развития мукозита представлялся следующим образом: химиопрепарат и/или лучевое воздействие, вызывая прекращение процессов регенерации эпителия, приводит к образованию язвенного дефекта, колонизации бактериальной флорой и инфекционному воспалительному процессу. Именно вторичная инфекция считалась определяющим фактором в развитии мукозита, определяя его длительность и исходы. В настоящее время установлено, что инфекция является лишь дополнительным фактором в развитии осложнений полихимиотерапии.
Изучение патогенеза мукозита показало, что еще до развития каких-либо клинических проявлений первые морфологические изменения выявляются в подслизистом слое. Повреждение эндотелиальных клеток, апоптоз фибробластов развиваются гораздо раньше гибели эпителиоцитов [19]. Гибель подслизистых эндотелиоцитов, продуцирующих фактор роста кератиноцитов (ФРК), ключевого триггера роста и дифференцировки эпителиоцитов, приводит к истончению эпителиального слоя и образованию язв. Одновременно повышается продукция провоспалительных цитокинов (ФНО-α, ИЛ-6, ИЛ-1β), способствуя воспалительному процессу [20].
S. Sonis выделяет несколько фаз в развитии мукозита [21].
I. Инициирование: в результате прямого воздействия цитостатиков или лучевой терапии на эпителиоциты и клетки подслизистого слоя происходит высвобождение свободных кислородных радикалов (ROS), которые непосредственно повреждают клетки, ткани и кровеносные сосуды.
II. Первичное повреждение: ROS, воздействуя на клетки, вызывают повреждение нитей ДНК, приводящее к гибели клеток. Активация ядерного фактора транскрипции (NF-kB) в ответ на повреждение приводит к запуску целого каскада реакций, сопровождающихся выбросом провоспалительных цитокинов, а именно ФНО-α, ИЛ-6, ИЛ-1β. Одновременно активируются и другие гены, приводя к синтезу молекул адгезии, ЦОГ-2 и последующему ангиогенезу. В этой фазе снижается скорость обновления эпителия, что ведет к атрофии слизистой оболочки и подслизистого слоя.
III. Выработка и передача сигналов: активация фактора транскрипции — не единственный путь, ведущий клетки к апоптозу, параллельно или последовательно с ним ROS активирует керамидный путь за счет ферментов сфингомиелиназы и керамидсинтетазы, непосредственно вызывающих апоптоз. Кроме того, распад фибронектина активирует макрофаги и последующую выработку матричной металлопротеиназы (ММР), которая еще более активирует ФНО-α и ведет к повреждению тканей. Эта фаза приводит к существенным биологическим изменениям в слизистой оболочке и подслизистом слое, хотя визуально ткань может выглядеть неповрежденной.
IV. Изъязвление: фаза, наиболее богатая клиническими проявлениями. Повреждение эпителиальных стволовых клеток приводит к эрозивным изменениям слизистой оболочки. Язва служит центром для бактериальной колонизации, особенно в окружающей среде, столь богатой микроорганизмами. Развивается вторичная инфекция. Продукты распада бактерий проникают через подслизистую оболочку и, стимулируя макрофаги, приводят к новому выбросу провоспалительных цитокинов. Как правило, эта фаза совпадает с глубокой нейтропенией, при этом целые бактерии могут вторгаться в подслизистую оболочку, вызывать развитие бактериемии или сепсиса [22].
V. Заживление: данная фаза характеризуется восстановлением скорости эпителиального обновления (пролиферации и дифференцировки клеток), нормализацией состава микрофлоры окружающих тканей. Как правило, фаза заживления совпадает с периодом восстановления показателей периферической крови и завершается к 15–16 дню от начала химиотерапии [23].
Клиническая картина
Клинические проявления мукозита в разных отделах ЖКТ различны, что обусловлено специфической структурой и функцией слизистых оболочек [7, 24–27].
Чаще мукозитом страдают дети, что связывают с высокими темпами метаболизма в тканях, высокой скоростью митозов клеток эпителия, особенностями онкологической патологии и схемами (протоколами) химиотерапии [28, 29]. Гендерных различий в связи с мукозитом в детской практике не отмечают [26, 30, 31].
Цитостатики нарушают дифференцировку эпителия слизистой оболочки, приводя к усиленной микробной колонизации ее изъязвлений грамположительными, грамотрицательными и анаэробными бактериями, грибами рода Candida. Эти процессы могут прогрессировать вплоть до развития бактериемии (фунгемии) и сепсиса у пациентов с миелосупрессией [22, 32–36].
Риск возникновения мукозита обусловлен двумя группами факторов: связанными с лечением онкологического заболевания и ассоциированными с пациентом. К факторам, связанным с лечением, относят выраженное токсическое действие отдельных препаратов на слизистую кишечника, дозировку, режим введения, а также сочетания препаратов и методов лечения. Среди цитостатических препаратов, применяемых в детской онкологии, наиболее выраженное токсическое действие на слизистую ЖКТ оказывают: антиметаболиты (метотрексат, меркаптопурин, фторурацил), антрациклины (доксорубицин), алкилирующие агенты (бусульфан, циклофосфамид, тиотепа), винкаалкалоиды (винкристин), комплексные соединения платины (цисплатин, карбоплатин), противоопухолевые антибиотики (блеомицин), ингибиторы топоизомераз ДНК (этопозид, топотекан) [37–41]. Пациенты, у которых мукозит возник на фоне первого курса химиотерапии, имеют повышенный риск развития данного осложнения при последующих курсах, что объясняют эффектом кумуляции препаратов [22, 42, 43]. Риск возникновения мукозита возрастает также при комбинировании химиотерапии и лучевой терапии [26, 41, 44, 45].
Большое значение имеют факторы риска, ассоциированные с пациентом. К ним относят возраст (моложе 30 лет); пол (чаще у женщин); тип опухоли (чаще при гемобластозах и лимфопролиферативных заболеваниях); плохая санация ротовой полости до начала лечения; наличие в анамнезе сахарного диабета; нарушения функции почек и печени [46].
Наиболее частые симптомы орального мукозита проявляются эритемой, отеком, воспалением, атрофией и изъязвлением, что сочетается с выраженной болезненностью, кровоточивостью, дисгевзией и нарушением питания [24, 47–51].
В клинической симптоматике эзофагитов наблюдаются одинофагия, дисфагия, особенно — боль и затруднение глотания при употреблении жидкой пищи, могут появиться жалобы на одышку и боли в груди, при присоединении инфекционного процесса будет наблюдаться лихорадка. Реже эзофагит может протекать бессимптомно. Чаще всего ограничивается поражением поверхностных слоев слизистой оболочки пищевода и только в исключительных случаях вызывает глубокое воспаление стенки пищевода, которое может привести к образованию стеноза или фистулы.
Наиболее частым специфическим симптомом мукозита желудка и двенадцатиперстной кишки является боль в животе. Боли при типичном течении эрозивно-язвенных поражений локализуются в основном в эпигастральной и периумбиликальной областях. По характеру боли могут быть различными от ноющих до режущих и приступообразных. Характер болевого синдрома зависит от возраста, индивидуальных особенностей больного, состояния его нервной и эндокринной систем, анатомических особенностей эрозивно-язвенного дефекта, степени выраженности функциональных нарушений ЖКТ. Диспепсические симптомы проявляются в виде тошноты, рвоты, чувства тяжести в подложечной области, жжения в эпигастрии и изжоги. С увеличением продолжительности заболевания частота симптомов диспепсии нарастает.
Клинические проявления мукозита кишечника могут варьировать от умеренной диареи до угрожающего жизни энтероколита. У детей отмечаются выраженная диарея с потерей жидкости и белка, потеря аппетита и болевой синдром. Кроме того, данные симптомы могут сопровождаться повышением воспалительных маркеров (C-реактивный белок, прокальцитонин). Учащение дефекаций, изменение консистенции (жидкий, примесь слизи, крови) и увеличение объема стула, иногда появление болезненных тенезмов, вздутие и болезненность при пальпации живота; нередко эти симптомы могут быстро разрешаться, однако в тяжелых случаях приводят к дегидратации и потере массы тела, электролитным нарушениям, угрожающим жизни больного. При постановке диагноза необходимо помнить о дифференциальной диагностике и наиболее частых причинах диарейного синдрома у детей с гематологическими и онкологическими заболеваниями, таких как индуцированный полихимиотерапией мукозит, длительный прием иммуносупрессивных препаратов, нейтропенический энтероколит, вирусное поражение кишечника (ротавирус, аденовирус, цитомегаловирус и др.), Cl. difficile-ассоциированное поражение, бактериальное поражение (Salmonellas spp., Shigella spp., Campylobacter spp.) [52–55].
Диагностика
Для объективизации степени тяжести гастроинтестинального воспаления слизистой оболочки, вызванного химиотерапией у детей, были бы очень полезны специфические биомаркеры. Однако до настоящего времени такого идеального биомаркера гастроинтестинального воспаления слизистой оболочки нет. Как возможный биомаркер, дыхательная проба c 13 C-сахарозой показана для неинвазивной оценки состояния тонкой кишки у детей [56–58]. Главные недостатки этого метода — специализированное оборудование, необходимое для анализа. Кроме того, образцы выдыхаемого воздуха требуется брать каждые 15 минут в течение 2 часов, что позволяет приравнивать его к инвазивным методам у тяжелобольных детей и создает трудности при проведении у детей раннего возраста [56–59]. Другой дополнительный биомаркер — аминокислота цитруллин. Цитруллин синтезируется исключительно энтероцитами тонкой кишки, поэтому является надежным маркером массы энтероцита [60]. В доклинических исследованиях гастроинтестинального воспаления слизистой оболочки, вызванного метотрексатом у крысы, уровень цитруллина в крови был связан с длиной ворсинки [61–64]. Кроме того, в доклиническом исследовании снижение цитруллина было взаимосвязано с атрофией слизистой оболочки, независимо от рациона крыс [65]. Также в нескольких клинических исследованиях у взрослых больных снижение аминокислоты цитруллин в крови коррелировало с тяжестью гастроинтестинального воспаления слизистой оболочки кишечника и низкая концентрация цитруллина была достоверно связана с бактериемией [57–59, 66, 67]. Цитруллин, как показали исследования, является маркером гастроинтестинального воспаления слизистой оболочки, вызванного химиотерапией, у детей с онкологическими заболеваниями. Цитруллин сравнивали по шкале оценки NCI-CTCAE с выраженностью гастроинтестинального воспаления слизистой оболочки тонкой кишки, уровнем ИЛ-8 в крови и стуле, фекальным кальпротектином и тестом c 13 C-сахарозой у детей с воспалением слизистой оболочки, больных раком. Из всех этих параметров уровень цитруллина в крови сильнее всех коррелировал с критериями NCI-CTCAE, что позволяет обнаружить даже субклиническое воспаление слизистой оболочки ЖКТ [68]. Таким образом, цитруллин крови является возможным диагностическим инструментом воспаления слизистой оболочки тонкой кишки.
Для оценки степени тяжести мукозита используется шкала критериев тяжести мукозита (токсичности) NCI-CTC (табл. 1) [46, 69].
Причины мукозита с диарейным синдромом можно определить на основании анамнеза, внимательного клинического осмотра и анализа особенностей полученной больным терапии, тем не менее, в ряде случаев необходимы дополнительные тесты. Должно быть проведено исследование для определения клостридиальных токсинов А и Б в кале. У детей в состоянии нейтропении ректальное обследование делать не следует из-за возможной травматизации слизистой. Можно решиться на эту процедуру в исключительных случаях для выявления источника кровотечения, если таковое имеет место. Методом неинвазивной диагностики является ультразвуковое исследование органов брюшной полости, варианты лучевой диагностики. Инвазивный метод — эндоскопия с возможным взятием образца для гистологического исследования. Могут быть проведены другие исследования, если их результаты повлияют на принятие решений по поводу лечения, в частности микробиологическое исследование стула.
Для оценки степени тяжести используется шкала критериев токсичности NCI CTC (версия 3.0) [69] (табл. 2).
Профилактика и лечение
В качестве мер профилактики развития мукозита рекомендуются [70]:
При возникновении мукозита назначается терапия, направленная на купирование и ослабление субъективных симптомов, уменьшение воспаления, репарацию повреждений, профилактику инфекционных осложнений:
К местным средствам можно также отнести обработку полости рта маслом шиповника, облепихи, раствором прополиса, витамином В12 [71]. Другие методы лечения [71–75] представлены в табл. 3.
При мукозитах с диарейным синдромом важно поддержание водного баланса. Могут использоваться растворы для оральной регидратации. При выраженной диарее или при рвоте показана внутривенная регидратация с коррекцией электролитных и других обменных нарушений (например, восполнение потери альбумина) [79]. Возможно применение препаратов сорбентов. Лечебные протоколы, включающие препараты с высоким риском развития диареи, должны предусматривать комплекс мер, направленных на профилактику развития этого осложнения (адекватная инфузионная терапия, поддержание электролитного баланса, парентеральное питание, в отдельных случаях — назначение лоперамида).
Для профилактики и лечения диареи важное значение имеет соблюдение диеты. Основы диетического питания это высококалорийная, механически и химически щадящая пища с достаточным количеством белка и витаминов. Рекомендовано исключить продукты, способствующие процессу брожения в кишечнике (виноград, сливы; кисломолочные продукты), и увеличить потребление продуктов, богатых крахмалом (рис, бананы, сухари). Необходима коррекция питьевого режима — обильное питье (не менее 3–4 л в сутки), которое позволяет во многих случаях избежать парентерального введения растворов и электролитов. С этой целью используются безалкогольные мягкие напитки (кисель, чай), минеральная вода (Ессентуки, Нарзан и др.) или растворы для оральной регидратации до 1000–1500 мл в сутки. Симптоматическая терапия диареи у онкологических больных осуществляется с учетом ее конкретного патогенеза и в общем виде заключается в назначении диеты, препаратов, уменьшающих перистальтику кишечника, противовоспалительных, вяжущих средств, биологически активных веществ, нормализующих кишечную флору, антибиотиков. Кроме того, при наличии болевого синдрома назначаются анальгетики, спазмолитики. Дополнительными средствами лечения диареи могут быть биопрепараты. Продолжающаяся более 48 ч диарея может потребовать введения синтетического аналога соматостатина, при присоединении лихорадки — назначение антибиотиков и проведение инфузионной терапии для компенсации электролитных нарушений, предотвращения гиповолемии и шока [80].
Заключение
Мукозит является потенциальным осложнением системного противоопухолевого лечения. Наиболее опасным является поражение нескольких отделов ЖКТ, приводящее к расстройству водно-электролитного баланса, нарушению абсорбции в желудочно-кишечном тракте и ограничению потребления пищи в связи с болевым синдромом в верхних и нижних отделах ЖКТ. Следствием таких нарушений является нутритивная недостаточность, повышение риска развития инфекционных осложнений, длительности использования парентерального питания, использование наркотических анальгетиков и затрат на лечение. Назначение химиотерапии требует от врача и всего медперсонала знаний по механизму действия цитостатиков, правил их хранения и применения, а также знаний о непосредственных, отсроченных и отдаленных последствиях их использования. Таким образом, тщательный контроль над пациентами, выявление причинных механизмов токсичности и своевременное начало адекватной терапии позволяют быстро и полностью купировать развившиеся осложнения и продолжить противоопухолевое лечение.
Литература
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва


.gif)
.gif)