Болезнь вильсона коновалова что это
Медные люди: что важно знать о болезни Вильсона-Коновалова
Откуда берется медь в нашем организме и зачем она нужна? Из-за чего возникает болезнь, при которой медь не выводится из тела самостоятельно, и почему она опасна? Как живут люди, у которых меди слишком много, и чем медицина может им помочь?
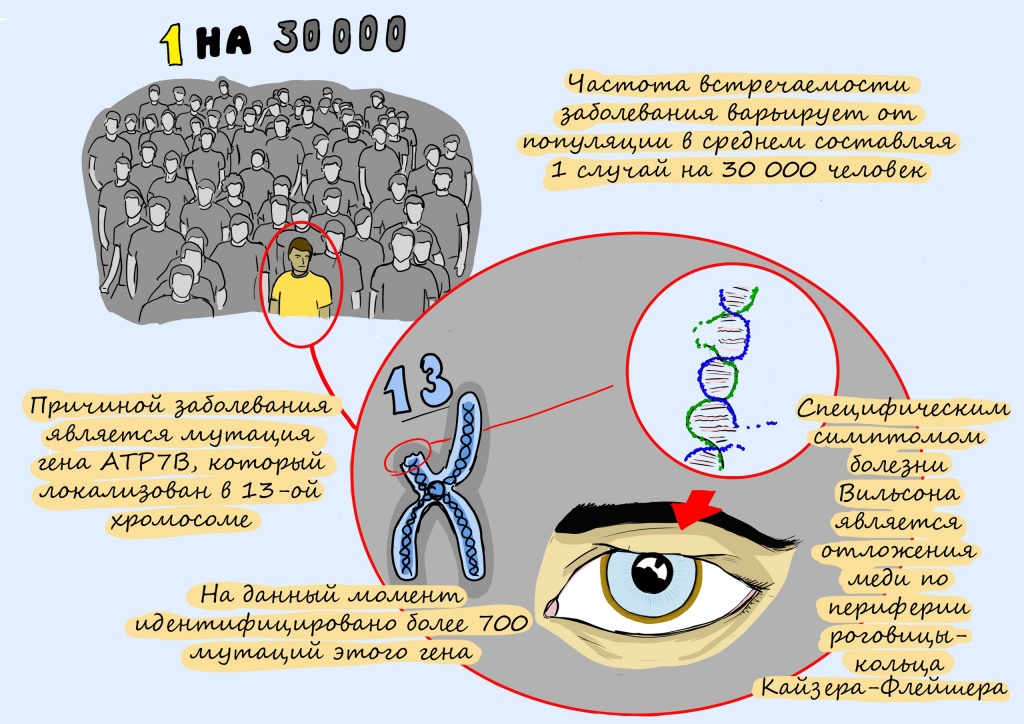
Вместе с информационно-просветительским гуманитарным проектом «12 месяцев» мы запускаем серию материалов о редких (орфанных) генетических заболеваниях и жизни людей с ними. Читайте в ноябре рассказ о болезни Вильсона-Коновалова, которая встречается у одного из 30 тысяч человек, а также историю «медного пациента» — 38-летней Олеси Фрерихс, которая узнала о заболевании на 7 месяце беременности.
Как связаны медь, гены и болезнь Вильсона-Коновалова?
Ежедневно наш организм получает с пищей не только белки, жиры, углеводы и витамины — в него поступает множество ионов металлов и других микроэлементов, необходимых для его правильного функционирования. Например, медь, которая содержится в печени и мясе, какао и бобовых, злаках и орехах.
Несмотря на небольшую суточную потребность — всего 1,5-2,5 мг, медь участвует в обмене энергии, метаболизме железа, защите клеточных мембран — то есть практически во всех физиологических процессах в нашем теле.
Обмен меди, как и многие другие индивидуальные особенности организма генетически запрограммированы, то есть заложены в нас при рождении. Гены — это всего лишь инструкции для синтеза белков в рибосомах. Один ген — один белок, все достаточно просто. А вот какую функцию будет выполнять этот белок — зависит от его структуры.
Некоторые белки участвуют в метаболизме меди. У всех людей всасывание меди происходит в желудке и двенадцатиперстной кишке. Дальше медь транспортируется в печень, где соединяется с различными белками, затем ее часть выводится в связанном состоянии в кровь и уже после — в мочу и кал.
Чтобы меди в организме было всегда ровно столько, сколько нужно, метаболизм регулирует и выравнивает скорости ее поступления и выведения наружу.
Ключевую роль в этом уравнении играет белок-транспортер меди под названием ATP7. Он работает исправно, если в его гене, в инструкции по его сборке, нет опечаток — или мутаций, как их называют биологи. Известно уже более 800 таких опечаток в гене АТР7.
Именно из-за этих мутаций у некоторых людей белок ATP7 не работает вовсе или его функция заметно снижена. В этом случае излишки меди не выводятся из организма, а накапливаются в органах. Но много — не всегда значит хорошо. Избыток металла не дает пациентам с неработающим белком ATP7 повышенную крепкость организма, а напротив — повреждает клеточные структуры. От избытка меди прежде всего страдает головной мозг и печень.
Такую болезнь, вызванную накоплением меди в организме из-за мутации белка ATP7, называют болезнью Вильсона — по имени Сэмюэля Уилсона (Вильсона) — британского невролога, подробно описавшего симптомы заболевания в 1912 году.
В России более распространено другое название — болезнь Вильсона-Коновалова: в 1960 году советский невропатолог Николай Коновалов существенно расширил понимание болезни. Еще реже можно встретить тройное название — Вильсона-Вестфаля-Коновалова (немецкий патолог Карл Фридрих Вестфаль описал болезнь еще в 1883 году). Сами пациенты называют себя вильсонятами.
В этом ролике — краткая история открытий на пути к познанию природы этой болезни и способов помочь пациентам.
Когда появляются симптомы и какими они могут быть?
Первые симптомы болезни Вильсона-Коновалова обычно появляются на втором или третьем десятке лет жизни в виде неврологических нарушений, например, нечеткости речи, нарушении глотания, автоматических жевательных движений, и нарушений показателей работы печени.
В теле не остается ни одного органа, равнодушного к нарушению обмена меди.
Чем медицина может помочь «медным людям»?
Главный на сегодняшний день способ лечения болезни Вильсона-Коновалова был предложен еще больше полувека назад — это регулярное применение препаратов, которые связывают медь и выводят ее из организма. Важным для «вильсонят» остается соблюдение строгой диеты и, при необходимости, пересадка печени.
Прерывание терапии или неправильное лечение может привести к смерти в течение нескольких месяцев. При этом медикаментозная, лекарственная терапия эффективна не для всех пациентов — побочные эффекты препаратов могут даже утяжелять состояние некоторых людей. Поэтому наука продолжает искать ответ — чем же помочь «вильсонятам»?
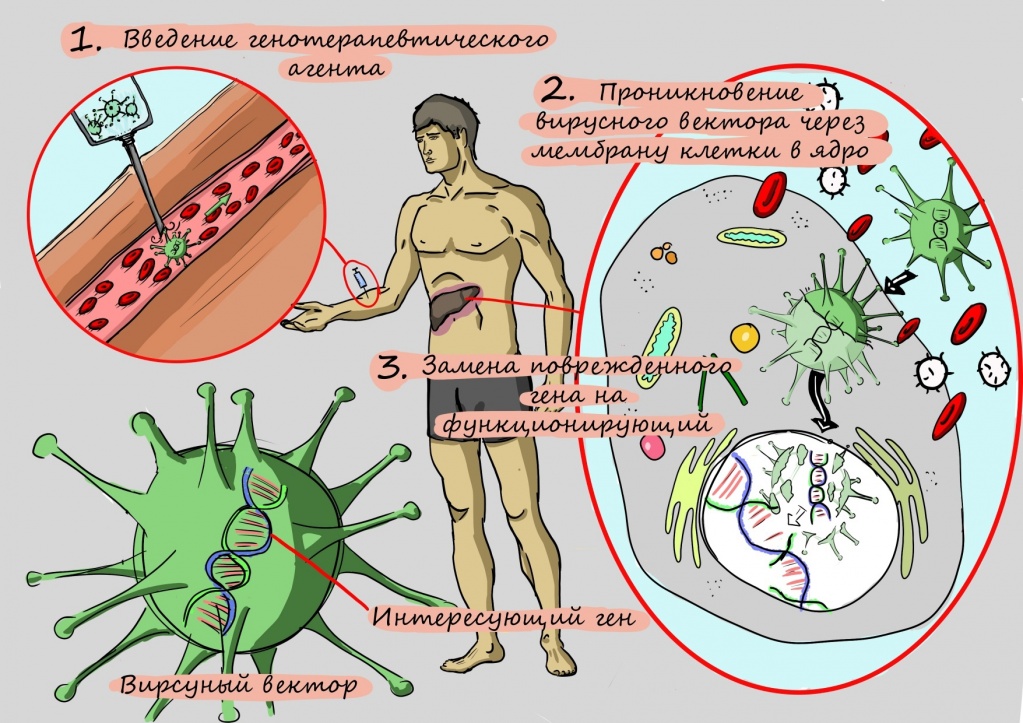
Не так давно исследователи научились исправлять «опечатки» в генах. В том числе — и в ATP7. Не всегда это получается хорошо, тем не менее, генная терапия может навсегда избавить пациентов с болезнью Вильсона-Коновалова от пожизненного приема препаратов и строгой диеты.
Как исследователи пытались научиться делать такую «операцию» на генах? Первые способы замены поврежденного участка гена на здоровый, в частности, применение олигонуклеотидов — коротких фрагментов ДНК или РНК, получаемых путем химического синтеза, даже у мышей приводили к едва заметному улучшению — его точно не хватило бы для помощи человеку.
Разочарования исследователей продлились до тех пор, пока они не научились «протезировать» больной ген. Для этого копию гена без поломки помещают в структуру искусственного вируса, чтобы эта неизмененная копия гена легко проникла в клетку. Освободившись от белковой оболочки, как от скафандра, ген начинает работать — и клетка наполняется правильно работающими переносчиками для меди.
Молекулярное протезирование гена АТР7 — генная терапия
Однако при проведении этого вида терапии исследователи столкнулись с проблемой: аденовирус, который использовали для доставки гена в клетку, не может внедряться в собственный генетический аппарат клеток, — и это приводило к тому, что терапия работала недолго.
Следующим шагом в разработке терапии стало применение другого носителя — так называемого аденоассоциированного вирусного вектора.
Мышам с мутацией, которая похожа на мутацию в белке ATP7, вызывающую болезнь Вильсона-Коновалова, вводили такой вектор, и эффект оказался положительным.
Аденоассоциированный вирусный вектор имеет способность встраиваться в генетический аппарат клеток, поэтому результат лечения был более долгосрочным. Однако и этого оказалось недостаточно.
Успешный опыт подогревал ажиотаж исследователей: так, в 2021 году начались первые два клинических исследования по спасению «вильсонят» методами генной терапии (NCT04884815, NCT04537377). Через несколько лет мы узнаем — помогут ли эти разработки пациентам.
Материал подготовили: Роман Деев, Максим Пушкин, Екатерина Пичугина, Алексей Паевский, Виктория Рыжкова.
Иллюстрации Владислава Ефремова.
Невролог «СМ-Клиника» рассказала о течении болезни Вильсона-Коновалова у взрослых
В 1912 году одновременно в нашей стране и за рубежом была описана особая наследственная патология, которая получила свое название по авторам — болезнь Вильсона-Коновалова. Это наследственная болезнь и она опасна. Можно ли ее вылечить — выясним с экспертом.
АЛЕНА ПАРЕЦКАЯ
Врач-патофизиолог, иммунолог, член
Санкт-Петербургского общества патофизиологов
ВАЛЕНТИНА КУЗЬМИНА
К.м.н., врач-невролог «СМ-Клиника»
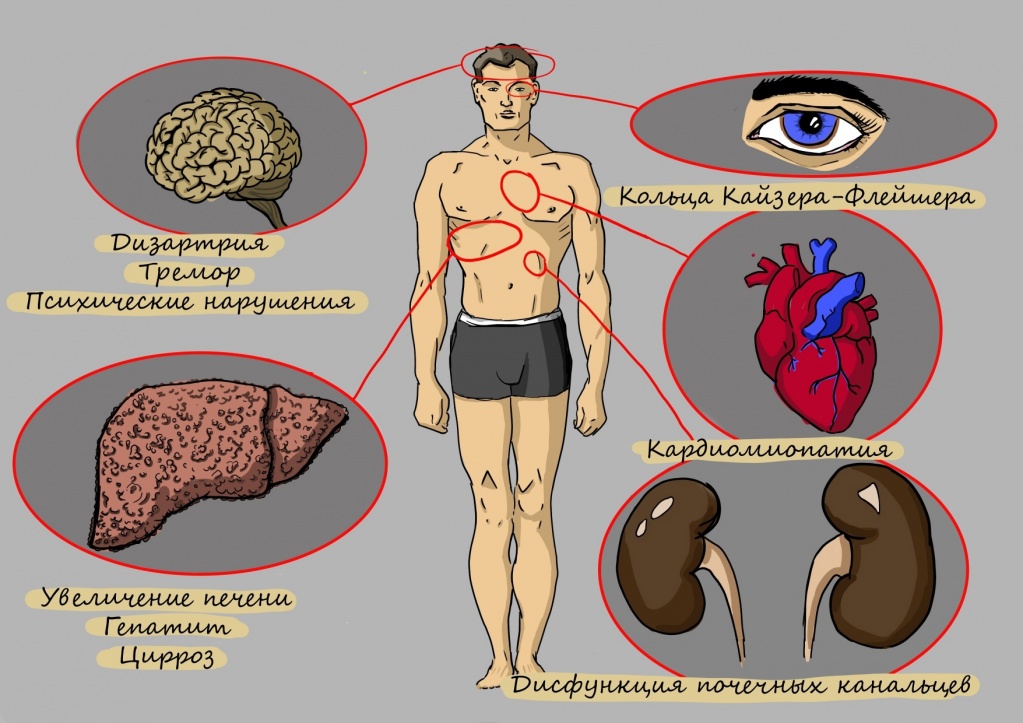
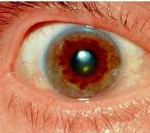
Один из самых характерных признаков болезни – это патологическое накопление меди в области различных органов, повреждение тканей, особенно – печени, проблемы нервной системы, изменения в радужке глаза.
Что нужно знать о болезни Вильсона-Коновалова
Что такое болезнь Вильсона-Коновалова
Термином болезнь Вильсона-Коновалова называют наследственную патологию. Она возникает, когда родители передают ребенку дефектный ген (АТР7В). Состояние относится к аутосомно-рецессивным патологиям, то есть возникает, если каждый из родителей несет подобный ген в своих клетках и ребенок наследует сразу оба гена – от матери и от отца.
Этот дефектный ген дает команды к синтезу белка, который регулирует обмен и перенос меди внутри организма. При его дефекте медь копится в печени, концентрируется в нервных ганглиях, откладывается в радужке глаза. Патология встречается нечасто, ее иногда очень сложно распознать, особенно, если в семье нет подобных больных.
Причины болезни Вильсона-Коновалова у взрослых
Ключевой процесс при этой патологии – наследование дефектного гена от родителей. Он располагается в 13-ой хромосоме и регулирует обмен меди.
Подавляющий объем микроэлемента (95%) переносится в тесной связке с белком плазмы – церулоплазмином. Его постоянно образует печень, и только около 5% меди переносится вместе с альбумином.
Медь нужна для участия в метаболических процессах, в том числе – окислительных. Если развивается болезнь Вильсона, выведение ее нарушается, повышается концентрация в плазме, оттуда она разносится в ткани. Основное накопление меди происходит в мозге, в области радужки, внутри печени, а также в почках. Избыток микроэлемента оказывает токсический эффект.
Симптомы болезни Вильсона-Коновалова у взрослых
При брюшной форме болезни симптомы обычно проявляются ближе к 40 годам. Среди ключевых признаков:
Самая редкая форма болезни – это экстрапирамидно-корковые расстройства. Он похожи на все формы, дополнительно будут судорожные приступы, выраженные проблемы интеллекта, расстройства движений.
Лечение болезни Вильсона-Коновалова у взрослых
Диагностика
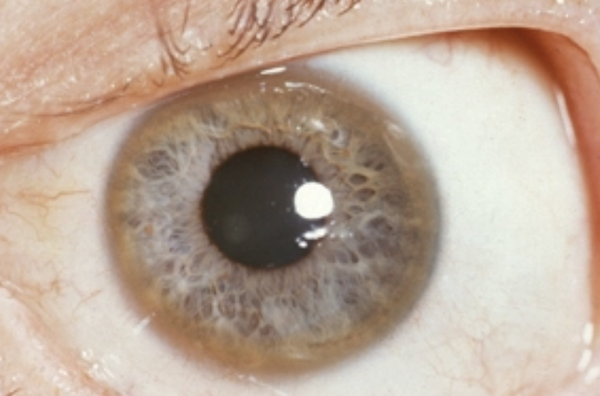
Если речь идет о проявлении глазных симптомов, врач предварительно осматривает состояние глаз щелевой лампой для того, чтобы подтвердить наличие кольца Кайзера-Флейшера.
Показано назначение биохимических тестов крови и мочи, которые покажут повышенное содержание меди в моче и сниженную концентрацию церулоплазмина в плазме крови.
КТ или МРТ покажут атрофические процессы в области мозга и мозжечка, повреждение базальных ядер.
Дополнительно проводится консультация генетика и ряд генетических тестов, выявляющих дефектные гены.
Современные методы лечения
Основной метод лечения при этой болезни – назначение тиоловых препаратов, особенно – унитиола либо D-пеницилламина, купренила. Препараты принимают длительно, врач подбирает наиболее оптимальную дозу, которая позволит избежать побочных эффектов.
Дополнительно врач может применять препараты из группы нейролептиков, при ригидности мышц – леводопу или карбидопу.
При тяжелом течении показана трансплантация печени, иммунсупрессивная терапия. Возможно применение биогемоперфузии с изолятом живых клеточных элементов селезенки с печенью.
Дополнительно необходимо соблюдение диеты с исключением продуктов, содержащих большое количество меди.
Профилактика болезни Вильсона-Коновалова у взрослых в домашних условиях
– Для профилактики патологии, – говорит врач-невролог Валентина Кузьмина, – необходимо придерживаться диеты №5, а также ограничить потребление меди до 1 г в сутки – исключить орехи, сухофрукты, шоколад, раков, печенье, цельную пшеницу. Также рекомендован прием препаратов группы витамина В6, унитиола, триентина.
Популярные вопросы и ответы
Мы поговорили о проблемах болезни Вильсона-Коновалова, ее осложнениях и возможности самолечения с врачом-неврологом Валентиной Кузьминой.
Какие могут последствия при болезни Вильсона-Коновалова?
Среди основных последствий болезни Вильсона-Коновалова можно выделить:
Вызвать врача на дом необходимо при нарушении речи (дизартрия) и глотания (дисфагия), насильственном непроизвольном смехе или плаче, нарушении эмоционального состояния, умеренном снижении интеллекта.
Можно ли вылечить болезнь Вильсона-Коновалова народными средствами?
Нет, лечить болезнь Вильсона-Коновалова народными средствами ни в коем случае нельзя. Это только навредит и ухудшит проблемы печени и нервной системы. Обязательно обратитесь к специалисту.
Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФазы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях. Болезнь Вильсона может протекать в брюшной, ригидно-аритмогиперкинетической, дрожательной или экстрапирамидно-корковой форме. Диагностика болезни Вильсона включает офтальмологическое обследование, биохимические анализы мочи и крови, МРТ или КТ головного мозга. Основу патогенетической терапии составляют тиоловые препараты, которые могут приниматься в течении нескольких лет и даже пожизненно.
МКБ-10
Общие сведения
Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФ-азы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях. Первооткрыватель заболевания — А.К. Вильсон, описавший заболевание в 1912 году, в отечественной медицине — Н.А. Коновалов. Патогенез болезни Вильсона был выявлен в 1993 году. Понятию «болезнь Вильсона» соответствуют также: болезнь Вильсона-Коновалова, болезнь Вестфаля-Вильсона-Коновалова, дистрофия гепатоцеребральная, дистрофия гепатолентикулярная, дегенерация лентикулярная прогрессирующая.
Причины
Ген АТР7В картирован на длинном плече хромосомы 13 (13q14.3-q21.1). Организм человека содержит около 50-100 мг меди. Суточная потребность меди для человека — 1-2 мг. 95% абсорбированной в кишечнике меди, транспортируется в форме комплекса с церулоплазмином (один из глобулинов сыворотки, синтезируемых печенью) и только 5% в форме комплекса с альбумином. Кроме того, ион меди входит в состав важнейших метаболических ферментов (лизилоксидаза, супероксиддисмутаза, цитохром-С-оксидаза и др.). При болезни Вильсона происходит нарушение двух процессов обмена меди в печени — биосинтез главного медьсвязывающего белка (церулоплазмина) и выведение меди с желчью, следствием чего становится повышение уровня несвязанной меди в крови. Концентрация меди в различных органах (чаще всего в печени, почках, роговице и головном мозге) увеличивается, что приводит к их токсическому поражению.
Классификация
Согласно классификации Н.В. Коновалова различают пять форм болезни Вильсона:
Симптомы
Для болезни Вильсона характерен клинический полиморфизм. Первые проявления заболевания могут появиться в детстве, юношестве, в зрелом возрасте и гораздо реже в зрелом возрасте. В 40-50% случаев Болезнь Вильсона манифестирует с поражения печени, в остальных — с психических и неврологических расстройств. С вовлечением в патологический процесс нервной системы обнаруживается кольцо Кайзера-Флейшера.
Брюшная форма развивается преимущественно до 40 лет. Характерный признак — тяжелое поражение печени по типу цирроза печени, хронического гепатита, фульминантного гепатита.
Ригидно-аритмогиперкинетическая форма манифестирует в детском возрасте. Начальные проявления — мышечная ригидность, амимия, смазанность речи, трудности при выполнении мелких движений, умеренное снижение интеллекта. Для этой формы заболевания характерно прогрессирующее течение, с наличием эпизодов обострения и ремиссии.
Дрожательная форма возникает в возрасте от 10 до 30 лет. Преобладающим симптомом является тремор. Кроме того, могут наблюдаться брадикинезия, брадилалия, тяжелый психоорганический синдром, эпилептические приступы.
Экстрапирамидно-корковая форма встречается весьма редко. Ее начало схоже с началом какой-либо из вышеперечисленных форм. Для нее характерны эпилептические припадки, экстрапирамидные и пирамидные нарушения и выраженный интеллектуальный дефицит.
Диагностика
Офтальмологическое исследование с помощью щелевой лампы выявляет кольцо Кайзера-Флейшера. Биохимические исследования мочи обнаруживают повышенную экскрецию меди в суточной моче, а также снижение концентрации церулоплазмина в крови. С помощью визуализационных методов (КТ и МРТ головного мозга) обнаруживают атрофию полушарий большого мозга и мозжечка, а также базальных ядер.
При диагностике болезни Вильсона неврологу необходимо дифференцировать ее от паркинсонизма, гепатоцеребрального синдрома, болезни Геллервордена-Шпатца. Основным дифференциально-диагностическим признаком этих заболеваний является отсутствие характерных для болезни Вильсона кольца Кайзера-Флейшера и расстройств обмена меди. Для подтверждения болезни Вильсона проводится генодиагностика.
Лечение болезни Вильсона
Основой патогенетического лечения является назначение тиоловых препаратов, в первую очередь — D-пеницилламина либо унитиола. Главное преимущество купренила — низкая токсичность и возможность длительного приема при отсутствии побочных эффектов. Его назначают по 0,15 г (1 капсула) в сутки (только после еды), в дальнейшем, в течение 2,5-3 месяцев дозу увеличивают до 6-10 капсул/сутки (оптимальная доза). Лечение D-пеницилламином проводится годами и даже пожизненно с небольшими перерывами (на 2-3 недели) в случае появления побочных эффектов (тромбоцитопения, лейкопения, обострения язвенной болезни желудка и т. д.).
Унитиол назначают в случае непереносимости (плохой переносимости) D-пеницилламина. Длительность одного курса лечения — 1 месяц, после чего лечение приостанавливают на 2,5-3 месяца. В большинстве случаев наступает улучшение общего состояния пациента, а также регресс неврологических симптомов (скованности, гиперкинезов). В случае доминирования гиперкинезов рекомендовано назначение небольших курсов нейролептиков, при ригидности — леводопы, карбидопы, тригексифенидила.
В случае тяжелого течения болезни Вильсона, при неэффективности консервативного лечения за рубежом прибегают к трансплантации печени. При положительном исходе операции состояние пациента улучшается, восстанавливается обмен меди в организме. В дальнейшем лечение пациента составляет иммуносупрессивная терапия. В России на сегодня постепенно внедряется в клиническую практику метод биогемоперфузии с изолированными живыми клетками селезенки и печени (т. н. аппарат «вспомогательная печень). Немедикаментозное лечение состоит в назначении диеты (стол №5) в целях исключения продуктов богатых медью (кофе, шоколад, бобовые, орехи и т. д.).
Прогноз и профилактика
В случае своевременного диагностирования болезни Вильсона и проведения адекватной медьснижающей терапии возможна нормализация общего состояние пациента и обмена меди в организме. Постоянный прием тиоловых препаратов по схеме, назначенной врачом-специалистом, позволяет поддерживать профессиональную и социальную активность пациента.
Для предотвращения рецидивов болезни Вильсона рекомендовано проведение лабораторных исследований крови и мочи пациента несколько раз в год. Необходим контроль следующих показателей: концентрация меди, церулоплазмина и цинка. Кроме того, рекомендовано проведение биохимического анализа крови, общего анализа крови, а также регулярные консультации у терапевта и невролога.
Болезнь Вильсона-Коновалова
И.А. Иванова-Смоленская
профеcсор, доктор медицинских наук
ГУ НИИ неврологии РАМН
Открытый недавно ген болезни отвечает за синтез медь-транспортирующего белка (АТР7В). При гепатолентикулярной дегенерации обмен меди и медьсодержащих белков нарушается, появляется избыток “свободной” меди, которая в больших количествах откладывается в печени, мозге, роговице, а также выделяется с мочой. Не случайно диагностика болезни базируется на обнаружении характерных нарушений медного обмена. Благодаря идентификации гена в настоящее время возможна и ДНК- диагностика этого заболевания.
Поражение печени избытком “свободной” меди проявляется циррозом печени. Поражение мозга приводит к развитию тяжелой неврологической симптоматики: дрожанию конечностей и всего туловища, повышению мышечного тонуса, иногда сопровождающемуся болезненными спазмами, нарушением речи, глотания, снижению интеллекта. Отложение меди в роговице (по краю радужной оболочки) обусловливает формирование кольца Кайзера–Флейшера – буро-зеленоватого пигмента. По этому признаку диагноз болезни можно поставить безошибочно.
Гепато-лентикулярная дегенерация известна с глубокой древности. Дошедшее до нас изображение египетского фараона Тутанхамона, по мнению крупнейшего специалиста J. Walshe, не исключает вероятности, что он страдал этим заболеванием. Институт неврологии РАМН в течение многих лет занимается проблемой гепато-лентикуляной дегенерации. Знаменитый отечественный невролог академик АМН СССР Н.В. Коновалов, один из основателей Института, посвятил этому заболеванию две монографии, последняя из которых в 1964 году была удостоена Ленинской премии. В последующие годы данное заболевание продолжало успешно изучаться сотрудниками нейрогенетического отделения Института неврологии, под наблюдением которых за 40 лет находилось свыше500 семей, отягощенных этим недугом. Весь многолетний опыт Института свидетельствует о том, что ключевой проблемой является ранняя диагностика гепатолентикулярной дегенерации. Чем раньше начать лечение (в идеале – еще на досимптоматической стадии либо на доневрологическом этапе, то есть до появления признаков поражения мозга), тем лучше эффект. Вот почему, если в семье есть хоть один ребенок, страдающий этим заболеванием, необходимо тщательное обследование всех его братьев и сестер, в том числе с использованием самых современных биохимических и молекулярно-генетических методов.
Заподозрить раннюю стадию болезни можно на основании следующих признаков: перенесенной желтухи; повторных кровотечений из носа, кровоточивости десен либо множественных кровоподтеков; сосудистых “звездочек” на коже груди и спины; своеобразных “полосок” (белых, меняющих периодически окраску на красновато-синюшную) на бедрах и в подмышечных областях; гормональных нарушений в виде аменореи или дисменореи у девушек, гинекомастии (нагрубание грудных сосков) у юношей, а также акромегалии(увеличение носа, подбородка, утолщение губ); снижения интеллекта и изменений психики в виде чередования дурашливости и пониженного настроения, трудностей усвоения нового материала, проблем с успеваемостью в школе.
Гепато-лентикулярная дегенерация может начать проявляться в детском, подростковом, юношеском, зрелом возрасте и очень редко – в 50–60 лет. Чем раньше начинается заболевание, тем тяжелее оно протекает (при отсутствии лечения). Однако болезнь Вильсона–Коновалова – редкий пример наследственного нарушения, для которого разработаны высокоэффективные методы лечения: даже при появлении тяжелой неврологической симптоматики систематическое лечение обычно дает “драматический” эффект, вплоть до исчезновения всех симптомов или резкого их уменьшения. Пациенты вновь могут полностью обслуживать себя, вести домашнюю работу, учиться, работать по профессии, создать семью и родить здорового ребенка (под нашим наблюдением находятся 30 женщин, страдающих гепатолентикулярной дегенерацией и благополучно родивших здоровых детей). Пациентам с гепатолентикулярной дегенерацией необходимо регулярно наблюдаться у постоянного лечащего врача.
В чем же заключается лечение этой тяжелейшей болезни? Во-первых, это строгое соблюдение “печеночной” диеты (стол 5а), предполагающей исключение богатых медью продуктов (шоколад, кофе, орехи, бобовые и др.). Однако основное лечение – постоянный прием препаратов, выводящих медь из организма. Главным из них является D-пеницилламин.
Эти препараты назначаются по специальной схеме с постепенным увеличением дозы. К сожалению, в силу необходимости проведения пожизненного лечения и особых требований к химической чистоте препаратов отечественный аналог пеницилламина не может быть рекомендован при гепатолентикулярной дегенерации из-за высокой токсичности.
При длительном многолетнем приеме D-пеницилламина у некоторых больных гепатолентикулярной дегенерацией возникают побочные явления в виде дерматитов, анемии и иных осложнений. Поэтому был предложен альтернативный метод лечения солями цинка (оксид, сульфат и др.). Нами было предложено комбинированное лечение D-пеницилламином и препаратами цинка, что дает возможность снизить дозу и избежать побочных явлений. У больных в пресимптоматической стадии достаточно лечения только препаратами цинка.
В настоящее время за рубежом в тяжелых случаях болезни, не поддающихся консервативному лечению, широко применяется пересадка печени. При удачном исходе операции больной полностью выздоравливает и не нуждается в дальнейшем приеме препаратов. В России делаются первые шаги в этом направлении, и одним из таких шагов является разработанный нами совместно с Институтом трансплантологии и искусственных органов метод био-гемоперфузии с изолированными живыми клетками печени и селезенки – так называемый аппарат “вспомогательная печень”.
Помимо этих методов, большое значение имеет гепатопротекторная терапия, направленная на максимальное улучшение функций печени.
Таким образом, при правильной терапии гепатолентикулярной дегенерации – тяжелейшего наследственного заболевания мозга и внутренних органов – в 80% случаев возможно клиническое выздоровление либо выраженное улучшение состояния больных при условии своевременной максимально ранней диагностики.