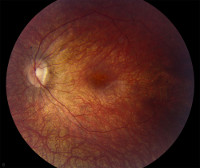
Болезнь лебера что это
Болезнь лебера что это
Наследственная нейрооптикопатия Leber (Leber’s hereditary optic neuropathy, LHON) — одно из первых заболеваний, для которых была установлена этиологическая связь со специфическими дефектами мтДНКЛ. Минимальная моментальная распространенность составляет 1 на 31000 на Северо-Западе Англии, 1 на 39000 в Нидерландах и 1 на 50000 в Финляндии. Возраст дебюта заболевания обычно составляет от 15 до 35 лет, но может варьировать от одного года до 87 лет. Наследственная нейрооптикопатия Leber поражает преимущественно мужчин, что не характерно для митохондриального типа наследования.
У 25-50% мужчин и 5-10% женщин — носителей наследственной нейрооптикопатии Leber в течение жизни развивается ухудшение зрения. Отмечается двустороннее безболезненное обычно внезапное ухудшение центрального зрения. Примерно в 50% случаев наблюдается последовательное ухудшение зрения обоих глаз, поражение второго глаза развивается в течение нескольких недель или месяцев после поражения первого. В течение года неизбежно поражаются оба глаза. Зрение каждого глаза ухудшается в течение нескольких недель или месяцев, острота зрения обычно снижается до значений 20/200 или ниже. Рано развиваются тяжелые нарушения цветового зрения; при периметрии как правило выявляются центральные или центроцекальные дефекты. Аномалии глазного дна выявляются как у самих больных наследственной нейрооптикопатией Leber, так и у их здоровых родственников по материнской линии.
Наблюдаются гиперемия диска зрительного нерва, расширение и извитость сосудов, кровоизлияния, окружающие диск телеангиэктатические микроангиопатии или отек слоя нервных волокон (псевдозастой); эти изменения особенно выражены в острую фазу ухудшения зрения. Со временем единственной аномалией, выявляемой на глазном дне, остается атрофия зрительного нерва и дефекты слоя нервных волокон, особенно в зоне папилломакулярного пучка. Может встречаться неглаукоматозная экскавация ДЗН и сужение артерий. У большинства пациентов с наследственной нейрооптикопатией Leber ухудшение зрения является единственным проявлением болезни. В некоторых семьях у больных наблюдались сопутствующие нарушения сердечной проводимости, особенно часто — синдромы преждевременного возбуждения. У нескольких пациентов были описаны небольшие неврологические нарушения и скелетные аномалии, наподобие наблюдающихся при рассеянном склерозе.
Клиническое значение дополнительных методов исследования при наследственной нейрооптикопатии Leber ограничено. Флюоресцентная ангиография может помочь отдифференцировать изменения диска зрительного нерва при наследственной нейрооптикопатии Leber от истинного отека ДЗН. При электрокардиографии могут выявляться нарушения проводимости сердца. При оптической когерентной томографии на начальных стадиях заболевания выявляется утолщение перипапиллярного слоя нервных волокон, после чего, по мере развития атрофии зрительного нерва, наблюдается его истончение. При ухудшении зрения регистрируются ожидаемо аномальные зрительные вызванные потенциалы. При стандартной электроретинографии при стимуляции вспышкой, электроэнцефалографии, исследовании спинномозговой жидкости, КТ и МРТ головного мозга обычно не выявляется аномалий. Изредка при МРТ у больных с наследственной нейрооптикопатией Leber выявляется резкое увеличения контрастности передних отделов зрительного пути, а в поздние фазы в режиме Т2 — яркие изменения.
У нескольких пациентов с наследственной нейрооптикопатией Leber при магнитной резонансной спектроскопии с фосфором-31 были выявлены признаки нарушения митохондриального метаболизма мышц конечностей и затылочных долей. У тех же пациентов с наследственной нейрооптикопатией Leber при анализе крови выявлена недостаточность комплекса I дыхательной цепи.
Наследственная нейрооптикопатия Leber передается по материнской линии; было выяснено, что причиной заболевания являются точечные мутации митохондриальной ДНК. Три точечные мутации митохондриальной ДНК, известные как «основные мутации наследственной нейрооптикопатии Leber», вызывают примерно 90% случаев этого заболевания во всем мире. Они локализуются в нуклеотидных позициях 11778 (69% случаев), 3460 (13% случаев) и 14484 (14% случаев).
Описаны другие точечные мутации, которые чаще встречаются у больных наследственной нейрооптикопатией Leber, чем в контрольных группах, но выводы о значении этих «второстепенных» мутаций в развитии заболевания следует делать с осторожностью. Некоторые из этих мутаций и в самом деле могут являться основными мутациями, но каждая из них была обнаружена лишь в нескольких семьях по всему миру. Роль других мутаций в патогенезе заболевания остается неясной. Скрининг на предмет наследственной нейрооптикопатии Leber пациентам с ухудшением зрения должен начинаться с поиска трех основных мутаций. Отрицательные результаты анализов на основные мутации и сохраняющиеся сильные подозрения, возможно, являются показанием к исследованию на предмет наличия других связанных с наследственной нейрооптикопатией Leber мутаций митохондриальной ДНК, особенно тех, которые, как считается, вызывают заболевание в нескольких семьях. Или же, поскольку большинство этих «второстепенных» мутаций митохондриальной ДНК локализуются в кодирующих субъединицы комплекса I генах, может быть выполнено полное секвенирование комплекса I, возможно, начиная с так называемой «горячей точки» — гена ND6. Наконец, выполнимо секвенирование всего митохондриального генома, хотя этот анализ трудоемок.
Эти исследования следует выполнять только при наличии стойких подозрений, результаты должны интерпретироваться специалистом, разбирающимся в тонкостях митохондриальной генетики.
Среди пациентов с наследственной нейрооптикопатией Leber, вызванной основными мутациями, наблюдаются очень сходные клинические фенотипы. Единственным существенным различием является более благоприятный прогноз для зрения у пациентов с мутацией 14484. Почти у 70% пациентов с мутацией 14484 отмечается некоторое улучшение зрительных функций, по сравнению со всего лишь 5% пациентов с мутацией 11778. Возможно, у пациентов с мутацией 3460 шансы на восстановление зрения выше, чем при наличии мутации 11778, но для обоснованного анализа количество пациентов слишком мало. У пациентов с дебютом ухудшения зрения в возрасте младше двадцати, а особенно — младше десяти лет, прогноз для зрения гораздо более благоприятный.
Однако нельзя объяснить экспрессию заболевания только генетическими дефектами. Наличие мутации митохондриальной ДНК обязательно, но не достаточно для фенотипической экспрессии. Одним из факторов экспрессии может являться гетероплазмия (наличие одновременно мутантных и нормальных митохондриальных ДНК). В семьях с гетероплазмией у индивидов с большим количеством мутантной митохондриальной ДНК, вероятно, более высокий риск ухудшения зрения. Однако у многих пациентов со 100% мутантной мтДНК зрение так никогда и не ухудшается. Взаимодействие генетических (митохондриальных или ядерных) факторов и окружающей среды осложняет определение роли отдельных мутаций мтДНК в патогенезе заболевания. На экспрессию заболевания, вероятно, влияют и другие факторы митохондриальной или ядерной ДНК, в том числе сцепленные с Х-хромосомой, что объясняет экспрессию заболевания преимущественно у мужчин. Высказывались предположения о различных факторах среды, провоцирующих ухудшение зрения у пациентов с наследственной нейрооптикопатией Leber.
Системные заболевания, недостаточность питания, медикаменты и токсические воздействия, вызывающие нарушения выработки энергии митохондриями, могут оказаться губительными для индивидов, генетически предрасположенных к недостаточности энергопродукции митохондриями. Курение, вероятно, из-за своего пагубного воздействия на функцию митохондрий, связано с более выраженной экспрессией ухудшения зрения среди носителей основных мутаций наследственной нейрооптикопатии Leber; аналогичная связь установлена только для тяжелого алкоголизма.
Патофизиология наследственной нейрооптикопатии Leber остается неизвестной. Может иметь место аномальное окислительное фосфорилирование и недостаточная продукция АТФ, напрямую или опосредованно связанные с выработкой свободных радикалов, что приводит к необратимому повреждению ганглиозных клеток и их аксонов. Почему эти нарушения приводят к селективному повреждению зрительного нерва, остается неясным. При гистохимических исследованиях зрительного нерва животных была выявлена высокая дыхательная активность митохондрий безмиелиновых волокон преламинарной части зрительного нерва, что свидетельствует о высокой потребности в функционирующих митохондриях в этой зоне. Большой интерес представляет собой недавно открытая на модели грызунов генетическая индукция недостаточности комплекса I; при этом гистологические признаки дегенерации зрительного нерва аналогичны наблюдаемым у пациентов с наследственной нейрооптикопатией Leber. Дальнейшее развитие моделирования митохондриальных болезней на животных поможет лучше изучить патогенез митохондриальных болезней человека.
Методы лечения, применяемые при наследственной нейрооптикопатии Leber, включают в себя терапию коэнзимом Q10, идебеноном, L-карнитином, сукцинатом, дихлороацетатом, витамином К1, витамином КЗ, витамином С, тиамином, витамином В2 и витамином Е. По результатам рандомизированного контролируемого исследования применения идебенона для лечения наследственной нейрооптикопатии Leber у пациентов с ухудшением зрения в течение пяти лет при различных зрительных функциях двух глаз (т.е. тех пациентов, у которых заболевание манифестировало недавно), исход для зрения на фоне лечения может быть лучше. Однако из-за необратимых повреждений маловероятно, что при атрофии зрительного нерва какая-либо терапия будет иметь выраженный эффект. Общая рекомендация — избегать приема веществ, вызывающих нарушение митохондриальной энергопродукции, однако эффективность этих мер не доказана.
Но мы все же рекомендуем пациентам с наследственной нейрооптикопатией Leber и их родственникам по материнской линии, входящим в группу риска, избегать табакокурения, употребления содержащих цианиды продуктов, чрезмерного употребления алкоголя и внешних токсических воздействий. Симптоматическое лечение заключается в применении кардиостимуляторов у пациентов с сердечными блокадами или тяжелыми нарушениями сердечной проводимости, а также в помощи слабовидящим при тяжелом снижении зрительных функций. По мере изучения специфических генетических и биохимических аномалий, вероятно, будут разработаны новые методы лечения, направленные на замещение или создание путей обхода генетических и метаболических дефектов у больных и их находящихся в группе риска родственников. Возможно, перспективный метод генной терапии, известный под названием аллотипической экспрессии, в будущем будет играть роль при лечении наследственной нейрооптикопатии Leber и других митохондриальных болезней, а пока не следует недооценивать важность информированного генетического консультирования членов семьи при материнском типе наследования.
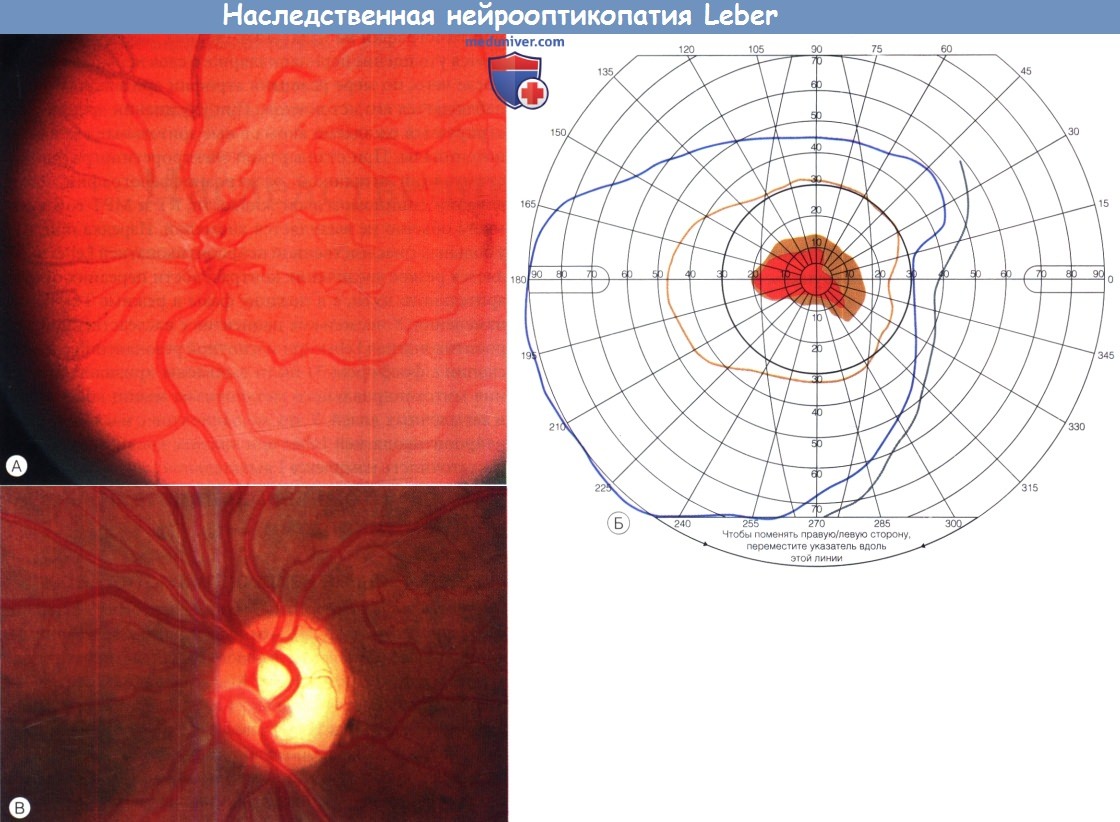
(А) Глазное дно левого глаза в период ухудшения зрения; отмечается легкая гиперемия диска зрительного нерва и перипапиллярные телеангиэктазии.
(Б) При периметрии по Goldmann выявляется центральная скотома левого глаза.
(В) Бледный диск зрительного нерва с экскавацией через пять месяцев после ухудшения зрения у пациента с наследственной нейрооптикопатией Leber. 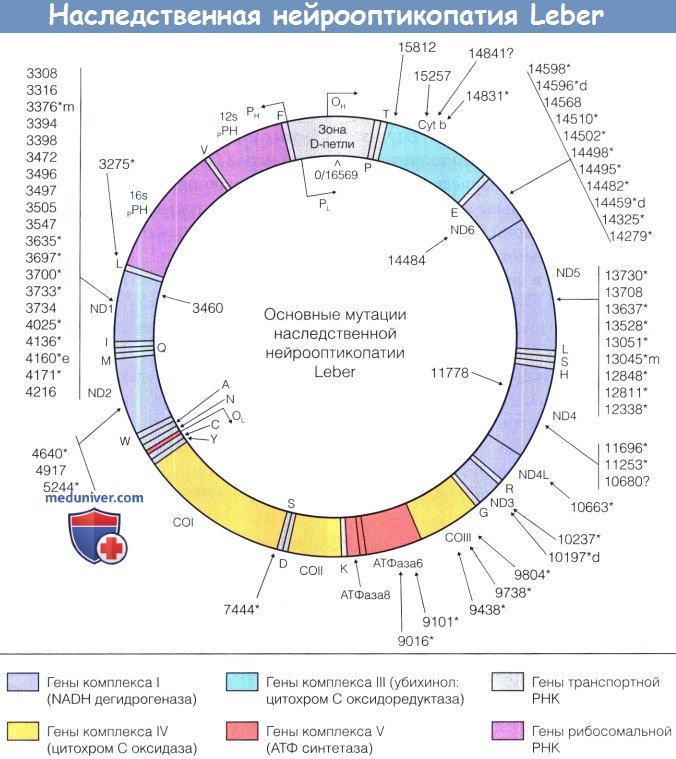
Более 90% всех случаев наследственной нейрооптикопатии Leber вызываются одной из трех основных мутаций, отмеченных внутри генома (кольца); другие мутации отмечены снаружи от генома.
Последние значительно различаются по встречаемости, степени эволюционного консерватизма измененной кодируемой аминокислоты и встречаемости в контрольной группе.
Мутации, отмеченные символом * также, возможно, могут быть отнесены к основным, но каждая из них во всем мире выявлена только в одной или в единичных семьях.
Мутации, отмеченные символом ** — основные мутации, вызывающие наследственную нейрооптикопатию Leber и дистонию.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Атрофия зрительного нерва Лебера
OMIM 535000
Наша команда профессионалов ответит на ваши вопросы
Наследственная оптическая нейропатия Лебера (Leber hereditary optic neuropathy, LHON), или наследственная атрофия зрительных нервов Лебера, или болезнь Лебера (не путать с амаврозом Лебера. – названия похожи, но клинические проявления различаются) –митохондриальное заболевание, манифестирующее, как правило, в возрасте 15-35 лет (однако возраст начала заболевания может варьировать от 1 до 70 лет). Леберовская атрофия зрительного нерва характеризуется острым или подострым двусторонним медленным снижением остроты центрального зрения, при этом не сопровождается болью в глазных яблоках. Глаза могут поражаться как одновременно, так и последовательно, с интервалом в несколько месяцев. Как правило, снижение зрения остается выраженным и постоянным, но описаны случаи, когда спустя несколько лет происходит спонтанное улучшение зрения, иногда значительное. На ранних стадиях заболевания часто отмечается поражение цветового зрения. В ряде семей кроме снижения остроты зрения выявляются и неврологические симптомы: тремор, атаксии, дистония, судороги, а в некоторых случаях – заболевания, не отличимые от рассеянного склероза. Характерными особенностями наследственной оптической нейропатии Лебера являются неполная пенетрантность (до 50% у мужчин и 10% у женщин) и большая частота заболевания среди мужчин (мужчины болеют в 3-5 раз чаще женщин), возможно, связанная с действием Х-сцепленного модифицирующего гена, расположенного в районе Xp21. Показано, что важное влияние на начало и развитие заболевания оказывают факторы риска – стрессы, курение, употребление алкоголя, действие токсинов, лекарств и инфекций.
Как и для других заболеваний с митохондриальным наследованием, для наследственной оптической нейропатии Лебера характерны передача по материнской линии, а также явление гетероплазмии (присутствие в клетке более одного типа митохондрий), которым в ряде случаев можно объяснить неполную пенетрантность.
Причиной развития наследственной оптической нейропатии Лебера являются мутации в митохондриальной ДНК. Выделяют 18 аллельных вариантов заболевания, связанных с миссенс-мутациями в ряде митохондриальных генов. Большинство этих мутаций являются редкими (встречаются в одной или нескольких семьях в мире), однако в 95% случаев выявляется одна из трех мажорных мутаций: m.3460G>A, m.11778G>A или m.14484T>C. Все они изменяют структуру генов, кодирующих белки первого комплекса дыхательной цепи митохондрий.
Показано, что степень тяжести заболевания и возможность восстановления зрения коррелируют с выявленными мутациями. Так, считается, что мутация m.11778G>A вызывает наиболее тяжелые формы, m.3460G>A – более легкие, а m.14484T>C дает наиболее благоприятный прогноз.
Нами разработан набор для ДНК-диагностики Атрофии зрительного нерва Лебера. Наборы предназначены для использования в диагностических лабораториях молекулярно-генетического профиля.
В Центре Молекулярной Генетики проводится диагностика основных трех мажорных мутаций m.11778G>A, m.14484T>C, m.3460G>A, а также 9 более редких первичных мутаций: m.3733G>A, m.4171C>A, m.10663T>C, m.14459G>A, m.14482C>G, m.14482C>A, m.14495A>G, m.14502T>C, m.14568C>T.
Амавроз Лебера
Амавроз Лебера – это наследственное заболевание, характеризующееся врожденным поражением светочувствительных клеток сетчатки глаза и в некоторых случаях другими общими нарушениями (аномалии почек, ЦНС). При этой патологии в первые месяцы жизни ребенка или сразу после рождения появляется нистагм, ослабление или отсутствие реакции зрачка на свет. В дальнейшем ребенок может тереть глаза (симптом Франческетти), возникает дальнозоркость и светобоязнь, возможна полная потеря зрения. Диагностика основывается на данных осмотра пациента врачом-офтальмологом, электроретинографии, исследования наследственного анамнеза и генетических анализов. Специфическое лечение амавроза Лебера на сегодняшний день не разработано.
МКБ-10
Общие сведения
Врожденный амавроз Лебера представляет собой гетерогенную группу заболеваний, причиной которых выступают мутации в 18 генах, кодирующих различные белки сетчатки, в том числе опсин. Впервые амавроз был описан еще в XIX веке (в 1867 году) Т. Лебером, указавшим основные проявления этого заболевания – маятниковый нистагм, слепота, появление пигментных пятен и включений на глазном дне. Средняя распространенность заболевания составляет 3:100000 населения.
Амавроз Лебера в равной мере поражает как мужчин, так и женщин. Заболевание составляет примерно 5% от всех наследственных ретинопатий. Современная генетика разрабатывает методики лечения данной патологии, имеются обнадеживающие результаты генной терапии одной из форм амавроза Лебера, обусловленной мутацией в гене RPE65. Отдельно выделяют атрофию зрительных нервов Лебера, которая также характеризуется постепенной потерей остроты зрения и впоследствии полной слепотой. Однако это заболевание совершенно другой генетической природы и обусловлено повреждением митохондриальной ДНК, которая имеет свой уникальный тип наследования (по материнской линии).
Причины
Основной механизм расстройства зрения при амаврозе Лебера – нарушение метаболизма в палочках и колбочках, которое ведет к летальным повреждениям фоторецепторов и их разрушению. Однако непосредственная причина таких изменений различается в зависимости от того, мутация какого именно гена вызвала заболевание.
Один из наиболее распространенных типов амавроза Лебера (тип 2, LCA2) обусловлен наличием мутантного гена RPE65 на первой хромосоме. Известно более 80-ти мутаций этого гена, некоторые из которых, помимо амавроза Лебера, вызывают и определенные формы пигментной абиотрофии сетчатки. Белок, кодируемый PRE65, отвечает за метаболизм ретинола в пигментном эпителии сетчатой оболочки глаза, поэтому при наличии генетического дефекта этот процесс нарушается с развитием побочных метаболических путей. В результате этого синтез родопсина в фоторецепторах прекращается, что и приводит к характерной клинической картине заболевания. Мутантные формы гена наследуются по аутосомно-рецессивному механизму.
Менее распространенная форма амавроза Лебера (тип 14) вызвана мутацией гена LRAT на 4-й хромосоме. Он кодирует белок лецитин-ретинол-ацилтрансферазу, который располагается в микросомах гепатоцитов и обнаружен в сетчатке глаза. Этот фермент участвует в метаболизме ретиноидов и витамина А, из-за наличия мутаций в гене полученный протеин не может полноценно выполнять свои функции, из-за чего развивается дегенерация фоторецепторов, которая клинически проявляется амаврозом Лебера или ювенильной пигментной абиотрофией сетчатки. Имеет аутосомно-рецессивный характер наследования.
Амавроз Лебера тип 8 наиболее часто приводит к врожденной слепоте, ответственный за развитие этой формы заболевания ген CRB1 располагается на 1-й хромосоме и имеет аутосомно-рецессивный характер наследования. При этом выяснено, что кодируемый данным геном белок принимает непосредственное участие в эмбриональном развитии фоторецепторов и пигментного эпителия сетчатки. Более точных данных по патогенезу данной формы амавроза Лебера на сегодняшний день не накоплено. Аналогичная ситуация с мутацией гена LCA5, расположенного в 6-й хромосоме и ассоциированного с 5-м типом амавроза. В настоящее время выявлен только белок, кодируемым данным геном – леберцилин, но его функции в сетчатке непонятны.
Также выявлено две формы амавроза Лебера, которые наследуются по аутосомно-доминантному механизму – тип 7, обусловленный мутацией гена CRX, и тип 11, ассоциированный с нарушением гена IMPDH1. Ген CRX кодирует белок, который обладает множеством функций – контроль развития фоторецепторов в эмбриональный период, поддержание их адекватного уровня во взрослом возрасте, участие в синтезе других протеинов сетчатки (является фактором транскрипции). Поэтому в зависимости от характера мутации гена CRX клиника амавроза Лебера 7-го типа может быть разнообразной – от врожденной слепоты до относительно позднего и вялотекущего ухудшения зрения.
Инозин-5′-монофосфатдегидрогеназа 1, кодируемый геном IMPDH1, представляет собой фермент, регулирующий рост клеток и образование нуклеиновых кислот, однако это пока не позволяет прояснить патогенез того, как нарушения этого белка приводят к 11-му типу амавроза Лебера.
Классификация амавроза Лебера
В настоящее время полностью доказана взаимосвязь между клиническими проявлениями и мутациями определенных генов для 16-ти типов амавроза Лебера. Также имеются указания об открытии еще двух генов, повреждения в которых приводят к такому заболеванию, но пока в этом отношении проводятся дополнительные исследования.
Кроме того, иногда в клинической классификации выделяют не только название поврежденного гена, но и характер мутации, поскольку это имеет значительное влияние на течение амавроза Лебера. Более того, различные типы мутаций в одном и том же гене могут приводить к совершенно разным заболеваниям – например, некоторые разновидности делеций в гене CRX могут приводить не к амаврозу, а к палочко-колбочковой дистрофии. Некоторые мутации генов RPE65, LRAT и CRB1 являются причиной различных форм пигментной абиотрофии сетчатки.
Симптомы амавроза Лебера
Симптоматика амавроза Лебера достаточно вариабельна и зависит от типа заболевания и характера мутации гена. В большинстве случаев при рождении ребенка патология не определяется – даже при осмотре глазного дна изменения наблюдаются лишь в нескольких процентах случаев. По мере его роста родители могут замечать, что ребенок не задерживает взгляд на предметах и окружающих, а в более старшем возрасте может болезненно реагировать на свет (появляется фотофобия), часто тереть глаза и указывать на них пальцем (симптом Франческетти, окулопальцевый синдром). Обнаруживается нистагм, который возникает еще в первые 2-3 месяца жизни и часто является одним из первых проявлений амавроза Лебера, замедленная реакция зрачка на свет или ее полное отсутствие.
В ряде случаев наблюдается врожденная слепота. Если же ребенок родился с относительно сохранной функцией зрения, то в первые годы жизни, помимо указанных симптомов, у его также развивается дальнозоркость, косоглазие, сильно страдает острота зрения. Обычно к 10-ти годам большинство больных с амаврозом Лебера полностью слепнут. В дальнейшем у них могут возникать и другие нарушения зрительного аппарата – кератоконус, катаракта, глаукома. При некоторых типах заболевания могут наблюдаться и сопутствующие нарушения – поражения ЦНС, глухота.
Диагностика
В современной офтальмологии диагностика амавроза Лебера производится на основании осмотра глазного дна, мониторинга динамики изменений в нем, данных электроретинографии. Немаловажную роль играет также изучение наследственного анамнеза, а для некоторых типов заболевания – генетическое секвенирование последовательности ключевых генов.
Дифференциальную диагностику производят с различными формами пигментной абиотрофии сетчатки (при ней сохраняется нормальная или немного сниженная амплитуда волн на электроретинограмме) и некоторыми типами атрофии зрительных нервов.
Лечение амавроза Лебера
На сегодняшний день специфического лечения любого типа амавроза Лебера не существует. На этапе клинических испытаний находится генно-инженерное введение гена RPE65 в сетчатую оболочку глаза больных амаврозом 2-го типа, имеются первые данные о значительном улучшении зрения подопытных больных. В случае же остальных форм заболевания такого прогресса пока нет. Поддерживающее лечение сводится к витаминной терапии, внутриглазным инъекциям сосудорасширяющих средств. При дальнозоркости назначается ношение очков.
Прогноз
В плане сохранения зрения прогноз крайне неблагоприятный, практически 95% больных полностью теряют способность видеть к 10-му году жизни. Кроме того, это наследственное заболевание может осложняться проблемами с ЦНС, почками, эндокринной системой, что требует более тщательного медицинского мониторинга для своевременного выявления подобных нарушений.
Болезнь лебера что это
ФГАОУ ВО «Балтийский федеральный университет им. Иммануила Канта», ул. А. Невского, 14, Калининград, 236016, Российская Федерация
Альбертский университет, 85 Авеню, Эдмонтон, AB T6G 2R3, Канада
Наследственная оптическая нейропатия Лебера
Журнал: Вестник офтальмологии. 2018;134(2): 92-97
Мазунин И. О., Володько Н. В. Наследственная оптическая нейропатия Лебера. Вестник офтальмологии. 2018;134(2):92-97.
Mazunin I O, Volodko N V. Leber hereditary optic neuropathy. Vestnik Oftalmologii. 2018;134(2):92-97.
https://doi.org/10.17116/oftalma2018134292-96
ФГАОУ ВО «Балтийский федеральный университет им. Иммануила Канта», ул. А. Невского, 14, Калининград, 236016, Российская Федерация
Наследственная оптическая нейропатия Лебера характеризуется двусторонней безболезненной потерей зрения, как правило, в возрасте до 25 лет. С момента первого описания в 1871 г. к настоящему времени многое стало понятно в этиологии и патогенезе заболевания. В представленной работе наследственная оптическая нейропатия Лебера рассматривается с точки зрения офтальмологии, неврологии и молекулярной генетики. Приводятся данные экспериментальных методов лечения заболевания, один из которых проходит клинические испытания.
ФГАОУ ВО «Балтийский федеральный университет им. Иммануила Канта», ул. А. Невского, 14, Калининград, 236016, Российская Федерация
Альбертский университет, 85 Авеню, Эдмонтон, AB T6G 2R3, Канада
Теодор Карл Густаф фон Лебер — немецкий офтальмолог, чье имя стало частью названия отдельных нозологических форм — наследственной оптической нейропатии Лебера (LHON, Leber hereditary optic neuropathy) и амавроза зрительного нерва Лебера (LCA, Leber congenital amaurosis). Эти заболевания имеют разные патогенез и клинические проявления, поэтому их необходимо четко различать. В настоящем обзоре речь пойдет только о наследственной оптической нейропатии Лебера (НОНЛ).
В возрасте 31 года доктор Лебер публикует работу, в которой описывает 15 случаев из 4 семей, имевших наследственную атрофию зрительных нервов (основной клинический симптом НОНЛ) [1]. Долгие годы после этого ученые и врачи пытались выяснить характер наследования данного заболевания, пока американский биохимик Дуглас Уоллес в 1988 г. не обнаружил мутацию в митохондриальной ДНК (мтДНК), ассоциированную с НОНЛ [2]. К настоящему времени описаны 18 патогенных мутаций мтДНК, ассоциированных с НОНЛ, и столько же мутаций, патогенность которых еще предстоит доказать либо опровергнуть. Кроме того, все яснее становится молекулярный патогенез заболевания, что в свою очередь способствует развитию терапии НОНЛ. Причина НОНЛ связана с мутациями только мтДНК. Кроме того, данное заболевание является наиболее распространенной митохондриальной патологией. Частота НОНЛ составляет примерно 1:50 000, однако носители мутаций встречаются приблизительно в 5 раз чаще — 1:10 000 [3].
Клиническая картина болезни
Манифестация заболевания обычно наблюдается в юношеском возрасте и первом периоде зрелого возраста. Отмечено, что у мужчин мутации проявляются клинически в среднем в 5 раз чаще. Как правило, болезнь поражает глаза не одновременно, а с интервалом в несколько недель или месяцев. Дебют заболевания характеризуется резким безболезненным снижением центрального зрения, появляются абсолютные центроцекальные скотомы. Развитие болезни Лебера характеризуется двумя стадиями — острой и атрофической [4]. В острой фазе выделяют триаду признаков: 1) гиперемию и стушеванность границ зрительного диска; 2) перипапиллярную микроангиопатию; 3) отсутствие транссудации флюоресцеина вокруг диска зрительного нерва (ДЗН) при проведении флюоресцентной ангиографии сетчатки. Атрофическая стадия начинается с побледнения всего ДЗН или его височной половины уже через несколько недель или месяцев. Для семей характерно широкое варьирование клинического проявления и количества заболевших. Атипичные случаи клинического течения заболевания включают увеличение остроты зрения, уменьшение размеров центральных скотом и переход скотомы из абсолютной в относительную при сохранении на глазном дне картины частичной атрофии зрительных нервов [5].
Иногда снижение остроты зрения при НОНЛ проявляется совместно с другими неврологическими симптомами [6]. Это могут быть тремор, атаксия и спастические парезы. Полинейропатия проявляется нарушениями тактильной и вибрационной чувствительности в дистальных отделах нижних конечностей. Ахилловы рефлексы могут быть снижены либо полностью отсутствовать. Поскольку в 20% случаев при НОНЛ выявляется также и тремор, можно предположить их генетическую взаимосвязь. Были описаны случаи НОНЛ в сочетании со спастическим парапарезом, атаксией, нарушением чувствительности по полиневрическому типу. При компьютерной томографии больных были обнаружены диффузные повреждения белого вещества мозга, что косвенно свидетельствовало о возможной взаимосвязи с рассеянным склерозом. Помимо неврологических нарушений, у больных с НОНЛ могут наблюдаться некоторые костно-суставные изменения. В единичных случаях отмечаются кардиальные нарушения, проявляющиеся на ЭКГ удлинением интервала Q—T, глубоким зубцом Q и высоким зубцом R. Редко наблюдается нейросенсорная тугоухость.
Молекулярная генетика болезни
Поскольку НОНЛ ассоциирована с мутациями в мтДНК, это определяет характер наследования заболевания: мутацию наследуют все дети больной женщины (митохондриальное наследование). Стоит отметить, что митохондриальное наследование в первом приближении можно спутать с X-сцепленным рецессивным наследованием — в обоих случаях болеют дети больной женщины. Разница заключается в соотношении полов больного потомства: при митохондриальном наследовании все дети имеют равный шанс заболеть, в то время как при X-сцепленном рецессивном наследовании мутация клинически проявляется лишь у мужского пола. Стоит, однако, отметить неполную пенетрантность мутаций, ассоциированных с НОНЛ, — носитель мутации не всегда будет иметь определенные клинические проявления заболевания. Существуют также спорадические случаи — мутация, возникшая в мтДНК de novo, также может спутать понимание характера наследования. Таким образом, анализ родословных является неотъемлемой частью постановки диагноза.
В ходе молекулярно-генетического анализа патогенные мутации в мтДНК удается выявить лишь в половине случаев, клинически диагностированных как НОНЛ. Но когда мутация все-таки выявляется, в 95% случаев — это одна из трех так называемых первичных мутаций мтДНК (m.3460G>A, m.11778G>A и m.14484T>C). Оставшийся процент составляют «вторичные» мутации, число которых растет с каждым годом [7]. Описаны случаи, когда в одной семье удается выявить наличие сразу двух патогенных мутаций — m.11778G>A и m.3460G>A [8]. Кроме того, «первичные» мутации НОНЛ могут выявляться вкупе с мутацией m.1555A>G, ассоциированной с нейросенсорной тугоухостью (SNHL, sensorineural hearing loss) [9], делециями, ассоциированными с прогрессирующей внешней офтальмоплегией (PEO, progressive external ophthalmoplegia) [10], а также с «вторичными мутациями», которые обостряют клиническое течение заболевания [11]. Такие мутации, как m.3376A>G и m.3697G>A, могут приводить к одновременному проявлению у пациента симптомов НОНЛ и MELAS [12].
НОНЛ является одним из немногих митохондриальных заболеваний, для которого установлена корреляция между экспрессией патогенной мутации и принадлежностью к определенной филетической линии (гаплогруппе мтДНК). Так, мутации m.11778G>A и m.14484T>C часто ассоциированы с гаплогруппой J, в то время как мутация m.3460G>A — с гаплогруппой K. Показано, что мутация m.3460G>A, найденная на территории Сибири, ассоциирована с гаплогруппами — производными макрогаплогруппы M, которая с наибольшей частотой представлена у коренных жителей Сибири (алтайцев, тувинцев, бурят). В то же время мутация m.11778G>A, согласно опубликованным данным, экспрессируется на фоне гаплогрупп кластера TJ [13].
Поскольку в клетке присутствуют одновременно несколько мтДНК, мутирующие независимо, возникает ситуация, называемая гетероплазмией (состояние, при котором в клетке имеются разные варианты мтДНК), — в таком состоянии находятся многие патогенные мутации мтДНК. Причем уровень гетероплазмии, как правило, определяет фенотипическую экспрессию мутации. Однако для большинства мутаций НОНЛ (примерно 85%) характерно состояние гомоплазмии, т. е. когда все варианты мтДНК идентичны. В работе Н.В. Володько и соавт. (2006), в частности, была охарактеризована большая семья, включавшая 5 поколений, где удалось выявить мутацию m.3460G>A, возникшую de novo в 3-м поколении. В ходе оценки уровня гетероплазмии было показано, что данная мутация при появлении составляла 27% и через поколение, достигнув уровня более 80%, проявилась клинически [13]. Поскольку знание уровня гетероплазмии мутации необходимо для прогнозирования начала ее клинического проявления, разработка точных методов оценки гетероплазмии становится все более актуальной задачей. Мы, в частности, используем подход капельной цифровой полимеразной цепной реакции для определения абсолютного количества копий мутантных и диких типов мтДНК [14].
Столь неравномерное распределение больных с НОНЛ по половому признаку заставило задуматься о влиянии X-хромосомы на фенотипическое проявление мутаций мтДНК. Кроме того, возможно, что неполная пенетрантность данного заболевания также обусловлена модифицирующим действием каких-либо ядерных генов. Так, анализ сцепления между генными локусами (linkage analysis) позволил выявить два локуса — Xp21-Xq21 и Xq25−27.2, предположительно влияющих на проявление заболевания. В ходе экспериментов на цитоплазматических гибридах, содержащих мутации m.3460G>A, m.11778G>A и m.14484T>C было показано, что 17β-эстрадиол активирует митохондриальный биогенез. Поскольку эстрогеновые рецепторы локализуются в митохондриях ганглиозных клетках сетчатки человека, исследования на цибридах отчасти объясняют наблюдаемое распределение по полу пациентов с НОНЛ [15].
От генотипа к фенотипу
Изменения в последовательности мтДНК (мутации структурных генов) ведут к изменению полипептидной последовательности белков, синтезируемых с этих мтДНК в митохондриях. Такие белки, входящие в состав комплексов окислительного фосфорилирования, нарушают работу этих комплексов, что в конечном счете сказывается на выработке энергии митохондрией. Большинство мутаций при НОНЛ поражают ND—гены, т. е. гены, продукты которых участвуют в сборке комплекса I (NADH-убихинон редуктаза). В связи с этим основным биохимическим дефектом, наблюдаемым при НОНЛ, является снижение активности комплекса I. Мутации в генах, кодирующих субъединицы комплексов III, IV и V, вероятно, действуют по тому же механизму. Мутации в генах тРНК, теоретически, нарушают процесс трансляции всех генов мтДНК, ведя, таким образом, к снижению активности всех комплексов окислительного фосфорилирования. В итоге любые мутации мтДНК должны уменьшать синтез АТФ в митохондриях.
В 1995 г. J. Rizzo и более детально P. Riordan-Eva и соавторы предложили так называемую гипотезу «аксоплазматического стаза», согласно которой центральную роль в развитии заболевания играют клетки ганглиозного слоя сетчатки [16, 17]. В результате снижения количества АТФ ухудшается энергетически зависимый транспорт митохондрий на периферию аксона. Поскольку митохондрии образуются только в соме нейрона, продолжительность их жизни составляет от 1 до 2 нед, некоторые из них не успевают достигнуть дистальных частей аксона, что усиливает недостаточность АТФ на его периферии. Это особенно характерно для безмиелиновых, длинных, узких волокон с высоким отношением площади клеточной мембраны к объему клетки и высоким уровнем активности, какими являются клетки ганглиозного слоя сетчатки. Таким образом, возникает порочный круг, в котором мутации мтДНК ведут к снижению продукции АТФ, что в свою очередь отрицательно влияет на аксонный транспорт митохондрий к дистальным частям аксона, а это приводит к еще большему периферическому снижению продукции АТФ. В конце концов, наряду с повышенным образованием активных форм кислорода (АФК), это может вызвать запуск апоптоза. Этим можно объяснить феномен «все или ничего», наблюдаемый при НОНЛ, — клинически здоровый человек в течение нескольких дней превращается в практически незрячего. Однако одним из загадочных вопросов НОНЛ является природа межклеточных взаимодействий, которые позволяют вовлечь в процесс отмирания одновременно большое количество клеток. Как объяснить, каким образом после двух—трех десятилетий нормального функционирования большинство из примерно 1,2 млн аксонов зрительного нерва погибает одновременно? Для этого необходимо наличие общего резервуара неких факторов или способности быстро обмениваться апоптотическими сигналами. Одними из таких типов клеточных соединений, которые обеспечивают быстрое распространение волны апоптоза, могут быть щелевые соединения расширений аксонов клеток ганглиозного слоя сетчатки. В самом деле, исследования показывают, что щелевые контакты, позволяя клеткам обмениваться АФК и ионами кальция, ответственны за центростремительное распространение гибели нейронов, а химические агенты, закрывающие щелевые контакты, могут ограничивать распространение волны апоптоза. Другим механизмом быстрого распространения сигнала для запуска апоптоза могло бы стать уменьшение количества АТФ, играющего роль нейромедиатора при взаимодействии клеток нервной системы [18].
В рамках этой гипотезы неполную пенетрантность НОНЛ можно объяснить индивидуальными анатомическими особенностями. Например, врожденное повышенное количество аксонов ганглиозных клеток в ДЗН и перипапилярной области изначально затрудняет транспорт митохондрий к окончаниям аксона. Кроме того, строение решетчатой пластинки (lamina cribosa) также может обусловливать различия в пенетрантности, поскольку именно точка ее пересечения зрительным нервом является самым узким местом последнего.
Перспективы лечения
Несмотря на все большее понимание природы молекулярного патогенеза НОНЛ, терапия остается неадекватной. Основные подходы к терапии данного заболевания можно поделить на медикаментозное лечение и экспериментальные методы генной терапии. В рамках данного обзора не будет обсуждаться медикаментозная терапия, поскольку нет ни одного доказательства реальной помощи пациентам после использования тех или иных препаратов [19]. Исключением, видимо, является ибеденон, аналог коэнзима Q10, который проходит клинические испытания [20, 21].
Экспериментальные методы направлены на этиологическую терапию и, хотя в большинстве случаев они находятся на стадии тестирования на клеточных линиях или животных моделях, виден значительный прогресс. Используя стратегию аллотропной экспрессии, создали векторную систему, включающую последовательность гена ND4, не содержащего m.11778G>A. До трансфекции в цитоплазматических гибридах вся мтДНК была представлена мутантными вариантами, вследствие чего уровень АТФ был снижен на 60%. После трансфекции удалось достичь повышения уровня выработки АТФ в 3 раза [22]. Подобная стратегия была использована другими исследователями, которые добились экспрессии гена ND4, соединенного с частью гена COX10, кодирующей сигнальную последовательность соответствующего белка. В результате удалось достичь почти полного восстановления уровня АТФ [23]. Используя NADH-оксидредуктазу (NDI1) из Saccharomyces cerevisiae в качестве донора электронов дыхательной цепи, был восстановлен рост клеток с m.11778G>A на питательной среде с галактозой, хотя уровень АТФ не удалось восстановить полностью [24]. Была сконструирована векторная система, объединяющая ген ND1 и часть гена COX10, необходимого для доставки первого в митохондрии. В клеточной линии, содержащей мутацию m.3460G>A, в состоянии гомоплазмии наблюдалось значительное снижение синтеза АТФ, однако после введения вектора удалось добиться практически полного восстановления исходного уровня АТФ [25]. Для супрессии мутации m.14459G>A была использована модифицированная версия системы редактирования генома TALEN. На основе данного подхода были сконструированы так называемые mitoTALEN — белки, способные импортироваться в митохондрии и узнавать мтДНК. Направленной элиминации подвергались мтДНК с m.14459G>A, следствием чего было не только уменьшение количества мутантной мтДНК, но и повышение активности комплекса I окислительного фосфорилирования [26]. Далее mitoTALEN применили на ооцитах мышей, несущих мутацию m.14459G>A. Было обнаружено, что количество копий мутантной мтДНК снизилось через 24 ч после трансфекции mitoTALEN [27]. Стоит отметить, что мутация m.14459G>A находилась в клеточной линии в состоянии гетероплазмии — одновременного присутствия как мутантной, так и дикого типа мтДНК.
В другом оригинальном исследовании был сконструирован рекомбинантный вирусный вектор AAV2, который специфично проникает в митохондрии, доставляя вложенную в него генетическую конструкцию. Трансфекция такой конструкции культуры клеток, содержащих мтДНК с m.11778G>A (MT-ND4), приводила к нормализации уровня АТФ [28]. «Обратная система», содержащая мутантный вариант гена ND4 (m.11778G>A), была доставлена в полость стекловидного тела мышей. В результате у мышей были обнаружены дегенерация ганглиозного слоя сетчатки и атрофия зрительного нерва, что характеризует НОНЛ у людей. Эксперименты на моделях животных также показали, что ДНК, доставляемая внутрь митохондрий рекомбинантными вирусами AAV2, стабильно поддерживается на протяжении ряда поколений, стабильно экспрессируется и не интегрируется в мтДНК [29]. После ряда заключительных тестов конструкция была использована для первой фазы клинических испытаний (NCT02161380) на пациентах с НОНЛ [30—32]. Авторы исследований заключили, что никаких серьезных проблем с безопасностью подхода у первых 5 участников клинических испытаний не наблюдалось. Последующие исследования этих и дополнительных участников, запланированные на ближайшие 4 года, необходимы, чтобы подтвердить предварительные выводы. Несмотря на то что до создания генно-терапевтического препарата еще далеко, данные, полученные в лаборатории Джона Гая, впечатляют и обнадеживают.
Работа выполнена в рамках федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014—2020 годы» при финансовой поддержке государства в лице Минобрнауки России, соглашение № 14.575.21.0108 от 27 ноября 2014 г. Уникальный идентификатор RFMEFI57514X0108.
Авторы заявляют об отсутствии конфликта интересов.