Более слабые восстановители чем водород
Большая Энциклопедия Нефти и Газа
Слабый восстановитель
Слабый восстановитель ; реагирует с кислотами-окислителями. [1]
Слабые восстановители не изменяют окраски раствора. Это свойство используется для определения больших количеств родия в присутствии хлоридов иридия ( IV) и платины ( IV), которые при восстановлении обесцвечиваются. [2]
Слабый восстановитель ; реагирует с кислотами-окислителями. [3]
Слабые восстановители не изменяют окраски раствора. Это свойство используется для определения больших количеств родия в присутствии хлоридов иридия ( IV) и платины ( IV), которые при восстановлении обесцвечиваются. [5]
Применяя более слабые восстановители и подбирая соответствующую кислотность или щелочность реакционной смеси, можно получить ряд соединений, представляющих различные промежуточные стадии процесса восстановления нитробензола. [8]
Будет ли слабый восстановитель хорошим реактивом на амины или он больше подходит для открытия альдегидов. [10]
Будет ли слабый восстановитель хорошим реактивом на амины или он больше подходит для открытия альдегидов. [11]
При действии слабых восстановителей процесс заканчивается на стадии бразовання нестойкого арилдиимина, который мгновенно разрушается с, выделением азота. [13]
Монозы являются слабыми восстановителями ; так, они выделяют металлическое серебро из аммиачного раствора окиси серебра и при нагревании красную закись меди из фелинговой жидкости. Последняя реакция в отсутствии других восстановителей является не только качественной, но позволяет также при соблюдении определенных условий. [15]
Комплект тестов к урокам химии
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Тесты составила: учитель химии МБОУСОШ№4 Сурова Ирина Александровна, ст. Староминская
Комплект тестов к урокам химии
Тесты по теме «Металлы»:
1)Самый распространенный металл в земной коре:
А) Fe Б) Ti В) Al Г)Са
2)В лампах накаливания используют металлическую нить из:
А) Al Б) Fe В)С u Г) W
3) Наиболее легкоплавкий металл:
А) Li Б) Al В) Hg Г)С u
4) Наиболее тугоплавкий металл:
5)К металлам не относится последовательность элементов:
6) При горении натрия на воздухе образуется:
А) Na 2 O Б) Na 2 O 2 В) NaO Г) Na 3 N
7)Щелочной металл, образующий нитрид при н.у.:
8)Растворимый гидроксид образуется при взаимодействии с водой:
9)При высокой температуре из воды вытесняет водород:
А) Cu Б) Fe В) Ag Г) Hg
10)Более слабыми восстановителями чем водород являются:
11)Уменьшение активности металлов в ряду:
12)Водород не восстановит металл из :
А)СаО Б) CuO В) Cr 2 O 3 Г) MnO 2
13)С соляной кислотой не взаимодействует:
А) Mg Б) Zn В) Ca Г) Cu
14) C оединение CaH 2 называют:
А)амид кальция Б)гидрат кальция В)гидрид кальция Г)гидроксид кальция
Тесты по теме «Неметаллы» :
1)О фторе нельзя сказать, что он самый:
2)Для поглощения хлора можно использовать концентрированный раствор:
А) NaCl Б) NaOH В)НС l Г) H 2 SO 4
3) C какими из перечисленных веществ не взаимодействует хлор:
А)водой Б)раствором хлорида натрия В)раствором бромида натрия Г)раствором щелочи
4)Степень окисления хлора в соединении Ca ( OCl )2 :
5)Сила галогеноводородных кислот возрастает в ряду:
6)Хлорноватистая кислота имеет формулу:
А) HClO Б) HClO 2 В) HClO 3 Г) HClO 4
7)Кислород проявляет положительную степень окисления в соединении:
А) Na 2 O Б) H 2 O 2 В) OF 2 Г) NaNO 3
8)Сожгли 8г кислорода и 8г водорода. Масса образовавшейся воды:
9)Какой из указанных газов не горит в атмосфере кислорода:
А)оксид углерода( II ) Б)метан В)водород Г)оксид углерода( IV )
10)Кислород образуется при разложении:
А)СаСО3 Б) H 2 SO 4 В) H 2 CO 3 Г) HgO
11)Отрицательная степень окисления у азота в соединении:
А) N2O Б) NO В) Na3N Г) NO2
12)Оксид азота( IV ) может взаимодействовать с:
А)хлоридом натрия Б)кислородом В)соляной кислотой Г)гидроксидом кальция
13)Взаимодействие медной стружки с концентрированной азотной кислотой приводит к образованию: А) NO 2 Б) NO В) NH 3 Г) N 2 O
Тесты по теме «Техника безопасности»:
1)Токсичными являются газы:
А)Н2,СО2 Б) Cl 2, H 2 S В)О2,Н2 Г) N 2, He
2)Из наборов газов неядовитыми являются:
А )H2S,NH3,HCl Б ) H2,O2,N2 В ) CO,Cl2,NO2 Г )F2,NO2,NO
3)Этикетка с надписью зеленого цвета приклеивается на тару с веществом:
А)ядовитым Б)боящимся воды В)взрывоопасным Г)огнеопасным
4)Поражает обоняние и оказывает токсическое действие:
А)СО Б)Н2 S В) Cl 2 Г) SO 2
5)Пятно иода, попавшего на халат, исчезнет, если использовать раствор:
А )NaCl Б )Na2S4O6 В )Na2S2O3 Г )KI
6)Если вещество обладает взрывоопасными свойствами, то на тару наклеивают этикетку:
А)красного цвета Б)желтого цвета В)голубого цвета Г)зеленого цвета
7)Если вещество необходимо беречь от воды, на тару наклеивают этикетку:
А)белого цвета Б)желтого цвета В)голубого цвета Г)зеленого цвета
8)В школьных лабораториях в газометрах категорически запрещается хранить: А)азот Б)кислород В)ацетилен Г)оксид углерода( IV )
9)Вентили баллонов с сжатым кислородом нельзя смазывать маслом:
А)кислород растворим в масле Б)кислород будет растворяться парами масла В)кислород находится в баллоне под давлением Г)масло реагирует с сжатым кислородом со взрывом
10)При перегонке легковоспламеняющихся жидкостей в лаборатории разрешается пользоваться только:
А)газовой горелкой Б)спиртовкой В)электроплиткой Г)водяной баней
11)При наличии у реактива ядовитых свойств на тару с ним наклеивают этикетку: А)красного цвета Б)желтого цвета В)голубого цвета Г)зеленого цвета
12)В спиртовках можно использовать только:
А)бензин Б)керосин В)зтанол Г)глицерин
Тест «Металлы» Тест «Неметаллы»
Тест «Техника безопасности»
Тест к уроку«Карбоновые кислоты»:
1. Пропановую кислоту можно получить при взаимодействии:
А)Пропанола и гидроксида натрия
Б)Пропаналя и гидроксида меди( II )
В)Пропена и бромоводорода
Г)Пропаналя и гидроксида натрия
2.Формула масляной кислоты:
4.Карбоновые кислоты взаимодействуют с :
А)Медь и гидроксид натрия
Б)Оксид магния и соляная кислота
В)Магний и гидроксид калия
Г)Оксид кальция и сульфат натрия
5.Кислотные свойства усиливаются:
Тест к уроку «Типы кристаллических решеток»
1. Установите соответствие:
Вещество Тип кристаллической решетки
А) сероводород 1) ионная
Б) кремний 2) молекулярная
В) хлорид калия 3)металлическая
2. Вещества только с молекулярной кристаллической решеткой:
А) магний, иод, хлорид лития;
Б) белый фосфор, оксид углерода( IV ); аммиак;
В)вода, цинк, кремний;
Г) кислород, алмаз, гидроксид натрия.
3. Вещества только с ионной кристаллической решеткой:
4.Вещество с атомной кристаллической решеткой:
А)СО2; Б) SiO 2; В) Mg ; Г) NaCl
5.Вещество молекулярного строения-это:
6.Вещество немолекулярного строения:
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Ищем педагогов в команду «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
также Вы можете выбрать тип материала:
Краткое описание документа:
Тесты составила: учитель химии МБОУСОШ№4 Сурова Ирина Александровна, ст. Староминская
Комплект тестов к урокам химии
«Тесты по теме «Металлы»:
1)Самый распространенный металл в земной коре:А)Fe Б)Ti В)Al Г)Са
2)В лампах накаливания используют металлическую нить из:А)Al Б)Fe В)Сu Г)W
3) Наиболее легкоплавкий металл:А)Li Б)Al В)Hg Г)Сu
4) Наиболее тугоплавкий металл:А)Fe Б)Cu В)W Г)Са
5)К металлам не относится последовательность элементов:А)Са,Zn, Cd Б)В,As,Se В)К,Na,Mg Г)Cu,W,Au
6) При горении натрия на воздухе образуется:А) Na2O Б)Na2O2 В)NaO Г)Na3N
7)Щелочной металл, образующий нитрид при н.у.:А)К Б)Са В)Li Г)Na
8)Растворимый гидроксид образуется при взаимодействии с водой:А)К Б)Mg В)Ag Г)Сu
9)При высокой температуре из воды вытесняет водород:А)Cu Б)Fe В)Ag Г)Hg
10)Более слабыми восстановителями чем водород являются:А)Са,Al Б)Fe,Co В)Bi,Ag Г)Sn,Pb
11)Уменьшение активности металлов в ряду:А)Fe,Zn,Pb,Cd Б)Fe,Zn,Cd,Pb В)Zn,Fe,Cd,Pb Г)Zn,Fe,Cd,Pb
12)Водород не восстановит металл из :А)СаО Б)CuO В) Cr2O3 Г) MnO2
13)С соляной кислотой не взаимодействует:А)Mg Б)Zn В)Ca Г)Cu
14)Cоединение CaH2 называют:А)амид кальция Б)гидрат кальция В)гидрид кальция Г)гидроксид кальция
«Тесты по теме «Неметаллы» :
1)О фторе нельзя сказать, что он самый:А)легкийБ)активныйВ)электроотрицательныйГ)агрессивный
2)Для поглощения хлора можно использовать концентрированный раствор:А)NaCl Б)NaOH В)НСl Г)H2SO4
3)C какими из перечисленных веществ не взаимодействует хлор:А)водой Б)раствором хлорида натрия В)раствором бромида натрия Г)раствором щелочи
4)Степень окисления хлора в соединении Ca(OCl)2 :А)-1 Б)+1 В)+3 Г)+5
5)Сила галогеноводородных кислот возрастает в ряду:А) HCl,HBr,HI Б)НI,HBr,HF В)HBr,HI,HCl Г)HI,HCl,HBr
6)Хлорноватистая кислота имеет формулу:А)HClO Б)HClO2 В)HClO3 Г)HClO4
7)Кислород проявляет положительную степень окисления в соединении:А)Na2O Б)H2O2 В)OF2 Г)NaNO3
8)Сожгли 8г кислорода и 8г водорода. Масса образовавшейся воды:А)8г Б)9г В)16г Г)18г
9)Какой из указанных газов не горит в атмосфере кислорода:А)оксид углерода(II) Б)метан В)водород Г)оксид углерода(IV)
10)Кислород образуется при разложении:А)СаСО3 Б)H2SO4 В)H2CO3 Г)HgO
11)Отрицательная степень окисления у азота в соединении:А)N2O Б)NO В) Na3N Г) NO2
12)Оксид азота(IV) может взаимодействовать с:А)хлоридом натрия Б)кислородом В)соляной кислотой Г)гидроксидом кальция
13)Взаимодействие медной стружки с концентрированной азотной кислотой приводит к образованию: А)NO2 Б)NO В)NH3 Г) N2O
«Тесты по теме «Техника безопасности»:
1)Токсичными являются газы:А)Н2,СО2 Б)Cl2,H2S В)О2,Н2 Г)N2,He
2)Из наборов газов неядовитыми являются:А)H2S,NH3,HCl Б) H2,O2,N2 В) CO,Cl2,NO2 Г)F2,NO2,NO
3)Этикетка с надписью зеленого цвета приклеивается на тару с веществом:А)ядовитым Б)боящимся воды В)взрывоопасным Г)огнеопасным
4)Поражает обоняние и оказывает токсическое действие:А)СО Б)Н2S В)Cl2 Г)SO2
5)Пятно иода, попавшего на халат, исчезнет, если использовать раствор:А)NaCl Б)Na2S4O6 В)Na2S2O3 Г)KI
6)Если вещество обладает взрывоопасными свойствами, то на тару наклеивают этикетку:А)красного цвета Б)желтого цвета В)голубого цвета Г)зеленого цвета
7)Если вещество необходимо беречь от воды, на тару наклеивают этикетку:А)белого цвета Б)желтого цвета В)голубого цвета Г)зеленого цвета
8)В школьных лабораториях в газометрах категорически запрещается хранить: А)азот Б)кислород В)ацетилен Г)оксид углерода(IV)
9)Вентили баллонов с сжатым кислородом нельзя смазывать маслом:А)кислород растворим в масле Б)кислород будет растворяться парами масла В)кислород находится в баллоне под давлением Г)масло реагирует с сжатым кислородом со взрывом
10)При перегонке легковоспламеняющихся жидкостей в лаборатории разрешается пользоваться только:А)газовой горелкой Б)спиртовкой В)электроплиткой Г)водяной баней
11)При наличии у реактива ядовитых свойств на тару с ним наклеивают этикетку: А)красного цвета Б)желтого цвета В)голубого цвета Г)зеленого цвета
12)В спиртовках можно использовать только:А)бензин Б)керосин В)зтанол Г)глицерин
Водород
Степени окисления
Получение
Химические свойства
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых выше, чем у водорода:
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
Na + H2 → NaH (гидрид натрия)
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
Кристаллогидраты
В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует вычесть кристаллизационную воду и найти массу безводного сульфата калия.
Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
В разбавленных растворах пероксид водорода легко разлагается:
Также перекись проявляет окислительные свойства:
Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки, предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Более слабые восстановители чем водород
Химические свойства водорода
При обычных условиях молекулярный водород сравнительно мало активен, непосредственно соединяясь лишь с наиболее активными из неметаллов (с фтором, а на свету и с хлором). Однако при нагревании он вступает в реакции со многими элементами.
Водород вступает в реакции с простыми и сложными веществами.
При взаимодействии водорода с неметаллами образуются летучие водородные соединения. В химической формуле летучего водородного соединения, атом водорода может стоять как на первом так и на втором месте, в зависимости от местонахождения в ПСХЭ
Гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода:
Рассмотрим более подробно некоторые реакции:
1). При взаимодействии (в/д) с кислородом образуется вода:
2). При взаимодействии (в/д) с галогенами образуется галогеноводороды, например:
3). При взаимодействии (в/д) с азотом образуется аммиак:
лишь на катализаторе и при повышенных температуpax и давлениях.
4). При взаимодействии (в/д) с серой образуется сероводород:
значительно труднее с селеном и теллуром.
5). При в/д с чистым углеродом водород может реагировать без катализатора только при высоких температуpax:
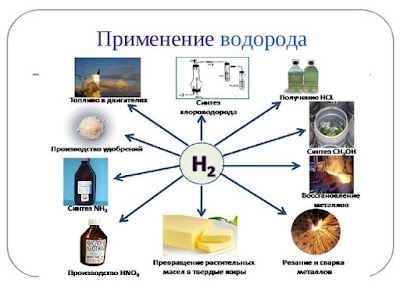
В настоящее время водород получают в огромных количествах. Очень большую часть его используют при синтезе аммиака, гидрогенизации жиров и при гидрировании угля, масел и углеводородов. Кроме того, водород применяют для синтеза соляной кислоты, метилового спирта, синильной кислоты, при сварке и ковке металлов, а также при изготовлении ламп накаливания и драгоценных камней. В продажу водород поступает в баллонах под давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной надписью «Водород».
Водород используется для превращения жидких жиров в твердые (гидрогенизация), производства жидкого топлива гидрогенизацией углей и мазута. В металлургии водород используют как восстановитель оксидов или хлоридов для получения металлов и неметаллов (германия, кремния, галлия, циркония, гафния, молибдена, вольфрама и др.).
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
Задание №1
Составьте уравнения реакций взаимодействия водорода со следующими веществами: Br2, Mg, Al2O3, оксидом ртути (II), оксидом вольфрама (VI). Назовите продукты реакции, укажите типы реакций.
Задание №3.
Вычислите массу воды, которую можно получить при сжигании 4 г водорода?