Блокада при панкреатите что
Современные возможности терапии хронического панкреатита
Хронический панкреатит — длительно протекающее воспалительное заболевание поджелудочной железы, проявляющееся необратимыми морфологическими изменениями, которые вызывают боль и/или стойкое снижение функции поджелудочной железы. При хроническом панкреатит
Хронический панкреатит — длительно протекающее воспалительное заболевание поджелудочной железы, проявляющееся необратимыми морфологическими изменениями, которые вызывают боль и/или стойкое снижение функции поджелудочной железы. При хроническом панкреатите морфологические изменения поджелудочной железы сохраняются после прекращения воздействия этиологического агента. В настоящее время распространенность хронического панкреатита, по данным аутопсий, составляет от 0,01 до 5,4%, в среднем — 0,3-0,4%, при этом за последние 40 лет заболеваемость выросла примерно в два раза, что связывают с тем, что население стало употреблять больше алкогольных напитков, а также с воздействием вредных факторов окружающей среды (см. диаграмму 1).
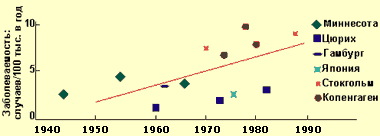 |
| Диаграмма 1. Заболеваемость ХП в 1945—1985 гг. (Worning H., 1990) |
В патогенезе хронического панкреатита важную роль играют несколько факторов. Одним из основных является обструкция главного панкреатического протока при конкрементах, воспалительном стенозе или опухолях. При алкогольном панкреатите повреждение поджелудочной железы связано с повышением содержания белка
в панкреатическом секрете, что приводит к возникновению белковых пробок и обструкции мелких протоков железы. Другим фактором, влияющим на патогенез алкогольного панкреатита, является изменение тонуса сфинктера Одди: его спазм вызывает внутрипротоковую гипертензию, а релаксация способствует рефлюксу дуоденального содержимого и внутрипротоковой активации панкреатических ферментов.
Разрушение экзокринной части поджелудочной железы вызывает прогрессирующее снижение секреции бикарбонатов и ферментов, однако клинические проявления нарушения переваривания пищи развиваются лишь при деструкции более 90% паренхимы органа. В первую очередь возникают проявления недостаточности липазы в виде нарушения всасывания жиров, жирорастворимых витаминов: A, D, E и K, что нечасто проявляется поражением костей, расстройствами свертывания крови. У 10–30% больных хроническим панкреатитом развивается сахарный диабет, обычно на поздних стадиях заболевания, нарушение толерантности в глюкозе наблюдается гораздо чаще. Для таких больных характерно развитие гипогликемических реакций на инсулин, недостаточное питание или злоупотребление алкоголем. Кетоацидоз развивается редко, что связано с одновременным снижением продукции инсулина и глюкагона.
Приступ хронического панкреатита проявляется иррадиирующими в спину болями в верхней половине живота, развивающимися после приема пищи, которые могут продолжаться в течение многих часов или нескольких дней. Нередко наблюдается тошнота, рвота, у 30–52% пациентов — снижение веса, у 16–33% — желтуха. Преходящая желтуха возникает вследствие отека железы при обострениях хронического панкреатита, постоянная — связана с обструкцией общего желчного протока вследствие фиброза головки поджелудочной железы. При разрывах протоков поджелудочной железы, на месте предыдущего некроза ткани происходит скопление секрета, что приводит к формированию псевдокист. Кисты могут быть бессимптомными или вызывать боли в верхней половине живота. При длительном течении заболевания, при уменьшении объема функционирующей паренхимы до 10% от нормы появляются признаки мальабсорбции (полифекалия, жирный стул, похудание).
В течении хронического панкреатита можно выделить несколько стадий (Lankisch P.G., Moessner Y.), умение различать которые важно для правильного подбора терапии. Так, на первой стадии заболевания клиническая симптоматика отсутствует: в этот период характерные для ХП изменения данных КТ или ЭРХПГ выявляются лишь при случайном обследовании.
На второй стадии возникают начальные проявления, характеризующиеся частыми эпизодами обострения ХП (которые могут быть ошибочно расценены как острый панкреатит). Заболевание видоизменяется от повторных приступов боли в животе до постоянных умеренных болей и похудания. С течением времени рецидивы становятся менее тяжелыми, но симптоматика сохраняется в периоды между приступами. На этой стадии может существенно ухудшаться качество жизни. Вторая стадия обычно продолжается на протяжении четырех—семи лет. Иногда заболевание быстро прогрессирует, развивается атрофия ПЖ, и нарушается функция органа.
У больных на третьей стадии постоянно присутствует симптоматика ХП, прежде всего — абдоминальная боль. Пациенты могут стать зависимыми от анальгетиков, значительно сокращают объем принимаемой пищи из-за опасения усиления боли. Появляются признаки экзокринной и эндокринной панкреатической недостаточности.
Особенность панкреатита на четвертой стадии — это атрофия ПЖ, развитие экзокринной и эндокринной недостаточности, что проявляется стеатореей, похуданием и сахарным диабетом. Снижается интенсивность боли, прекращаются острые приступы заболевания, могут развиваться тяжелые системные осложнения ХП и аденокарцинома поджелудочной железы.
Терапия панкреатита проводится по нескольким направлениям: отказ от употребления алкоголя; соблюдение диеты с низким содержанием жира (до 50–75 г/сут) и частым приемом небольших количеств пищи; купирование боли; ферментная заместительная терапия, борьба с витаминной недостаточностью; лечение эндокринных нарушений.
Лечение приступа хронического панкреатита, а также острого панкреатита проводиться по аналогичной схеме. Обязательные компоненты терапии: внутривенное введение растворов электролитов и коллоидов, голодная диета (полное голодание до двух дней) и анальгезия (например, меперидин). Рекомендуется введение свежезамороженной плазмы или альбумина. Диуретики не показаны большинству больных: олигурия разрешается при исчезновении гиповолемии и нормализации перфузии почек. Для облегчения рвоты, купирования пареза желудочно-кишечного тракта и уменьшения стимуляции поджелудочной железы может быть использована аспирация содержимого желудка через назогастральный зонд. Коагулопатия, возникающая при панкреатите, обычно требует назначения гепарина, свежей плазмы. В последние годы при остром панкреатите показана эффективность антагониста тромбоцит-активирующего фактора лексипафанта (60–100 мг/сут), однако его действие при хроническом панкреатите еще нуждается в уточнении.
Применение ингибиторов протеолитических ферментов (например, апротинина, габексата) является спорным. Исследования показывают, что при остром панкреатите не наблюдается дефицита ингибиторов протеаз, кроме того, проведенные клинические исследования не выявили преимуществ этих препаратов по сравнению с плацебо. Однако существуют данные, что габексат, низкомолекулярный ингибитор трипсина, эффективно используется для профилактики развития острого панкреатита, связанного с ЭРХПГ.
Ингибиторы секреции поджелудочной железы: глюкагон, соматостатин, кальцитонин, ингибиторы карбоангидразы, вазопрессин, изопреналин, также было предложено применять для лечения острого панкреатита, однако их эффективность к настоящему времени не получила достаточного подтверждения. Препараты пищеварительных ферментов можно использовать для лечения как в разгар заболевания с целью подавления панкреатической секреции, так и в период выздоровления, когда пациент снова получает возможность принимать пищу орально.
При билиарном обструктивном панкреатите должна быть проведена своевременная эндоскопическая декомпрессия желчных путей. Выполняется папиллосфинктеротомия, дилатация или стентирование панкреатического протока. Хирургическое лечение обструктивного панкреатита, безусловно, является основным методом, в то же время целесообразность проведения вмешательства в первые сутки после развития тяжелого приступа должна быть признана спорной. После стихания остроты воспаления целесообразно проведение холецистэктомии.
Схему длительной терапии при хроническом панкреатите можно разделить на две основные части, в соответствии с ведущими клиническими синдромами (см. диаграмму 2).
Боль могут облегчить большие дозы панкреатических ферментов. Попадание ферментов поджелудочной железы (прежде всего — трипсина) в двенадцатиперстную кишку по механизму отрицательной обратной связи вызывает снижение панкреатической секреции, снижение внутрипротокового давления и уменьшает боль. Традиционно для этой цели использовались порошок или таблетированные препараты панкреатина.
Если болевой синдром резистентен к терапии, при расширении главного протока более 8 мм, у 70–80% пациентов облегчение может принести латеральная панкреатоеюностомия. В случаях, когда панкреатический проток не расширен, показано проведение дистальной панкреатэктомии (при преимущественном поражении хвоста железы) или операция Уиппла (Whipple) (при поражении в основном головки железы). Альтернативой операции является чрезкожная денервация солнечного сплетения введением алкоголя, однако эффект этой процедуры сохраняется лишь в течение нескольких месяцев. Весьма перспективно эндоскопическое лечение под контролем эндоскопического УЗИ (дренирование псевдокист, невролиз солнечного сплетения).
Показаниями для заместительной терапии экзокринной панкреатической недостаточности являются исключительно клинические показатели: похудание, стеаторея, метеоризм. Классическая рекомендация, предусматривающая определение содержания жира в кале перед назначением лечения, в настоящее время потеряла свое значение из-за трудоемкости и низкой чувствительности данного метода. Для купирования внешнесекреторной панкреатической недостаточности используют различные препараты экстрактов поджелудочной железы (см. таблицу 1).
При выборе препарата для заместительной терапии следует учитывать следующие показатели:
Способность препарата активироваться только в щелочной среде — очень важное свойство, которое резко повышает эффективность ферментов; так, при использовании препарата, имеющего энтеросолюбильную оболочку, всасывание жиров повышается в среднем на 20% по сравнению с такой же дозой обычного средства. Однако при хроническом панкреатите происходит значительное снижение продукции бикарбонатов, что приводит к нарушению щелочной среды в двенадцатиперстной кишке. Это создает несколько проблем. Первая касается нарушения активации частиц ферментного препарата, покрытых энтеросолюбильной оболочкой. Вторая проблема заключается в том, что в кислой среде происходит преципитация желчных солей и нарушение эмульгации жира, что делает его малодоступным для расщепления липазой. Поэтому эффективность ферментной терапии (см. рисунок 1) может быть повышена благодаря одновременному назначению антацидов за 30 мин до и через 1 ч после еды или антисекреторных препаратов (Н2-блокаторы, омепразол), но необходимо помнить, что антациды, содержащие кальций или магний, ослабляют действие ферментных препаратов. Возможно использование препаратов, содержащих протеолитические ферменты растительного происхождения, которые сохраняют активность в гораздо более кислой среде, чем животные.
Значительное снижение качества жизни больного панкреатитом связано с такой проблемой, о которой обычно забывают, как стойкое вздутие живота. Нередко вздутие не купируется даже при приведении заместительной терапии высокими дозами ферментов. В этом случае к проводимой терапии необходимо добавить адсорбенты (симетикон, диметикон) или использовать комбинированные ферментные препараты, содержащие адсорбирующие вещества.
Разовая доза ферментов, которая рекомендуется для лечения внешнесекреторной панкреатической недостаточности, должна содержать не менее 20–40 тыс. ед. липазы. Обычно пациенту назначают две—четыре капсулы препарата (по 20—25 тыс. ед. липазы) при основных приемах пищи и по одной-две капсуле (по 8—10 тыс. ед. липазы) или таблетки панкреатина при употреблении небольшого количества пищи. При клинически выраженной панкреатической недостаточности обычно не удается полностью устранить стеаторею даже с помощью высоких доз препаратов, поэтому критериями адекватности подобранной дозы пищеварительных ферментов являются: прибавка веса, нормализация стула (менее трех раз в день), снижение вздутия живота.
Причины неэффективности заместительной терапии могут быть связаны как с неточной диагностикой заболевания, так и с неадекватным назначением терапии больному (см. рисунок 2).
Побочные эффекты ферментной терапии (см. рисунок 3) обычно не носят тяжелого характера, наиболее известный опасный побочный эффект — развитие фиброзирующей колопатии — возникает при длительном приеме очень высоких доз ферментов в виде микротаблеток: более 50 тыс. ед. липолитической активности на 1 кг веса тела в сутки.
Таким образом, терапия хронического панкреатита должна проводиться дифференцированно, в зависимости от ведущего клинического синдрома и стадии заболевания. Заболевание, которое удается обнаружить на первой стадии, как правило, не требует медикаментозной коррекции, в этом случае обычно достаточно изменения образа жизни и диетотерапии. Лечение ХП на второй стадии включает назначение таблетированного панкреатина, антисекреторных препаратов и спазмолитиков. Третья стадия обычно требует использования всего арсенала средств, которые имеются у врача для купирования панкреатической боли: микрогранулы панкреатина, антисекреторные препараты, октреотид, спазмолитики, мощные анальгетики, психотропные препараты. На последней, четвертой, стадии лечение основывается, прежде всего, на использовании микрогранул панкреатина в высокой дозе с целью проведения заместительной терапии.
По вопросам литературы обращайтесь в редакцию
А. В. Охлобыстин, кандидат медицинских наук
Э. Р. Буклис, кандидат медицинских наук
ММА им. И. М. Сеченова, Москва
Продленная эпидуральная блокада в комплексной интенсивной терапии тяжелого острого панкреатита
1 ГБУЗ «Городская клиническая больница №23 «Медсантруд».
2 ГБОУ ВПО «Первый московский государственный медицинский университет им. И. М. Сеченова» МЗ РФ.
Проспективное исследование, включившее 220 пациентов с тяжелым острым панкреатитом, 105 из которых проводилась продленная эпидуральная блокада (ЭБ) 0,2% р-ром ропивакаина на протяжении 3—7 сут. Остальные пациенты составили контрольную группу. Продленная ЭБ способствовала снижению внутрибрюшного давления, позволяла на 2—3 сут раньше начать энтеральное питание. У пациентов группы ЭБ было отмечено меньшее количество легочных осложнений в сравнении с контрольной группой: 15,6 и 23,5% соответственно. Общее количество гнойных интраабдоминальных осложнений на фоне ЭБ составило 20,0%, в контрольной группе — 51,3%. Проведение продленной ЭБ способствовало сокращению сроков пребывания в отделении реанимации и в клинике в целом. Летальность в группе ЭБ составила 11,4%, в контрольной группе — 15,6%. Применение на ранних сроках тяжелого острого панкреатита продленной ЭБ в качестве компонента интенсивной терапии приводит к уменьшению частоты жизнеугрожающих осложнений и летальности.
Ключевые слова: продленная эпидуральная блокада, тяжелый острый панкреатит.
Интенсивная терапия пациентов с тяжелым острым панкреатитом (ОП) и панкреонекрозом (ПН) представляет собой сложную комплексную проблему. Течение данного заболевания характеризуется частым развитием жизнеугрожающих осложнений и высокой летальностью. Несмотря на совершенствование методов лечения, частота летальных исходов при данной нозологии остается в пределах 15—30% [1—4]. Основными причинами летальности являются инфекционные осложнения и развитие полиорганной недостаточности [5, 6]. В ряде случаев необратимая органная недостаточность развивается уже в ранние сроки заболевания (в течение 72 ч), при этом летальность достигает 40—60% [7, 8].
В Москве на протяжении ряда лет пациенты с ОП занимают 3-е место (25%) в структуре острой абдоминальной хирургической патологии после острого аппендицита и острого холецистита [9].
При этом также отмечается рост больных с инфицированным ПН, что повышает послеоперационную и общую летальность [10, 11].
По мнению большинства специалистов, основной причиной смерти является развитие инфекционных осложнений. В то же время прогрессирующая полиорганная недостаточность (ПОН) определяет от 20 до 50% всех летальных исходов [3]. В последние годы синдром системной воспалительной реакции (ССВР) рассматривается как ключевой фактор системного повреждения органов и тканей при тяжелом ОП [12, 13]. Раннее (в течение 1-й нед заболевания) формирование ПОН обычно является следствием стерильного ПН. Считается, что неконтролируемый системный воспалительный гиперответ основной патофизиологический механизм, определяющий исход на ранней стадии заболевания, позднее основную роль играет инфицирование поджелудочной железы.
На сегодняшний день интенсивная терапия ОП и ПН основывается на последних международных рекомендациях [14], разработанных Международной ассоциацией панкреатологии (IAP) и Американской панкреатической ассоциацией (APA). Современные рекомендации предусматривают использование в лечении ОП методов, основанных на доказательной медицине. Несмотря на большое количество исследований, проведенных за последние 30 лет, консенсус экспертов признает, что в настоящий момент отсутствует специфическая терапия ОП [15].
В частности, данные доказательной медицины указывают на то, что назначение антисекреторных препаратов и ингибиторов протеаз не оказывает существенного влияния на состояние пациентов с тяжелым ОП. Основой современной терапии ОП и ПН являются: коррекция водно-электролитных расстройств и гликемии, анальгезия, коррекция органной дисфункции, антибиотикотерапия, энтеральное питание. Принципиально важно раннее начало энтерального питания, что позволяет сохранить функциональную активность энтероцитов и предупредить развитие ряда серьезных осложнений.
Продленная эпидуральная блокада (ЭБ)1 достаточно давно используется в качестве компонента интенсивной терапии ОП и ПН. Более того, приказ Департамента здравоохранения Москвы №320 от 13.04.2011 «О единой тактике диагностики и лечения острых хирургических заболеваний органов брюшной полости …» (первичная редакция — аналогичный приказ №181 от 22.04.2005) в разделе «острый панкреатит» указывает на необходимость проведения продленной эпидуральной анальгезии ропивакаином или бупивакаином в комплексной терапии пациентов с данной патологией.
Парадокс заключается в том, что в литературе практически отсутствуют клинические исследования, оценивающие эффективность применения продленной ЭБ при данной патологии.
Поиск в международной электронной базе данных «PubMed» по ключевым словам «тяжелый панкреатит, эпидуральная анальгезия» позволил найти 28 источников, из которых только 2 освещают опыт клинического применения ЭБ, остальные же имеют исключительно экспериментальный характер.
Данное обстоятельство и явилось мотивом предпринятого нами исследования.
Цель работы — оценка влияния эпидуральной блокады на течение острого периода тяжелого панкреатита, а также на выживаемость пациентов.
Материалом для проспективного клинического исследования явились результаты лечения 220 больных с различными формами тяжелого острого панкреатита в возрасте от 18 до 80 лет, госпитализированных в клинику на различных сроках заболевания и находившихся в отделении реанимации и интенсивной терапии ГКБ № 23 «Медсантруд» г. Москвы с 2006 по 2012 г.
Критерии включения больных в исследование: • клиническая картина острого тяжелого панкреатита;
Критерии исключения больных из исследования:
С учетом схемы терапии, тяжести течения и особенностей клинической картины ОП, больные были разделены на следующие группы:
1-я группа (основная) — 105 (47,7%) пациентов, в лечении которых наряду с традиционными методами проводилась продленная ЭБ 0,2% раствором ропивакаина и раннее энтеральное питание (ЭП). Уровень катетеризации эпидурального пространства — Th8—9, скорость инфузии ропивакаина — 5—8 мл/ч (10—16 мг/ч), длительность ЭБ определялась сроками пребывания пациента в отделении реанимации (в среднем от 3 до 7 сут).
2-я группа (контрольная) — 115 (52,3%) пациентов, которым продленная ЭБ по тем или иным причинам не проводилась. Сроки начала ЭП у этих больных зависели от клинической ситуации.
В свою очередь в обеих группах были выделены 2 подгруппы в зависимости от клинической формы ОП (по МКБ — 10):
1. Острый панкреатит, отечная форма — 56 (25,5%) пациентов в 1-й группе и 52 (23,6%) во 2-й группе.
2. Острый панкреатит, деструктивная форма — 49 (22,3%) пациентов в 1-й группе и 63 (28,6%) во 2-й группе.
Большую часть пациентов в основной и контрольной группах составляли мужчины. В 1-й группе мужчин было 73 (69,5%), а в контрольной группе — 76 (66,1%). В основной группе средний возраст больных колебался от 18 до 80 лет и составил 54±2,8 года. Возраст больных в контрольной группе варьировал от 20 до 80 лет, что в среднем составило 56±2,3 года. В контрольной группе больных старше 75 лет было 8, что составило 7%, а в основной группе — 10 (9,6%).
Подавляющее число пациентов с ОП (84,2%) были госпитализированы в течение первых 2 сут от начала проявления болезни.
Оценка степени тяжести больных тяжелым ОП проводилась по классическим шкалам: APACHE II, SAPS, Ranson. У 18 (17,1%) больных основной и 23 (20,0%) контрольной группы общее состояние при госпитализации по шкале SAPS было расценено как легкой степени. Большинство пациентов госпитализированы в состоянии средней тяжести — 63 (60%) в основной и 63 (54,8%) в контрольной группе. У 24 пациентов (22,9%) основной и у 29 (25,2%) контрольной группы состояние при госпитализации определено как тяжелое.
У всех больных проведен стандартный комплекс диагностического и клинико-лабораторного обследования. Для динамической оценки болевого синдрома использовали 10-балльную визуальноаналоговую шкалу (ВАШ).
Центральную гемодинамику и объемные показатели сердца (давление в легочной артерии, минутный объем кровообращения (МОК), объемы левого предсердия и левого желудочка, сердечный выброс, общее периферическое сосудистое сопротивление (ОПСС) оценивали при помощи метода импедансной кардиографии и ЭХО-КГ, аппаратами «Niccomo» фирмы «Medis» (Германия) и «Voluson E8» фирмы «General Electric» (США).
Внутрибрюшное давление (ВБД) определялось не менее 4 раз в сут всем больным с помощью системы «Urometer Safeti Plus», подсоединенной к уретральному катетеру Фоллея, введенному в мочевой пузырь больного. Снижение ВБД до величин, приближенных к физиологическим, позволяло начинать ЭП сбалансированными смесями через ранее установленный назоинтестинальный зонд в тощую кишку. В желудок устанавливали зонд для эвакуации отделяемого и контроля моторно-эвакуаторной функции ЖКТ.
Статистический анализ данных проводился при помощи лицензионного пакета программ Statistica (версия 6.1. фирмы StatSoft Inc.). Для оценки статистической значимости различий между сравниваемыми группами применяли параметрический критерий Стьюдента (t-критерий) и непараметрический критерий Манна-Уитни (U-критерий).
Однородность дисперсий оценивали с применением теста Фишера. Корреляционный анализ осуществлен методом Спирмена с расчетом коэффициента ранговой корреляции (r) и вычислением его средней ошибки.
Результаты и обсуждение
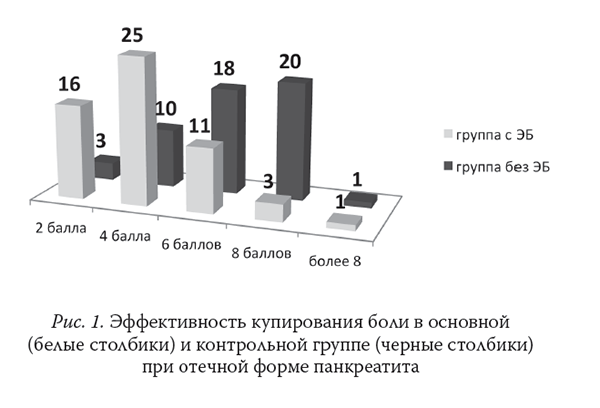
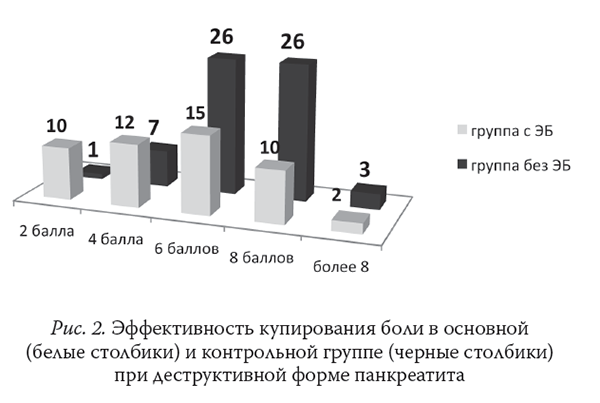
Выраженность болевого синдрома по ВАШ в группах с отечной и деструктивной формами ОП представлена на рис. 1 и 2.
Проведение интенсивной терапии у больных с тяжелым ОП требует обязательного динамического контроля центральной гемодинамики. В результате проведенного исследования выявлено, что наиболее проблемным являлось проведение ЭБ в 1-е сут интенсивной терапии, на фоне развернутой картины системного воспалительного ответа, когда повышается вероятность развития гипотензии в ответ на введение растворов МА в эпидуральное пространство.
Мониторинг параметров ЦГД показал, что уже на 2-е сут у пациентов основной группы прослеживалась тенденция к увеличению величины сердечного индекса (СИ) от 2,15±0,24 до 2,36± 0,23 л/мин/м2 (р > 0,05) при отечной форме ОП и от 1,57±0,23 до 1,92±0,24 л/мин/м2 (р > 0,05) при деструктивной форме. Кроме этого, на этом фоне определялся рост индекса ОПСС от 1659±119 до 1667±218 дин × с/см5 (р > 0,05), что имело компенсаторный характер. К 3-м сут интенсивной терапии в контрольной группе достоверно (р Литература
Регионарная анестезия и лечение острой боли Том IX №1 2015
Консервативное лечение хронического панкреатита в амбулаторных условиях
Хронический панкреатит объединяет гетерогенную группу заболеваний, характеризующихся структурными (морфологическими) и/или функциональными изменениями, несмотря на прекращение воздействия этиологического фактора, с дальнейшим прогрессированием поражения
Хронический панкреатит объединяет гетерогенную группу заболеваний, характеризующихся структурными (морфологическими) и/или функциональными изменениями, несмотря на прекращение воздействия этиологического фактора, с дальнейшим прогрессированием поражения поджелудочной железы и развитием экзокринной и/или эндокринной недостаточности. Морфологическим субстратом хронического панкреатита являются различной степени отек, воспаление и очаговые некрозы ацинарной ткани, развивающиеся на фоне стриктур по ходу панкреатических протоков, белковых пробок и кальцинатов в мелких протоках; псевдокисты, возникающие в период атаки острого панкреатита. Все это приводит к нарушению тока панкреатического сока, внутрипротоковой гипертензии, прогрессированию некроза ацинарной ткани с последующей атрофией ацинусов; интралобулярному и перилобулярному фиброзу поджелудочной железы. При потере 90% функционирующей паренхимы развивается панкреатическая недостаточность, обусловленная синдромом нарушенного переваривания пищи (maldigestion).
На поздних стадиях болезни при очевидной экзокринной недостаточности поджелудочной железы или развитии сахарного диабета диагностика хронического панкреатита не вызывает серьезных затруднений; определенные препятствия возникают на ранних стадиях болезни, когда превалируют функциональные изменения, проявляющиеся наиболее отчетливо в период действия этиологического фактора. Диагностика хронического панкреатита основывается на изучении факторов риска его развития, уточнении возможных этиологических факторов, оценке клинической картины заболевания. Нередко диагноз хронического панкреатита формируется после длительного наблюдения за больным, у которого имеются клинические признаки, позволяющие предположить наличие хронического панкреатита.
В качестве этиологических факторов хронического панкреатита наиболее часто выступают 2 основные причины — алкоголизм и желчнокаменная болезнь, причем 60–70% всех случаев хронического панкреатита обусловлены систематическим, длительным (6–18 лет) приемом алкоголя в дозе более 150 г в день до развития явных признаков заболевания (табл. 1). Частота выявления хронического панкреатита при аутопсии у интенсивно пьющих людей достигает 45–50%. Высокобелковая диета, курение усугубляют повреждающее действие алкоголя. Алкогользависимый панкреатит развивается преимущественно у мужчин и наиболее часто приходится на возраст 35–45 лет. Проведенный ретроспективный анализ историй болезни и последующее проспективное наблюдение за 372 больными позволили оценить течение хронического панкреатита при идиопатическом и алкогольном панкреатитах в зависимости от доз потребляемого алкоголя (менее 50 г/сут и более 50 г/сут) [1]. Показано, что в группе пациентов с алкогольным панкреатитом превалируют абдоминальные боли в начале заболевания. У больных из этой группы чаще развивались осложнения хронического панкреатита: фистулы, псевдокисты, абсцессы, обструктивная желтуха. Отмечено, что у пациентов с дебютом проявлений хронического панкреатита в возрасте старше 35 лет употребление алкоголя даже в небольших дозах (менее 50 г в день) приводит к раннему развитию заболевания, характеризующегося более частыми и интенсивными болями в животе, кальцификацией поджелудочной железы и наличием осложнений. Прием больших количеств алкоголя (50 и более граммов в день) ускоряет формирование кальцифицирующего панкреатита и повышает частоту фатального исхода при хроническом панкреатите.
Хронический панкреатит, развивающийся при желчнокаменной болезни (ЖКБ), холедохолитиазе, чаще встречается у женщин в возрасте 50–60 лет. Как правило, такие больные демонстрируют признаки метаболического синдрома: ожирение, гиперлипидемию, склонность к артериальной гипертензии, ИБС, нарушение толерантности углеводов, гиперурикемию и/или гиперурикозурию и т. д. У части пациентов с хроническим панкреатитом не удается уточнить этиологию заболевания — такой панкреатит относят к группе идиопатического панкреатита.
В зависимости от морфологических изменений в поджелудочной железе выделяют следующие формы хронического панкреатита (1989): кальцифицирующий, обструктивный, фиброзно-индуративный панкреатит, а также кисты и псевдокисты поджелудочной железы. Группу кальцифицирующих панкреатитов представляют алкогольный панкреатит, панкреатит, развивающийся при воздействии органических растворителей, некоторых химических соединений, лекарств, а также панкреатиты, начавшиеся вследствие гиперлипидемии, гиперкальциемии при гиперпаратиреозе, хронических вирусных инфекций (в том числе при хронической HCV- и HBV-инфекции), врожденных изменений протоков поджелудочной железы (удвоение панкреатического протока — pancreas divisum). Наследственный панкреатит с аутосомно-доминантным типом наследования с неполной пенетрацией также относится к группе кальцифицирующего панкреатита и развивается у детей 10–12 лет или в возрасте 30–40 лет. Он неотличим от обычных форм панкреатита, сопровождается рецидивирующими атаками абдоминальной боли, через 8–10 лет у 20% больных присоединяется сахарный диабет и у 15–20% пациентов — выраженная стеаторея. Отсутствие других этиологических факторов и указание на случаи панкреатита в семье делают обоснованным подозрение на наследственную форму хронического панкреатита.
Хронический обструктивный панкреатит развивается при обструкции главного панкреатического протока опухолью поджелудочной железы, воспалении дуоденального сосочка или его стенозе, дуодените вследствие болезни Крона, закрытой травме живота и хирургических операциях в пилородуоденальной зоне, наличии псевдокист поджелудочной железы, врожденной аномалии (pancreas divisum). Желчнокаменная болезнь и холедохолитиаз, дисфункция сфинктера Одди билиарного и панкреатического типов являются основными причинами формирования хронического обструктивного панкреатита.
Уточнение этиологического фактора в развитии хронического панкреатита позволяет более эффективно проводить профилактику и лечение, чем и обусловлено появление следующей классификации хронического панкреатита по этиологическому принципу, с учетом морфологического варианта:
Клинические признаки хронического панкреатита наиболее ярко представлены в период обострения (табл. 2).
 |
| Клинические признаки хронического панкреатита |
Нередко развитию болевой формы хронического панкреатита предшествует безболевая, латентная стадия различной продолжительности, маскирующаяся дискомфортом в эпигастрии, метеоризмом, неустойчивым стулом со склонностью к диарее с наличием непереваренной клетчатки в стуле или стеатореей. Повторные атаки болевой формы хронического панкреатита формируют панкреатическую недостаточность с преимущественным поражением экзокринной или эндокринной функций с развитием сахарного диабета 2 типа.
Болевой синдром — наиболее постоянный признак острого и хронического панкреатита — отмечается в 70–80% случаев и имеет типичные признаки: локализацию в эпигастрии, «опоясывающий» характер с иррадиацией в спину, провоцирующийся и быстро усиливающийся после приема пищи; боли облегчаются в положении сидя с наклоном вперед. Часто сопровождаются тошнотой, рвотой, лихорадкой. У 3–6% больных атаки болевого синдрома могут продолжаться несколько дней; у 70–90% эпизоды болевого синдрома перемежаются безболевым периодом. У части пациентов эквивалентом болей в эпигастрии могут быть боли в спине, иногда сопоставимые с интенсивностью болей в животе. В генезе болевого абдоминального синдрома при хроническом панкреатите основное внимание уделяется внутрипротоковой гипертензии за счет сохраняющейся секреции панкреатических ферментов воспаленной железой в условиях обструкции главных или мелких протоков. Другие факторы — воспаление внутрипанкреатических нервных стволов, перипанкреатическое воспаление с вовлечением двенадцатиперстной кишки, ретроперитонеального пространства, стенозом дистального отдела общего желчного протока — также играют определенную роль в развитии болевого синдрома. У 15% пациентов отмечается безболевая форма заболевания, проявляющаяся у 1/3 больных стеатореей, чаще всего это бывает при хроническом кальцифицирующем панкреатите алкогольной этиологии. Эндокринная функция наиболее чувствительна к воспалительному процессу при хроническом панкреатите и проявляется у 2/3 пациентов нарушением толерантности к глюкозе и сахарным диабетом. В большинстве случаев страдают обе — и экзокринная, и эндокринная — функции, признаки панкреатической недостаточности развиваются при потере 80–90% функционирующей паренхимы поджелудочной железы. В ряде случаев прогрессирующее снижение экзокринной функции приводит к снижению и даже полному исчезновению болевого синдрома.
Данные об эффекте абстиненции на течение алкогольного панкреатита противоречивы: у части пациентов отказ от алкоголя приводит к уменьшению выраженности и частоты болевых атак, признаков экзо- и эндокринной недостаточности, у других отмечается усиление болей через 12–24 ч абстиненции. Течение хронического панкреатита может быть непредсказуемым — прогрессирующим, несмотря на строгую абстиненцию, и довольно стабильным, независимо от того, что прием алкоголя продолжается. В одном наблюдении у 45% пациентов, злоупотребляющих алкоголем, не было клинических симптомов панкреатита, но имелись признаки хронического панкреатита при аутопсии.
Тошнота, рвота, анорексия и потеря массы тела часто отмечаются при хроническом панкреатите. Одной из основных причин снижения веса является уменьшение каллоража принимаемой пищи из-за усиления болей в животе, а также развивающийся синдром нарушенного всасывания вследствие maldigestion и некомпенсированный сахарный диабет. В течении хронического панкреатита синдром нарушенного всасывания с диареей и стеатореей развивается относительно поздно, как правило, на фоне менее 20% функционирующей ацинарной ткани. У части пациентов синдром нарушенного всасывания может протекать с оформленным стулом, что объясняется хорошей всасываемостью воды неизмененной слизистой тонкого кишечника и малым количеством воды в кале. Иногда пациенты отмечают жирные пятна на поверхности воды в унитазе, «жирный», блестящий кал, трудно смываемый со стенок унитаза, что обычно свидетельствует о панкреатической стеаторее. Абсорбция жирорастворимых витаминов A, D, E, K страдает мало, значительный дефицит их редко выявляется при панкреатической недостаточности.
Хотя нарушение толерантности глюкозы случается часто и при хроническом панкреатите проявляется рано, клинически очевидный сахарный диабет встречается относительно поздно. У большинства пациентов диагноз хронического панкреатита устанавливается задолго до развития гипергликемии, однако у части из них, страдающих безболевой формой панкреатита, сахарный диабет может быть первой и единственной манифестацией заболевания. Особенностью течения сахарного диабета при хроническом панкреатите следует считать редкое развитие кетоацидоза, диабетической нефропатии и хорошую переносимость уровня гипергликемии до 200 мг/дл, однако при длительном течении диабета ретинопатия и полинейропатия встречаются с одинаковой для разных вариантов диабета частотой.
Другие клинические проявления хронического панкреатита включают желтуху, обусловленную сдавлением общего желчного протока увеличенной головкой поджелудочной железы, асцит или плевральный выпот в связи с подтеканием панкреатического секрета из разрушенных протоков; псевдокисты. Редко встречаются атипичные варианты хронического панкреатита с развитием липонекрозов подкожной клетчатки или «химического» полиартрита мелких суставов кистей.
Уровень смертности при хроническом панкреатите достигает 50% при 20–25-летнем сроке заболевания. 15–20% пациентов погибают от осложнений, связанных с обострениями панкреатита, другие варианты смерти обусловлены травмой, нарушением питания, инфекцией, курением, которые часто отмечаются у больных хроническим панкреатитом.
Осложнения хронического панкреатита включают синдром нарушенного всасывания, сахарный диабет, псевдокисты, тромбоз портальной или селезеночной вены, стеноз привратника, обструкцию общего желчного протока и опухоль. Аденокарцинома поджелудочной железы развивается в 4% случаев у лиц с более чем 20-летним анамнезом хронического панкреатита.
Диагностика хронического панкреатита достаточно сложна и базируется на 3 основных признаках: характерном анамнезе (болевые приступы, злоупотребление алкоголем), наличии экзокринной и/или эндокринной недостаточности и выявлении структурных изменений поджелудочной железы.
Уровень амилазы, липазы сыворотки чаще остается нормальным или сниженным в период атаки панкреатита, что объясняется уменьшением числа ацинарных клеток, продуцирующих эти ферменты. При сочетании алкогольного панкреатита с алкогольной болезнью печени могут быть выявлены нарушенные функциональные печеночные тесты. В 5–10% случаев хронического панкреатита имеются признаки компрессии внутрипанкреатической части желчного протока, обусловленные отеком или фиброзом головки поджелудочной железы, что сопровождается желтухой, повышением уровня прямого билирубина и щелочной фосфатазы сыворотки.
Нарушение толерантности глюкозы развивается у 2/3 пациентов, сахарный диабет — у 30% больных хроническим панкреатитом.
Экзокринная недостаточность становится явной и легко обнаруживается при развитии синдрома нарушенного всасывания, при котором жир в кале можно определить качественным (окраска по Судану) или количественным методом. Секреторная недостаточность на более ранних этапах выявляется с помощью панкреатических функциональных тестов.
В последние годы в клиническую практику для диагностики хронического панкреатита внедряется иммуноферментный метод определения эластазы-1 в сыворотке крови и кале больных, позволяющий оценить внешнесекреторную функцию поджелудочной железы [4].
Инструментальные данные для подтверждения предположения о наличии хронического панкреатита можно считать довольно информативными. Используются ультразвуковое исследование органов брюшной полости; эндоскопическое ультразвуковое исследование, спиральная компьютерная и магнитно-резонансная томография поджелудочной железы. ЭРХПГ позволяет выявить стеноз протока, локализацию обструкции, структурные изменения мелких протоков, внутрипротоковые кальцинаты и белковые пробки, однако при этом имеется высокий риск развития острого панкреатита [5, 6].
Целью лечения хронического панкреатита можно считать решение нескольких задач: исключение провоцирующих факторов (алкоголь, лекарства, обструкция); облегчение боли; коррекция экзо- и эндокринной недостаточности; лечение сопутствующих расстройств. Основными целями консервативного лечения являются прекращение или замедление прогрессирования хронического панкреатита и борьба с его осложнениями. В зависимости от степени выраженности болевого абдоминального синдрома, используется поэтапное лечение хронического панкреатита, включающее следующие составляющие (модификация Ihse et al.,1993).
При слабом болевом синдроме успеха можно достичь благодаря строгой диете, дробному (каждые 3 ч) приему пищи и ограничению жира до 60 г в день, что способствует снижению панкреатической секреции при низкокалорийной диете. Учитывая тот факт, что основной причиной боли является внутрипротоковая гипертензия, целесообразно использовать лекарства, блокирующие стимулированную панкреатическую секрецию. В норме высвобождение холецистокинина — основного стимулятора экзогенной функции поджелудочной железы — регулируется холецистокинин-релизинг пептидом в проксимальном отделе тонкой кишки, который чувствителен к трипсину и активен в просвете кишки. Назначением панкреатических ферментов (мезим форте, панкреатина, панзинорма, панцитрата ликреазы) обеспечивается значительное облегчение болевого синдрома у части больных за счет включения механизма обратной связи: повышение уровня протеаз в просвете двенадцатиперстной кишки снижает высвобождение и синтез гастроинтестинальных гормонов (холецистокинина), что приводит к снижению стимуляции экзокринной функции поджелудочной железы, уменьшению внутрипротокового и тканевого давления и облегчению боли [7, 8].
Следует помнить о возможности инактивации экзогенных пищеварительных ферментов кислотой желудка и панкреатическими протеазами. Для предотвращения данного эффекта широко используется комбинация ферментов (панкреатин, креон, мезим, панзинорм, фестал, пензитал, энзистал) с H2-гистаминоблокаторами (фамотидин, ранитидин, циметидин, низатидин). Дозы ферментных препаратов для купирования боли должны быть адекватны; в плацебо-контролируемом двойным слепым методом исследовании панкреолипаза в дозе 6 таблеток 4 раза в день в течение 1 мес значительно снижала боль у 75% больных с умеренным и выраженным панкреатитом. Панкреатические ферменты в капсулированной форме, содержащей кислотоустойчивые мини-микросферы (креон), являются в настоящее время препаратами первого выбора в лечении абдоминальной боли в экзокринной недостаточности поджелудочной железы. Микрогранулированные лекарственные формы (креон 10000 или 25000) характеризуются быстрым (через 45 мин) высвобождением более 90% ферментов при pH дуоденального и тонкокишечного содержимого 5,5 и выше. При очень низких значениях pH в желудочно-кишечном тракте используется адъювантная терапия H2-антагонистами или ингибиторами протонной помпы (ланзопразол, омепразол, пантопразол, рабепрозол). Кроме того, показано, что ферментозаместительная терапия улучшает транзит пищи по желудочно-кишечному тракту, воздействуя на моторную функцию ЖКТ и способствуя тем самым снижению нарушений всасывания. Ферменты поджелудочной железы назначают во всех случаях хронического панкреатита для коррекции экзокринной функции поджелудочной железы. Прием этих препаратов уменьшает растяжение кишечника и диарею, обусловленную нарушением всасывания жиров, в связи с чем уменьшаются боли. Ферментные препараты снижают интенсивность болей при хроническом панкреатите средней тяжести, особенно у женщин с обструктивным панкреатитом; на фоне pancreas divisum. У мужчин с алкогольным кальцифицирующим панкреатитом эти препараты значительно менее эффективны. Для купирования стеатореи при хроническом панкреатите показаны препараты с высоким содержанием липазы, покрытые оболочкой; для купирования болей — препараты с высоким содержанием протеаз без оболочки.
При отсутствии эффекта ферментнозаместительной терапии в сочетании с H2-гистаминоблокаторами необходимо назначение анальгетиков, с этой целью могут использоваться также парацетамол (далерон, проходол, эффералган), нестероидные противовоспалительные препараты: диклофенак (апо-дикло, вольтарен, диклофенак, ортофен), ибупрофен (апо-ибупрофен, ибупрофен, ибуфен, солпафлекс), пироксикам (пироксикам, пироксифер, фельден, эразон), целекоксиб (целебрекс), лорноксикам (ксефокам), мелоксикам (мелоксикам, мовалис), нимесулид (месулид, найз, никулид), напроксен (апо-напроксен, налгезин, напроксен). Для купирования болевого синдрома при хроническом панкреатите назначают октреотид (сандостатин). Являясь мощным ингибитором нейроэндокринных гормонов желудочно-кишечного тракта, сандостатин угнетает экзогенностимулированную и эндогенностимулированную экзокринную секрецию поджелудочной железы путем прямого действия на экзокринную ткань и снижает высвобождение секретина и холецистокинина. В многоцентровом исследовании сандостатин в дозе 200 мкг подкожно 3 раза в день в течение 4 нед уменьшал выраженность болевого синдрома у 65% пациентов с хроническим панкреатитом. Препарат также эффективен в лечении псевдокист, панкреатического асцита и плеврита. Мы используем небольшие дозы: 50–100 мкг подкожно 2 раза в день в течение 1 нед для лечения болевой формы хронического панкреатита.
При сохранении болевого синдрома необходимо провести ЭРПХГ для морфологического уточнения характера поражения протоков, исключения дисфункции сфинктера Одди. В этом случае обсуждается возможность использования инвазивных методов лечения: эндоскопического дренирования и шунтирования, блокады солнечного сплетения стероидами, панкреатикоеюностомия и панкреатическая резекция.
Наибольшие трудности связаны с лечением дисфункции сфинктера Одди, одной из причин развития хронического панкреатита, трудной для диагностики. При дисфункции сфинктера Одди отмечается повышенная чувствительность стенки панкреатического и желчного протоков к изменениям объема и давления. Необходимо исключить лекарственные препараты, обладающие холеретическим действием (желчные кислоты, в том числе в составе ферментных препаратов — фестал, энзистал и т. д.; отвары желчегонных трав, синтетические желчегонные средства). Для снятия спазма гладкой мускулатуры сфинктеров Одди и пузырного протока используются нитраты: нитроглицерин — для быстрого купирования болей, нитросорбит — для курсового лечения (под контролем переносимости препаратов).
Миотропные спазмолитики (бендазол, бенциклан, дротаверин, мебеверин, папаверин) снижают тонус и двигательную активность гладкой мускулатуры. Основными представителями данной группы являются папаверин, дротаверин (но-шпа, но-шпа форте, веро-дротаверин, спазмол, спаковин), бенциклан (галидор).
Наиболее эффективным миотропным спазмолитиком является дюспаталин (мебеверин) — мышечнотропный, антиспастический препарат, оказывающий прямое действие на гладкую мускулатуру. Избирательно действуя в отношении сфинктера Одди, он оказывается в 20–40 раз эффективнее папаверина в том, что касается способности релаксировать сфинктер Одди.
Важно то, что дюспаталин не влияет на холинергическую систему и поэтому не вызывает таких побочных эффектов, как сухость во рту, нарушение зрения, тахикардия, задержка мочи, запор и слабость. Он активно метаболизируется при прохождении через печень, все метаболиты быстро выводятся с мочой. Полная экскреция препарата происходит в течение 24 ч после приема однократной дозы, в результате он не накапливается в организме, даже пожилым пациентам не требуется коррекция дозы. Дюспаталин назначают по 1 капсуле (200 мг) 2 раза в день, лучше принимать его за 20 мин до еды.
Другим миотропным спазмолитиком, обладающим селективными свойствами, является гимекромон (одестон) — фенольное производное кумарина, не имеющее свойств антикоагулянтов и оказывающее выраженное спазмолитическое и желчегонное действие. Гимекромон — синтетический аналог умбеллиферона, обнаруженного в плодах аниса и фенхеля, которые применялись как спазмолитические средства. Препарат обеспечивает тот или иной эффект в зависимости от особенностей его действия на различных уровнях билиарного тракта. Одестон вызывает дилатацию желчного пузыря, снижает внутрипротоковое давление и, таким образом, является антагонистом холецистокинина. На уровне сфинктера Одди он действует синергично с холецистокинином, снижает базальное давление и увеличивает длительность открытия сфинктера Одди, увеличивая тем самым пассаж желчи по желчным путям. Будучи высокоселективным спазмолитиком, одестон обладает также желчегонными свойствами. Холеретический его эффект обусловлен ускорением и увеличением поступления желчи в тонкую кишку. Увеличение поступления желчи в просвет двенадцатиперстной кишки способствует улучшению процессов пищеварения, активизации кишечной перистальтики и нормализации стула.
Одестон назначают по 400 мг (2 таблетки) 3 раза в день за 30 мин до приема пищи, что обеспечивает относительно постоянную концентрацию препарата в сыворотке, превышающую 1,0 мкг/мл. Продолжительность лечения индивидуальная — от 1 до 3 нед. Одестон малотоксичен, переносимость его обычно хорошая.
При отсутствии эффекта от консервативной терапии дисфункции сфинктера Одди и наличии данных о его стенозе восстановление проходимости сфинктера Одди проводят оперативным путем (сфинктеротомия).
Заместительная терапия экзокринной панкреатической недостаточности в исходе хронического панкреатита проводится при наличии стеатореи более 15 г жира в сутки, прогрессирующей потере массы тела и диспепсических нарушениях. Разовая доза ферментов должна содержать не менее 20 000–40 000 ед липазы, поэтому его назначают по 2–4 капсулы при основных приемах пищи и по 1–2 капсулы при дополнительных приемах небольшого количества пищи. При клинически выраженной панкреатической недостаточности часто не удается устранить стеаторею полностью. Увеличение массы тела, нормализация стула, снижение метеоризма свидетельствуют об адекватности подобранной дозы пищеварительных ферментов. Неэффективность заместительной терапии требует исключения других причин синдрома нарушенного всасывания — болезни Крона, целиакии, тиреотоксикоза. С целью коррекции питательной недостаточности назначают среднецепочечные триглицериды (трисорбон) и жирорастворимые витамины A, D, E, K.
По вопросам литературы обращайтесь в редакцию.
Т. Н. Лопаткина, кандидат медицинских наук, доцент
ММА им. И. М. Сеченова, Москва