Блокада дофаминовых рецепторов что это
Антипсихотики
Термин «антипсихотики» мне импонирует гораздо больше, чем термин «нейролептики», а тем более «большие транквилизаторы», поскольку первое понятие подразумевает, что основным эффектом этой группы препаратов следует считать не транквилизирующее действие или, «похожее на него, но не седативное», а возможность купирования симптомов психоза.
Все антипсихотики некоторые психиатры делят на четыре группы:
Практически все антипсихотики блокируют рецепторы дофамина, что в основном коррелирует с их влиянием на клинические симптомы психоза (влияние на мезолимбическую и мезокортикальную области мозга) и одновременно вследствие блокады рецепторов дофамина в нигростриарной системе они способны вызывать экстрапирамидную симптоматику.
В наименьшей степени, несмотря на влияние на рецепторы дофамина, экстрапирамидную симптоматику вызывают клозапин и тиоридазин, что обусловлено холинергическим эффектом данных препаратов, который как бы противодействует тому воздействию на дофаминергическую систему, которое провоцирует появление экстрапирамидной симптоматики. Впрочем, по общему влиянию на рецепторы дофамина (от более выраженного, до менее) антипсихотики можно расположить в следующей последовательности:
Все эти медикаменты также подавляют (ингибируют) вызванные апоморфином стереотипии и ажиатацию. Наиболее сильным влиянием на рецепторы дофамина обладает бенперидол, однако, пимозид считается более узко направленным на определенные рецепторы дофамина (более специфичным). Большинство атипичных антипсихотиков обладает «узконаправленным эффектом» по отношению к определенным рецепторам дофамина, в основном влияя на мезолимбическую область, а не на полосатое тело, которое является основной мишенью классических антипсихотиков. Сульпирид почти не вызывает экстрапирамидную симптоматику вследствие «узконаправленного» влияния на лимбические структуры, хотя он и не обладает холинергическим эффектом, противодействующим, как отмечалось выше, появлению экстрапирамидных нарушений.
Помимо влияния на дофаминергическую систему, эти препараты также увеличивают уровень гомованилиновой кислоты в таких структурах мозга как: полосатое тело, добавочные ядра и фронтальная кора. Кроме того, антипсихотики блокируют эффект стимуляции чувствительной к дофамину аденилатциклазы. Атипичные антипсихотики являются слабыми антагонистами эффектам дофамина (влияя на D2 рецепторы незначительно) в отношении стереотипий и не вызывают каталепсию.
Длительный («хронический») прием классических (типичных) антипсихотиков (нейролептиков) способен формировать толерантность к этим препаратам и увеличивать на начальном этапе терапии уровень гомованилиновой кислоты в спинномозговой жидкости, который, в дальнейшем, снижается через несколько недель после лечения нейролептиками. Вероятно, подобная толерантность касается только дофаминовых рецепторов, расположенных в полосатом теле, но не затрагивает мезолимбические и мезокортикальные дофаминергические системы, что, возможно объясняет клинический эффект антипсихотиков по мере их продолжительного приема (ослабление экстрапирамидной симптоматики, при сохранении собственно антипсихотического эффекта).
Клозапин в равной степени влияет как на D1, так и на D2 рецепторы, но обладает особенно выраженным эффектом по отношению к D4 рецепторам. Рисперидон имеет высокую аффиность к D2, D4, 5-HT2 и альфа-адренергическим рецепторам, но слабо влияет на D1 рецепторы.
Интересно отметить, что арипипразол являясь парциальным агонистом D2 и 5НТ1А рецепторов, антагонистом 5-НТ2А рецепторов, обладая при этом умеренно выраженной аффиностью по отношению к гистаминовым и альфа-адренергическим, не влияя на холиергические мускариновые рецепторы.
Зипразидон имеет высокую аффиность к D1, D2 и 5-НТ2А и альфа-адренергическим рецепторам и среднюю аффиность к рецепторам гистамина. Влияние некоторых антипсихотиков на блокаду альфа-1 адренергические рецепторы объясняет их побочные эффекты в отношении сердечно-сосудистой системы (гипотензия, тахикардия) и при этом позитивный седативный эффект.
Дофамин
Дофаминергическая теория патогенеза шизофрении пользовалась популярностью на протяжении последней четверти ХХ века. Представляется значимым познакомить читателя с основными положениями современного учения о дофамине.
Дофамин является не только предшественником норадреналина, но и сам выступает в роле трансмиттера. Локализация дофамина в нервной системе отличается от локализации других катехоламинов: норадреналина и адреналина.
Богатая сеть чувствительных к дофамину рецепторов выявлена во многих структурах центральной нервной системы.
Вся обширная зона срединного возвышения занята дофаминергическими терминалями, и только единичные окончания нервных клеток этой области чувствительны к норадреналину.
 | Для того, чтобы назначить правильное лечение при шизофрении, необходимо провести ее комплексную диагностику |
Нейроны, чувствительные к дофамину, в основном сконцентрированы в следующих структурах: черной субстанции, вентральной покрышке, полосатом теле, обонятельной луковице, гипоталамусе (аркуатное ядро), вокруг желудочков продолговатого мозга (перивентрикулярная область) и сетчатке.
Аксоны нейронов, чувствительных к дофамину, проецируются в лобную кору (окончания рецепторов, чувствительных к дофамину в коре мозга встречаются довольно редко), лимбическую систему, неостриатум, срединное возвышение.
Базальные ганглии состоят из хвостатого ядра и скорлупы (неостриатум), внутреннего и наружного сегментов бледного шара, ретикулярной и компактной частей черной субстанции и субталамического ядра.
Неостриатум считается основной частью базальных ганглиев, получающих информацию от всей коры в соответствии с соматотопической проекцией, а также от интраламинарных ядер таламуса. Информация поступает из базальных ганглиев через внутренний сегмент бледного шара и ретикулярную черную субстанцию, проходит через ядра таламуса (передневентральное и вентролатеральное), которые проецируются на премоторную область коры, дополнительную моторную зону и префронтальную кору. Проекция также распространяется на спинной мозг, особенно педункулопонтинное ядро, принимающее участие в локомоторных актах, а также к верхним бугоркам четверохолмия, принимающим участие в регуляции движений глаз. Базальные ганглии образуют несколько кругов нейронных сетей. В стрианигростриарном круге последнее звено — дофаминергическое. Неостриатум состоит из полос и стриосом, которые содержат небольшое количество ацетилхолинэстеразы (АцхЭ).
Основная масса постсинаптических рецепторов дофамина, как отмечалось выше, сосредоточена в полосатом теле, в области бледного шара и хвостатого ядра. К нейронам этих ядер подходят волокна клеток черной субстанции, в то время как аксоны бледного шара и хвостатого ядра идут в обратном направлении, образуя нигростриатную систему, играющую важную роль в регуляции психических и двигательных реакций.
Дофамин депонируется в крупных пузырьках синапса. После выброса (экзоцитоз) в синаптическую щель он взаимодействует с различными видами рецепторов. Затем инактивируется во внеклеточном пространстве или в клетках глии и, как другие катехоламины, разрушается с помощью двух ферментов — моноаминооксидазы (МАО) и катехол-о-метилтрансферазы (СОМТ). Описано два типа моноамиооксидаз (МАО-А и МАО-В).
В отличие от полосатого тела у префронтальной коры нет переносчиков, дофамина, последние являются белковыми соединениями, осуществляющими обратный захват. Кроме того, по своей структуре они напоминают белковые соединения, представляющие рецепторы серотонина. Белки обратного захвата могут быть блокированы, как в случае применения ингибиторов обратного захвата серотонина, или вообще отсутствовать, как в случае шизофрении в области префронтальной коры. Во всех этих случаях ферменты (СОМТ), расщепляющие нейротрансмиттеры начинают играть крайне важную роль. Таким образом, не подлежит сомнению влияние СОМТ на активность дофамина в области префронтальной коры.
Результаты исследований, проводимых на животных, показали, что СОМТ участвует в расщеплении более 60% дофамина, находящегося в области префронтальной коры. Подчеркнем, что дофамин префронтальной коры принимает участие в когнитивных процессах. Усиление активности дофамина в префронтальной коре, согласно исследованиям, проведенным на больных, страдающих болезнью Паркинсона, способствует улучшению когнитивных функций. Получается, что дофамин позволяет как бы сконцентрировать большую часть энергии в тех областях мозга, которые участвуют в обработке информации. Нарушение трансмиссии дофамина приводит к дефициту внимания.
В катехоламинергических нейронах и их аксонах доминирует МАО-В. Часть неразрушенного медиатора с помощью захвата специальной транспортной системой переносится обратно в окончание рецептора (внутринейрональный метаболизм) и может быть использована повторно.
Рецепторы, чувствительные к дофамину, представляют собой медленные метаботропные рецепторы. Длинная полипептидная цепь семь раз пересекает мембрану, гликозилированный N-конец обращен во внеклеточное пространство, а С-конец находится в цитоплазме. Рецепторы дофамина через G-белки сопряжены с аденилатциклазой.
Дофаминовые рецепторы могут быть локализованы как пост-, так и пре- синаптически, в частности, на норадренергических и дофаминергических нервных окончаниях, контролируя таким образом высвобождение медиаторов. Так, например, пресинаптические рецепторы D3 типа, могут регулировать выброс дофамина.
Выделяют четыре основных восходящих дофаминергических тракта:
Первый нигростриатный путь начинается от нейронов черной субстанции (substantia nigra), ядра А9 (в зависимости от рострокаудальной локализации катехоламиновые нейроны классифицированы от А1 до А15). Аксоны нейронов, расположенных в черной субстанции, простираются до дорсальной части тела стриатума (corpus striatum). Нигростриатный путь имеет отношение к регуляции (координации) моторных (сенсомоторных) функций организма, когнитивной интеграции, формированию стереотипных действий и инициации двигательных актов, а блокада дофаминовой трансмиссии в этом тракте нейролептиками проявляется симптомами паркинсонизма.
Нигростриатный путь
Второй дофаминергический путь — мезолимбический — формируется от нейронов вентрального поля покрышки (А10) и идет к структурам лимбической области: прилежащему ядру, обонятельным луковицам, миндалине, периформной коре.
Третий — мезокортикальный начинается также от А10, но направляется к префронтальной коре.
Согласно одной из гипотез патогенеза шизофрении, начало болезни обусловлено снижением активности дофаминергической мезокортикальной системы, тогда как продуктивные симптомы психоза возникают в связи с усилением активности дофаминергической мезолимбической системы (возможно, и кортиколимбической)
Мезокортикальный тракт
Четвертый тубероинфундибулярный путь идет от ядер покрышки к гипоталамусу.
В таблице 10 в общем виде отражена роль дофаминергических трактов в патогенезе некоторых клинических симптомов шизофрении.
Таблица 10. Роль дофаминергических трактов в патогенезе симптомов шизофрении
Дофамин
Дофаминергическая теория патогенеза шизофрении пользовалась популярностью на протяжении последней четверти ХХ века. Представляется значимым познакомить читателя с основными положениями современного учения о дофамине.
Дофамин является не только предшественником норадреналина, но и сам выступает в роле трансмиттера. Локализация дофамина в нервной системе отличается от локализации других катехоламинов: норадреналина и адреналина.
Богатая сеть чувствительных к дофамину рецепторов выявлена во многих структурах центральной нервной системы.
Вся обширная зона срединного возвышения занята дофаминергическими терминалями, и только единичные окончания нервных клеток этой области чувствительны к норадреналину.
 | Для того, чтобы назначить правильное лечение при шизофрении, необходимо провести ее комплексную диагностику |
Нейроны, чувствительные к дофамину, в основном сконцентрированы в следующих структурах: черной субстанции, вентральной покрышке, полосатом теле, обонятельной луковице, гипоталамусе (аркуатное ядро), вокруг желудочков продолговатого мозга (перивентрикулярная область) и сетчатке.
Аксоны нейронов, чувствительных к дофамину, проецируются в лобную кору (окончания рецепторов, чувствительных к дофамину в коре мозга встречаются довольно редко), лимбическую систему, неостриатум, срединное возвышение.
Базальные ганглии состоят из хвостатого ядра и скорлупы (неостриатум), внутреннего и наружного сегментов бледного шара, ретикулярной и компактной частей черной субстанции и субталамического ядра.
Неостриатум считается основной частью базальных ганглиев, получающих информацию от всей коры в соответствии с соматотопической проекцией, а также от интраламинарных ядер таламуса. Информация поступает из базальных ганглиев через внутренний сегмент бледного шара и ретикулярную черную субстанцию, проходит через ядра таламуса (передневентральное и вентролатеральное), которые проецируются на премоторную область коры, дополнительную моторную зону и префронтальную кору. Проекция также распространяется на спинной мозг, особенно педункулопонтинное ядро, принимающее участие в локомоторных актах, а также к верхним бугоркам четверохолмия, принимающим участие в регуляции движений глаз. Базальные ганглии образуют несколько кругов нейронных сетей. В стрианигростриарном круге последнее звено — дофаминергическое. Неостриатум состоит из полос и стриосом, которые содержат небольшое количество ацетилхолинэстеразы (АцхЭ).
Основная масса постсинаптических рецепторов дофамина, как отмечалось выше, сосредоточена в полосатом теле, в области бледного шара и хвостатого ядра. К нейронам этих ядер подходят волокна клеток черной субстанции, в то время как аксоны бледного шара и хвостатого ядра идут в обратном направлении, образуя нигростриатную систему, играющую важную роль в регуляции психических и двигательных реакций.
Дофамин депонируется в крупных пузырьках синапса. После выброса (экзоцитоз) в синаптическую щель он взаимодействует с различными видами рецепторов. Затем инактивируется во внеклеточном пространстве или в клетках глии и, как другие катехоламины, разрушается с помощью двух ферментов — моноаминооксидазы (МАО) и катехол-о-метилтрансферазы (СОМТ). Описано два типа моноамиооксидаз (МАО-А и МАО-В).
В отличие от полосатого тела у префронтальной коры нет переносчиков, дофамина, последние являются белковыми соединениями, осуществляющими обратный захват. Кроме того, по своей структуре они напоминают белковые соединения, представляющие рецепторы серотонина. Белки обратного захвата могут быть блокированы, как в случае применения ингибиторов обратного захвата серотонина, или вообще отсутствовать, как в случае шизофрении в области префронтальной коры. Во всех этих случаях ферменты (СОМТ), расщепляющие нейротрансмиттеры начинают играть крайне важную роль. Таким образом, не подлежит сомнению влияние СОМТ на активность дофамина в области префронтальной коры.
Результаты исследований, проводимых на животных, показали, что СОМТ участвует в расщеплении более 60% дофамина, находящегося в области префронтальной коры. Подчеркнем, что дофамин префронтальной коры принимает участие в когнитивных процессах. Усиление активности дофамина в префронтальной коре, согласно исследованиям, проведенным на больных, страдающих болезнью Паркинсона, способствует улучшению когнитивных функций. Получается, что дофамин позволяет как бы сконцентрировать большую часть энергии в тех областях мозга, которые участвуют в обработке информации. Нарушение трансмиссии дофамина приводит к дефициту внимания.
В катехоламинергических нейронах и их аксонах доминирует МАО-В. Часть неразрушенного медиатора с помощью захвата специальной транспортной системой переносится обратно в окончание рецептора (внутринейрональный метаболизм) и может быть использована повторно.
Рецепторы, чувствительные к дофамину, представляют собой медленные метаботропные рецепторы. Длинная полипептидная цепь семь раз пересекает мембрану, гликозилированный N-конец обращен во внеклеточное пространство, а С-конец находится в цитоплазме. Рецепторы дофамина через G-белки сопряжены с аденилатциклазой.
Дофаминовые рецепторы могут быть локализованы как пост-, так и пре- синаптически, в частности, на норадренергических и дофаминергических нервных окончаниях, контролируя таким образом высвобождение медиаторов. Так, например, пресинаптические рецепторы D3 типа, могут регулировать выброс дофамина.
Выделяют четыре основных восходящих дофаминергических тракта:
Первый нигростриатный путь начинается от нейронов черной субстанции (substantia nigra), ядра А9 (в зависимости от рострокаудальной локализации катехоламиновые нейроны классифицированы от А1 до А15). Аксоны нейронов, расположенных в черной субстанции, простираются до дорсальной части тела стриатума (corpus striatum). Нигростриатный путь имеет отношение к регуляции (координации) моторных (сенсомоторных) функций организма, когнитивной интеграции, формированию стереотипных действий и инициации двигательных актов, а блокада дофаминовой трансмиссии в этом тракте нейролептиками проявляется симптомами паркинсонизма.
Нигростриатный путь
Второй дофаминергический путь — мезолимбический — формируется от нейронов вентрального поля покрышки (А10) и идет к структурам лимбической области: прилежащему ядру, обонятельным луковицам, миндалине, периформной коре.
Третий — мезокортикальный начинается также от А10, но направляется к префронтальной коре.
Согласно одной из гипотез патогенеза шизофрении, начало болезни обусловлено снижением активности дофаминергической мезокортикальной системы, тогда как продуктивные симптомы психоза возникают в связи с усилением активности дофаминергической мезолимбической системы (возможно, и кортиколимбической)
Мезокортикальный тракт
Четвертый тубероинфундибулярный путь идет от ядер покрышки к гипоталамусу.
В таблице 10 в общем виде отражена роль дофаминергических трактов в патогенезе некоторых клинических симптомов шизофрении.
Таблица 10. Роль дофаминергических трактов в патогенезе симптомов шизофрении
Метаболические эффекты антипсихотиков
Первый нейролептик — хлорпромазин — совершил переворот в психиатрии: оказалось, что психические заболевания можно так же, как все другие, лечить фармакологическими препаратами. Насколько это эффективно и какой ценой даются улучшения, предстояло увидеть только спустя время. Нередко первый в своем классе препарат признают со временем устаревшим, потому что синтезируются его аналоги, более действенные и с меньшим количеством побочных эффектов.
Хлорпромазина эта закономерность не коснулась, и самый первый типичный нейролептик все еще выглядит достойно среди конкурентов, но едва ли потому, что его первооткрывателям повезло сразу наткнуться на препарат с оптимальными свойствами. Разные механизмы действия, разные оттенки эффекта, но едва ли фармакология нейролептиков за много лет сдвинулась с мертвой точки: если новый препарат лучше переносится, слабее оказывается его эффект; если отличается лучшим эффектом — больше будет эффектов побочных.
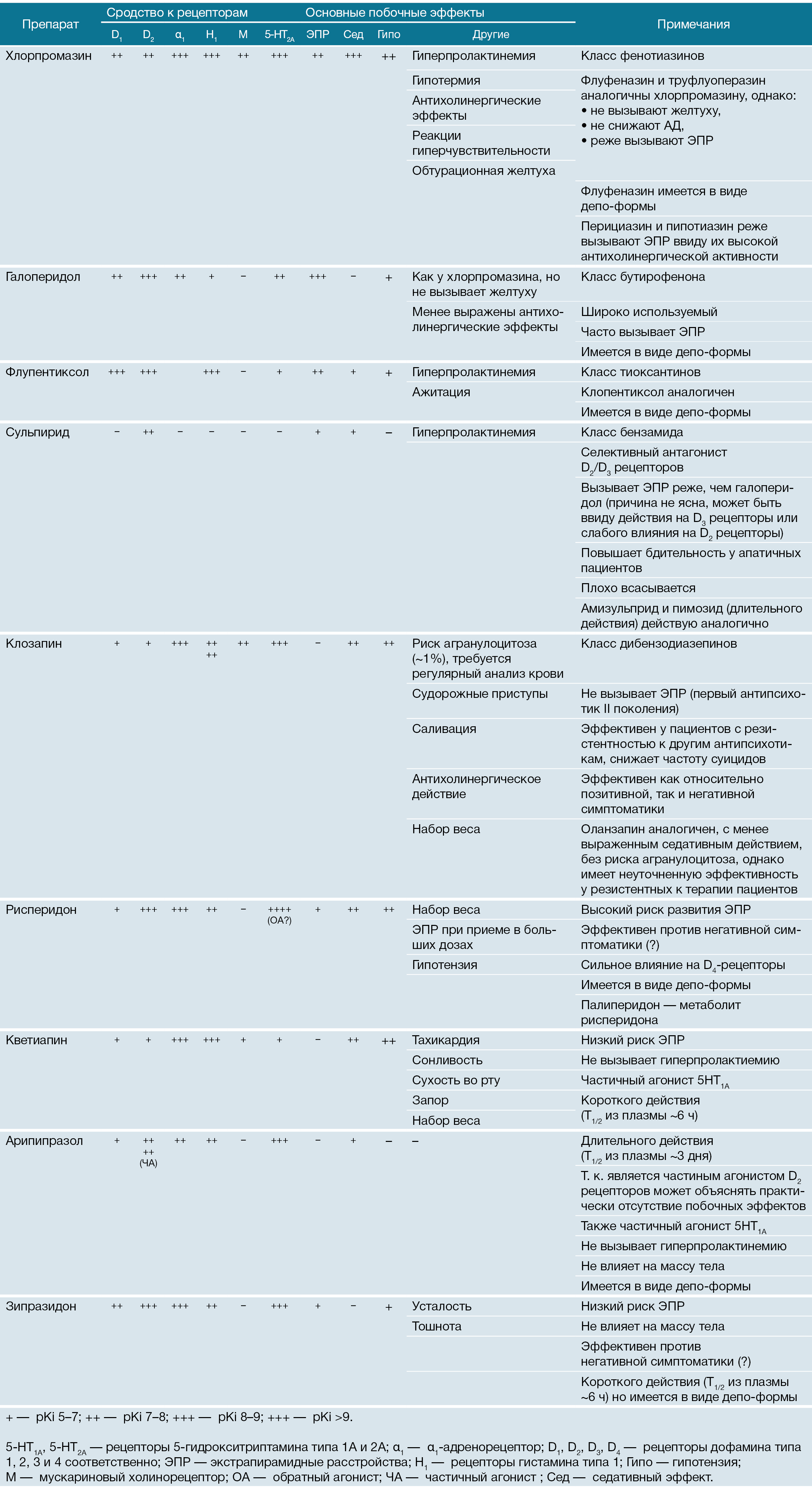
Спектр побочных эффектов хлорпромазина обусловлен блокадой разного типа рецепторов:
Врачи, которые первыми стали применять хлорпромазин, обратили внимание на экстрапирамидные симптомы, — интерес к ним при изучении побочных эффектов антипсихотиков сохраняется до сих пор. Он же направлял поиск новых препаратов, который привел к созданию атипичных нейролептиков. В то же время первое сообщение о развитии гипергликемии у прежде здоровых в этом отношении пациентов или декомпенсации сахарного диабета на фоне применения хлорпромазина осталось практически незамеченным.
Но научная мода меняется, сейчас метаболический статус привлекает внимание ученых, и набор веса оказывается не таким пустяком, как думалось, наверное, впервые назначавшим хлорпромазин. Известно, что метаболические нарушения прямо сказываются на состоянии сосудов и повышают риски инфаркта и инсульта, что уже звучит серьезно в сравнении с лекарственным паркинсонизмом и злокачественной нейролепсией.
Даже если речь не идет о сосудистой катастрофе, хроническая ишемия может накладывать свой отпечаток на психическое заболевание, потребовавшее назначения нейролептиков. Снова возникает вопрос, насколько мы помогаем пациентам. Если нас интересует не немедленно «успокоить», а обеспечить на долгое время качество жизни, и мы рассматриваем эффект на большом временном промежутке, насколько совокупная польза превышает вред и превышает ли вообще?
С точки зрения метаболических эффектов атипичные антипсихотики своим предшественникам только проигрывают. Постулируется, что их эффект в меньшей степени обусловлен блокадой дофаминовых рецепторов, за счет чего уменьшается риск развития экстрапирамидных симптомов; многие атипичные антипсихотики в большей степени действуют на серотониновые 5-HT2 рецепторы.
У каждого препарата свой профиль сродства к рецепторам, который обеспечивает отличия не только в психотропном эффекте, но и в побочных. Далее мы разберем по порядку, как перечисленные механизмы действия антипсихотиков на разные рецепторы могут приводить к метаболическим изменениям.
Таблица 1 | Характеристики основных антипсихотических препаратов.
Сосредоточимся на таких компонентах метаболического синдрома, как:
Кроме них клиническим признаком метаболического синдрома считают повышение артериального давления более 140 и 90 мм рт. ст., но патогенез гипертензии требует отдельного обсуждения.
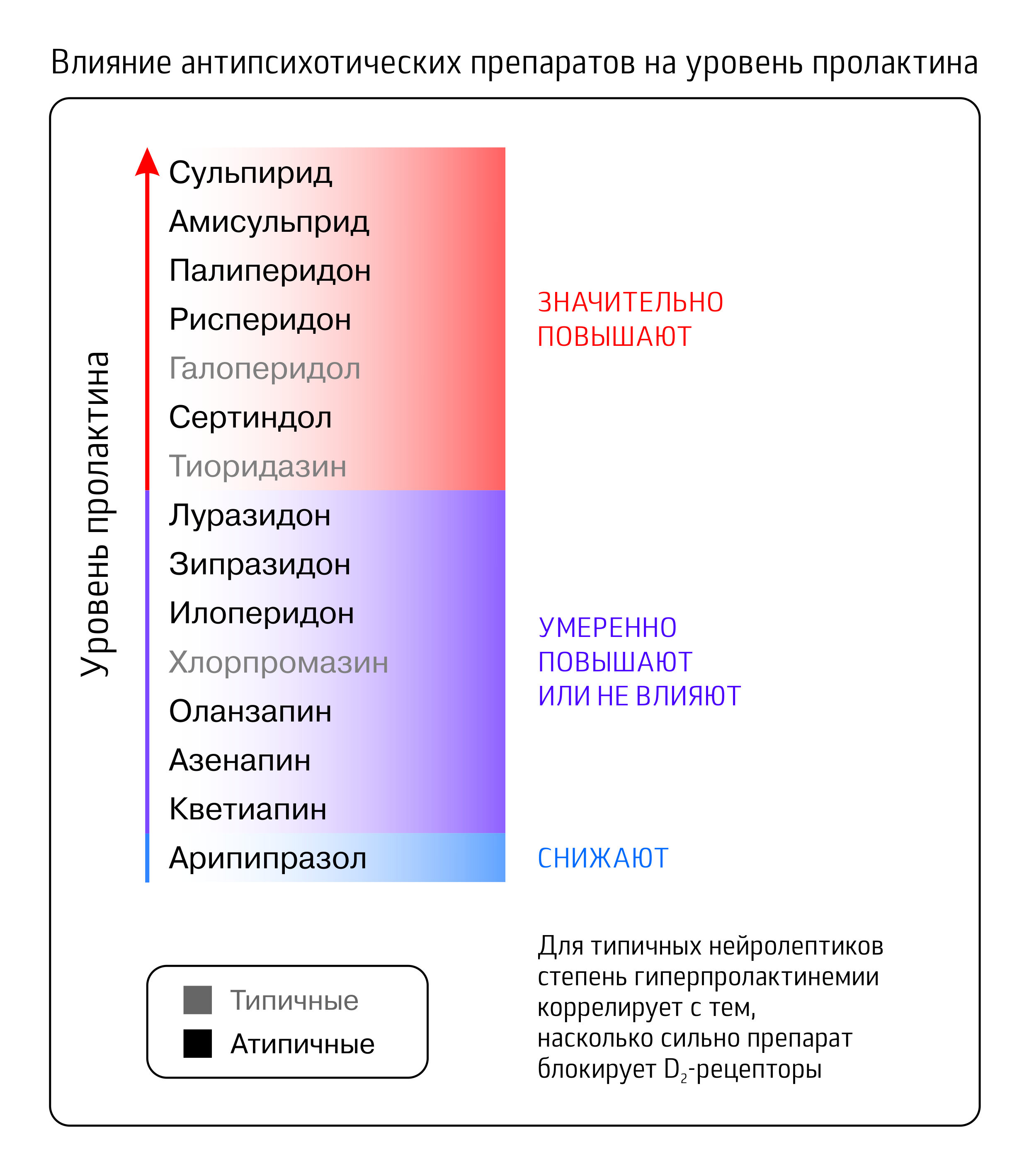
Гиперпролактинемия
Считается, что блокаде D2 дофаминовых рецепторов типичные нейролептики в большей степени обязаны антипсихотическим эффектом, но есть у него и обратная сторона: естественная функция дофамина, кроме нейромедиаторной, состоит в подавлении выработки пролактина (другое название дофамина — пролактостатин). Кроме дофамина на секрецию пролактина влияет огромное количество факторов, среди прочего серотонин и ацетилхолин, рецепторы к которым антипсихотики также блокируют, но такой однозначной связи с гиперпролактинемией для них не обнаружено.
Есть физиологическое состояние гиперпролактинемии — у недавно родившей женщины, пока сохраняется лактация, и за это время тоже возможна прибавка в весе.
Полагают, что изменения липидного состава крови и массы тела при этом первичны, и они приводят к инсулинорезистентности.
Во-вторых, пролактин сам по себе способен влиять на жировую ткань. Путем увеличения экспрессии факторов транскрипции, которые участвуют в дифференцировке и созревании адипоцитов, пролактин стимулирует адипогенез — возникновение новых жировых клеток. Также он блокирует секрецию адипонектина, который мобилизует жиры для использования; например, в мышцах это антиатерогенный фактор, содержание которого коррелирует с уровнем «хороших» ЛПВП; он модулирует чувствительность клеток к инсулину, а снижение его является предиктором сахарного диабета 2 типа.
Жировая ткань и сама способна вырабатывать пролактин, то есть с увеличением ее массы под действием того же пролактина формируется замкнутый круг. Конечно, секреторная активность жировой ткани меньше, чем у гипофиза (в 4–5 раз), но это с лихвой компенсируется ее объемом: сравните 1 грамм гипофиза и 50 килограмм жировой ткани при морбидном ожирении.
В-третьих, пролактин вмешивается в регуляцию чувства голода и насыщения, провоцируя гиперфагию. На нейронах гипоталамуса с соответствующей функцией имеются рецепторы к пролактину, и ответом на стимуляцию становится повышение содержания нейропептида Y и агути-подобного белка. Такой же эффект производит грелин («гормон голода»), а обратный — лептин («гормон насыщения»). Опосредованное действие пролактина реализуется через снижение концентрации эстрогенов, обычно снижающих аппетит. В то же время выработка прогестерона под действием пролактина повышается, а прогестерон — типичный орексигенный гормон; в ЦНС он метаболизируется с образованием аллопрегнанолона, подавляющего выработку окситоцина и АКТГ (анорексигенных гормонов). К тому же, кроме самого пролактина, жировая ткань вырабатывает лептин, анорексигенный гормон; с накоплением жировой ткани его вырабатывается все больше, но свое свойство подавлять аппетит он при этом теряет — формируется лептинорезистентность.
Блокада дофаминовых рецепторов
Неблагоприятно сказывается на метаболическом статусе не только побочное, но и терапевтическое действие типичных антипсихотиков. Влияние дофамина определяется типом рецепторов, через который оно реализуется, и их локализацией в мозге, однако в основном оно связано именно с пищевым поведением. D1-подобные рецепторы (к ним относятся D1 и D5), приводящие через связь с Gs белком к активации аденилатциклазы, по всей видимости, мало участвуют в его регуляции. Наоборот, для D2-подобных рецепторов (собственно D2, на которые в основном действуют антипсихотические препараты, а также D3 и D4) такие эффекты выявлены.
Если речь идет о дофаминовых рецепторах гипоталамуса, в области дугообразных ядер и латеральной гипоталамической области действие на них снижает аппетит, а в области вентромедиальных ядер — повышает. Но наиболее известный механизм — дофаминовая «система вознаграждения»: если некоторый стимул ожидается и будет получен, за правильное предсказание, повышающее его адаптивность, организм получает вознаграждение. Таким стимулом может служить пища, и чем человек голоднее, тем выше уровень дофамина, который он получит, приняв ее — сходным образом развивается наркотическая зависимость. Было показано, что у больных с морбидным ожирением, чем выше масса тела, тем меньше D2 рецепторов в области полосатого тела; даже выдвигается гипотеза, что у людей, предрасположенных к ожирению, имеется недостаточность дофаминовой системы, которую они пытаются восполнить постоянным перееданием. Тот же «недостаток дофамина» испытывают пациенты, получающие терапию нейролептиками, и гиперфагия может быть одним из способов ее компенсировать.
К тому же, D2-подобные рецепторы обнаруживаются еще и на мембране бета-клеток поджелудочной железы; с ними соединяется дофамин в комплексе с инсулином, что стимулирует дальнейшую секрецию инсулина. Этот эффект оказался таким выраженным, что сейчас обсуждается применение бромокриптина, агониста D2 рецепторов, в качестве препарата для лечения сахарного диабета 2 типа.
Блокада гистаминовых рецепторов
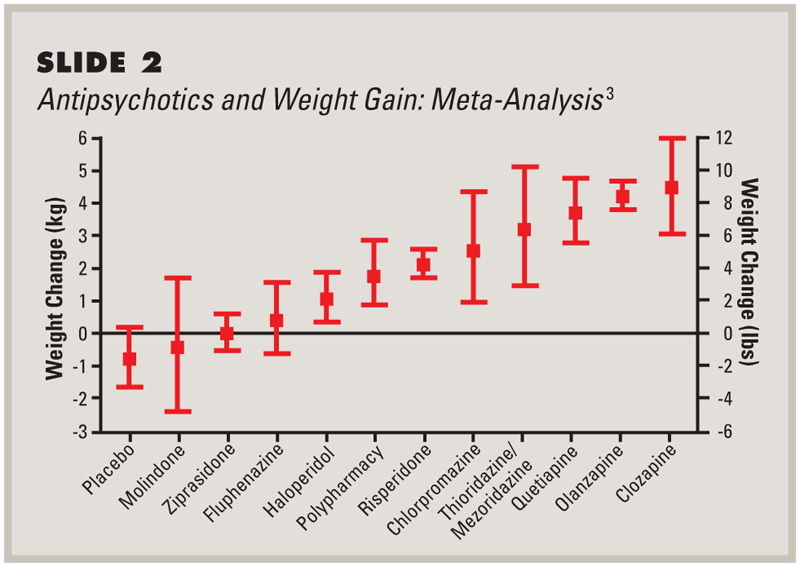
Наиболее выраженным эффектом в отношении H1 гистаминовых рецепторов обладают клозапин и оланзапин — атипичные антипсихотики, для которых в большей степени характерен набор веса на фоне терапии.
Гистаминергических нейронов много в задних отделах гипоталамуса, и их отростки проецируются на обширные области мозга; из четырех известных типов гистаминовых рецепторов в мозге распространены H1–H3. Наибольшую роль в регуляции аппетита, по всей видимости, играют именно Н1 рецепторы: анорексигенный эффект селективных агонистов Н1 рецепторов сравним с эффектом от введения в мозговые желудочки гистамина, а нокаутные по гену Н1 рецептора мыши съедают больше в ответ на стимуляцию орексигенным нейропептидом Y.
Эффект стимуляции Н1 рецепторов в отношении обмена обусловлен активацией AMPK — АМФ-активируемой протеинкиназы. В норме она активируется в условиях большого расхода энергии (при этом как раз накапливается АМФ) и предотвращает дальнейшие энергозатраты, переводя клетку в «сберегающий» режим. Известно, что лептин, обладающий свойством понижать аппетит, снижает активность AMPK, а антипсихотики с H1-блокирующим действием повышают. В пользу этой теории говорит и то, что у мышей, нокаутных по гену рецептора Н1, этот эффект антипсихотиков не обнаруживается.
Блокада серотониновых рецепторов
Сведения о влиянии на аппетит лекарственных средств, модулирующих серотониновую систему, мы имеем не только из истории атипичных нейролептиков, но и препаратов для борьбы с депрессией. Некоторые препараты из группы ингибиторов обратного захвата серотонина и агонисты 5-НТ2с рецепторов целенаправленно использовались для краткосрочной терапии при борьбе с лишним весом, а мутации в гене 5-НТ2с рецептора ассоциированы с гиперфагией и инсулинорезистентностью у мышей; набор веса при приеме трициклических антидепрессантов также обусловлен в большой степени блокадой этих рецепторов.
Статистически корреляция между способностью антипсихотика блокировать 5-НТ2с рецепторы и побочным эффектом в виде набора массы тела была подтверждена, но с уверенностью выделить какие-то конкретные механизмы на данный момент нельзя: эффекты серотонина как в ЦНС, так и на периферии слишком полиморфны.
Известно, что ингибиторы обратного захвата серотонина, снижают секрецию инсулина бета-клетками; сходным эффектом могут обладать и антипсихотики, при наличии некоторой миметической активности в отношении периферических 5-НТ2a или 5-НТ2c рецепторов. Помимо клеток поджелудочной железы, серотонин и его транспортер активны в печени, где обусловливают чувствительность к инсулину, и на ней также может сказаться частичный агонизм по отношению к 5-НТ2a/c рецепторам.
Блокада холинорецепторов
Метаанализ также обнаружил корреляцию между набором веса и способностью препаратов блокировать M1 и M3 холинорецепторы. M3-холинорецепторы имеются на бета-клетках поджелудочной железы; воздействуя на них, ацетилхолин повышает высвобождение инсулина. М-холинорецепторами опосредуется влияние блуждающего нерва на выработку грелина и в целом «обратная связь» пищеварительной системы с центрами голода и насыщения.
Кроме того, метаанализ показывает, что препараты тем более склонны вызывать гиперпролактинемию, чем меньшее сродство имеют к М1 и М4 рецепторам, однако это противоречит данным о том, что ацетилхолин стимулирует секрецию пролактина. Тем не менее, данных по холинорецепторам гораздо меньше, чем по остальным, и абсолютно недостаточно, чтобы судить о конкретных механизмах отрицательного метаболического эффекта.
Блокада адренорецепторов
Антипсихотики влияют на α1/α2-адренорецепторы, как на мембранах нейронов ЦНС, так и на периферии. Метаболические эффекты α2-адренорецепторов более изучены: на периферии их стимуляция вызывает снижение секреции инсулина и подавляет липолиз в адипоцитах. О периферических эффектах стимуляции α1-рецепторов до недавнего времени было известно мало, но в последние годы появились сведения, что на метаболизме она сказывается благоприятно: повышает толерантность к глюкозе, секрецию лептина и ускоряет метаболизм липидов.
Альфа-адренорецепторы также участвуют в регуляции пищевого поведения, модулируя активность серотонинергических нейронов, например, в ядрах шва. Они обладают противоположным эффектом: действуя на одно и то же медиальное ядро шва адреналином, можно получить и подавление, и активацию пищевого поведения. Эффект зависит от преимущественного действия на пресинаптические α2 или постсинаптические α1 рецепторы, что было подтверждено в экспериментах с селективными агонистами и антагонистами этих рецепторов.
В свою очередь, какие рецепторы ответят на стимуляцию, зависит это от предшествующего пищевого статуса: у животных, которых до этого лишали пищи, стимуляция адреналином подавляла пищевое поведение — за это ответственны α1 рецепторы; у сытых животных введение адреналина наоборот стимулировало прием пищи вследствие активации α2 рецепторов. В литературе нет указаний на корреляцию между выраженностью компонентов метаболического синдрома и способностью препарата блокировать адренорецепторы, однако, исходя из физиологии, отрицательный метаболический эффект препаратов возможен (и показан на примере селективных антагонистов α1 адренорецепторов).
Кроме рецепторов.
Не только прямое влияние на метаболизм может приводить к набору веса: и седативное действие препаратов, и ограничения режима психиатрических больниц, стигматизация и самостигматизация приводят к тому, что активность пациентов, вынужденных принимать антипсихотики, падает, с ней падает и расход энергии. В то же время препараты так и «убеждают» съесть побольше — в конце концов, пирожные могут стать единственной радостью пациентов.
Выявлено множество факторов, которые влияют на корреляцию между применением препаратов и метаболическими нарушениями: это и возраст, и пол, и разнообразные генетические полиморфизмы, обусловливающие индивидуальную в каждом случае реакцию на препараты, и диета, и разные другие аспекты образа жизни. Активная реабилитационная работа может переломить описанную выше ситуацию, особенно в тех моментах, где повышение веса связывается именно с аппетитом, то есть с формированием мотивации к употреблению пищи: в наших силах сделать так, чтобы когда пациенту вообще чего-то захочется, в его распоряжении были не только ухудшающие липидный профиль вещи.
Кроме того, ставится вопрос о том, не лежат ли одинаковые патофизиологические механизмы, генетические дефекты в основе психических заболеваний и метаболического синдрома — это тема для отдельного разговора. Но тем не менее, вспомним старые картины, где изображены умалишенные в домах призрения, — и нынешние отделения психиатрических больниц. Некогда набору веса у таких пациентов не способствовал ни фактор образа жизни, ни лечебные приемы тех времен, и дожить до метаболического синдрома, проявляющегося в большей степени с возрастом, было маловероятно.
Конечно, мы будем ждать и дальнейшего прогресса в психофармакотерапии, еще большей безопасности и переносимости, а пока самое безобидное, что мы можем противопоставить борьбе с галлюцинациями, — это борьба с желанием съесть лишний рогалик.
Источники
Ballon J. S. et al. Molecular pathophysiology of metabolic effects of antipsychotic medications //Trends in Endocrinology & Metabolism. – 2014. – Т. 25. – №. 11. – С. 593-600.
Olten B., Bloch M. H. Meta regression: Relationship between antipsychotic receptor binding profiles and side-effects //Progress in Neuro-Psychopharmacology and Biological Psychiatry. – 2018. – Т. 84. – С. 272-281.
Yunilainen O. A., Starostina E. G., Dzeranova L. K. Obesity associated with neuroleptic drugs, value of hyperprolactinemia //Obesity and metabolism. – 2013. – Т. 10. – №. 2. – С. 33-37.
Сметник В. П. Защитное влияние эстрогенов на сердечно-сосудистую систему //Consilium medicum. – 2002. – Т. 2. – С. 3-6.
Мосолов С. Н. и др. Метаболические побочные эффекты современной антипсихотической фармакотерапии //Социальная и клиническая психиатрия. – 2008. – Т. 18. – №. 3.
Юнилайнен О. А., Доровских И. В. Гиперпролактинемия, ассоциированная с приемом нейролептиков //Социальная и клиническая психиатрия. – 2013. – Т. 23. – №. 1.
Романцова Т. И. Репродукция и энергетический баланс: интегративная роль пролактина //Ожирение и метаболизм. – 2014. – №. 1.
Taylor D, Paton C, Kapur S. The Maudsley Prescribing Guidelines, 12th Edition. United Kingdom; Wiley Blackwell, 2015;
Shi T., Papay R. S., Perez D. M. The role of α1-adrenergic receptors in regulating metabolism: increased glucose tolerance, leptin secretion and lipid oxidation //Journal of Receptors and Signal Transduction. – 2017. – Т. 37. – №. 2. – С. 124-132.
Flores R. A. et al. Evaluation of food intake and Fos expression in serotonergic neurons of raphe nuclei after intracerebroventricular injection of adrenaline in free-feeding rats //Brain research. – 2018. – Т. 1678. – С. 153-163.