Биопсия по системе olga что это
Эндоскопическое наблюдение пациентов с предраковыми изменениями слизистой оболочки желудка с использованием системы гистопатологического стадирования OLGA и OLGIM
Введение.
Гастроскопия является наиболее эффективным методом скрининга и диагностики предопухолевой патологии желудка. Однако ее диагностические возможности могут быть реализованы в полной мере только при условии выполнения биопсии и проведения гистологического исследования. Долгое время методика биопсии и интерпретация результатов гистологического исследования определялись модифицированной Сиднейской системой классификации гастритов и оценки состояния слизистой оболочки желудка. Эта система позволяет охарактеризовать гастрит с точки зрения его топографии, выраженности морфологических изменений слизистой оболочки желудка, обсемененности инфекцией Helicobacter pylori, однако она не предназначена для градирования риска развития рака желудка.
В отличие от этого, разработанные в последнее время системы гистопатологического стадирования OLGA (Оперативная система оценки гастрита) и OLGIM (оперативная система оценки гастрита, основанная на кишечной метаплазии) позволяют классифицировать пациентов в группы с различным риском развития рака желудка. Согласно Европейским рекомендациям, именно такое стадирование изменений слизистой оболочки желудка должно быть положено в основу определения дальнейшей тактики ведения пациентов с предраковыми состояниями. Однако процесс оценки преимуществ и недостатков систем OLGA (Оперативная система оценки гастрита) и OLGIM в настоящее время продолжается.
В ГУ «Республиканский научно практический центр Радиационной медицины и экологии человека» в центре превентивной гастроэнтерологии с 2009 ведется динамическое наблюдение за пациентами с предопухолевой патологией желудка, количество которых достигло уже 1000 человек. Традиционно гистологическая оценка гастральной слизистой оболочки проводилась по модифицированной Сиднейской системе. В 2013 году в работе с пациентами было начато внедрение систем гистопатологического стадирования OLGA и OLGIM.
Цель. Сопоставить результаты оценки состояния слизистой оболочки желудка по модифицированной Сиднейской системе, системам OLGA и OLGIM.
Материалы и методы. В исследование включены данные пациентов, состоящих под наблюдением в центре превентивной гастроэнтерологии ГУ «Республиканский научно практический центр радиационной медицины и экологии человека» по поводу атрофического гастрита и проходивших плановый осмотр в 2013 г. после начала внедрения гистопатологических систем оценки желудка OLGA и OLGIM.
Всем пациентам проводился эндоскопический осмотр верхних отделов желудочно-кишечного тракта и выполнялась биопсия желудка из пяти точек: 1) антральный отдел по малой кривизне в 2-х см от пилоруса, 2) антральный отдел по большой кривизне в 2-х см от пилоруса, 3) угол желудка, 4) тело желудка по малой кривизне примерно в 8-ми см от кардии, 5) тело желудка по большой кривизне. Полученные биоптаты помещались в формалин и подвергались стандартной пробоподготовке. Гистологические срезы окрашивались гематоксилином и эозином, а также по Гимзе. Состояние слизистой оболочки желудка оценивалось по модифицированной Сиднейской системе, а также по системам ОLGA и OLGIM. Статистическая обработка проводилась с использованием программного пакета MedCalc.
Стадии гастрита, характеризующиеся значимым повышением риска рака желудка (стадия 3-4), при использовании системы OLGA были диагностированы в 48,6% случаев, а системы OLGIM – в 18,9% случаев (р=0,03). Совпадение стадий по обеим классификационным системам наблюдалось у 24,3% пациентов. Из 28 случаев, при которых имело место несовпадение стадий, у 20 пациентов стадия по OLGIM была на 1 ступень ниже, чем по OLGA, а у 8-ми пациентов – на 2 ступени. Пациенты с дисплазией (n=3) оказались стадированы как 2/0, 3/2 и 4/3 по OLGA/OLGIM соответственно, то есть в 2 из 3 случаев дисплазия развилась на фоне гастрита, который при оценке по системе OLGIM не попадал в группу высокого риска рака.
Выводы. Использование систем гистопатологического стадирования OLGA и OLGIM приемлемо для клинической практики и позволяет практически в 2 раза сократить количество пациентов, отнесенных в группу риска по раку желудка, по сравнению со стандартным подходом, основанным на наблюдении всех пациентов с атрофическим гастритом. Доли пациентов, классифицированных в разные группы риска, достоверно отличаются при использовании классификаций OLGA и OLGIM. Использование системы OLGIM может сопровождаться недооценкой риска развития рака. Необходимы дальнейшие исследования, чтобы определить, использование какой из этих гистопатологических систем более эффективно в профилактике рака.
Взятие биопсии для диагностики Helicobacter pylori
Хеликобактер пилори – это одноклеточный микроорганизм, который обитает в желудке и 12-перстной кишке человека. Бактерия выживает и активно размножается в агрессивной среде желудка, повреждает клетки слизистой оболочки, выделяет токсические для организма вещества, что практически у 90% инфицированных приводит к гастриту.
Число инфицированных, по данным статистики, очень велико и во многом определяется уровнем жизни населения. Так, например, число носителей Helicobacter pylori в Москве и других крупных развитых городах не превышает 60%, тогда как в регионах этот показатель составляет от 70 до 90%.
Устранить хеликобактер несложно. Для этого разработаны и с успехом применяются специальные схемы лекарственных препаратов, которые включают в том числе и антибиотики. Однако бесконтрольное применение лекарств еще никому не шло на пользу, поэтому сначала необходимо установить наличие, количество патогенных бактерий в желудке, определить их чувствительность к антибиотикам. Биопсия слизистой в данном процессе играет ключевую роль.
Клинические проявления и осложнения
Гастрит, ассоциированный с хеликобактер пилори (он же гастрит типа В), имеет комплекс неспецифических симптомов, которые могут проявиться при целом ряде заболеваний желудочно-кишечного тракта, интоксикации и других патологических процессах:
С такими симптомами, если интенсивность их небольшая, многие пациенты живут годами, не придавая значения имеющимся нарушениям, связывая их не с заболеванием, а с погрешностями в диете, перееданием и прочими причинами.
Вероятность развития осложнений гастрита типа В определяется преимущественной локализацией очагов размножения Helicobacter pylori в желудке. Если поражен антральный отдел (часть желудка, которая расположена ближе к месту соединения желудка и 12-типерстной кишки), то у пациента будет высокий риск развития дуоденальных язв. Если же очаги расположены по всему желудку или сосредоточены преимущественно в его центральной части, то у больного несколько повышена вероятность развития рака желудка. Согласно статистике, язвы и рак выявляются ежегодно у 1% больных с хеликобактериозом.
Диагностика Helicobacter pylori
Среди всего многообразия тестов, которые применяются в клинической практике для обнаружения хеликобактера, наиболее простыми и востребованными среди пациентов являются уреазный (дыхательный) тест и выявление специфических антител против хеликобактера в сыворотке крови больного методом ИФА. Это связано с тем, что сдать кровь или провести дыхательный тест намного проще, чем решиться на гастроскопию с расширенной биопсией. Тем не менее, данные исследования имеют и недостатки, так как существует целый ряд сложностей с интерпретацией полученных с их помощью данных.
Основной недостаток дыхательного теста заключается в том, что бактерии Helicobacter pylori живут не только в желудке, но могут встречаться в пищеводе и в полости рта. Они выявляются в слюне и накапливаются в значительном количестве в зубном налете. При этом большинство исследователей сходятся во мнении, что корреляционной зависимости между наличием хеликобактера в зубном налете, в желудочном содержимом и в 12-типерстной кишке нет. Это значит, что положительный уреазный тест не всегда свидетельствует о наличии у пациента гастрита типа В. Выявление специфических антител в сыворотке также не является основанием для постановки диагноза хеликобактериоз, так как антитела могут длительно сохраняться в крови даже после элиминации возбудителя. Поэтому наиболее точным и информативным методом диагностики считается биопсия во время гастроскопии.
В связи с тем, что распространение патогенных микроорганизмов неравномерное, биопсия для выявления Helicobacter pylori проводится по международному стандарту для гистологической оценки биоптатов по системе OLGA. Система предполагает получение 5 образцов ткани из разных отделов желудка: 2 биоптата из антрального отдела, 2 из тела желудка и 1 из угла желудка. Классическая биопсия, когда для анализа используется только 1 образец, в случае гастрита типа В может дать ложноотрицательный результат, что потребует проведения дополнительных исследований и отсрочит назначение пациенту адекватной терапии.
Биоптаты сразу после их получения отправляются в лабораторию, где проводится их гистологическое исследование, анализ на уреазную активность, выявление ДНК Helicobacter pylori методом ПЦР. В ряде случаев может быть проведено и микробиологическое исследование, когда из образцов ткани выделяется хеликобактер, и определяется чувствительность этой бактерии к антибиотикам, в частности, к кларитромицину.
Комплексное обследование с использованием достоверных методов позволяет назначить на его основе адекватное лечение, которое имеет высокую эффективность. В большинстве случаев при соблюдении пациентом всех рекомендаций доктора удается избавиться от Helicobacter pylori, что снижает вероятность развития таких грозных заболеваний, как язва или злокачественное новообразование желудка.
Помимо выявления Helicobacter pylori, гастроскопия позволяет:
От качества подготовки к гастроскопии зависит качество самого обследования. Будет ли гастроскопия на 100% эффективной, зависит не только от врача и оборудования, но и от готовности пациента.
Материал подготовлен специалистами медицинского центра «УРО-ПРО»
Протокол диагностики и лечения пациентов с хроническим гастритом в РБ
Хронический гастрит – это хронический воспалительный процесс слизистой оболочки желудка, характеризующийся нарушением ее физиологической регенерации, уменьшением количества железистых клеток, при прогрессировании – атрофией железистого эпителия с развитием кишечной метаплазии, а в последующем – дисплазии. Хронический гастрит обычно вызывается микроорганизмом Нр.
Согласно МКБ-10 хронический гастрит классифицируется как:
Клиническими критериями хронического гастрита являются:
Диагностика при хронических гастритах
Обязательная диагностика:
Дополнительная диагностика:
Примечание:
Диагностические критерии хронического гастрита
При хроническом гастрите используют следующие критерии оценки степени тяжести:
| Выраженность атрофии (метаплазии)* | Тело желудка | ||||
|---|---|---|---|---|---|
| нет | легкая | умеренная | тяжелая | ||
| Антрум | нет | стадия 0 | стадия I | стадия II | стадия II |
| легкая | стадия I | стадия I | стадия II | стадия III | |
| умеренная | стадия II | стадия II | стадия III | стадия IV | |
| тяжелая | стадия III | стадия III | стадия IV | стадия IV | |
* Выраженность атрофии (метаплазии) определяется по проценту атрофированных и (или) метаплазированных желез с учетом всех биоптатов из данного отдела желудка: менее 30 % – легкая атрофия (метаплазия), 30–60 % – умеренная атрофия (метаплазия), более 60 % – тяжелая атрофия (метаплазия).
легкий атрофический гастрит – стадия I;
умеренный атрофический гастрит – стадия II;
тяжелый атрофический гастрит – стадии III, IV.
Наличие и степень тяжести дисплазии определяется по следующим критериям:
Хронический гастрит классифицируется в соответствии с Хьюстонско- Сиднейской системой следующим образом:
Формулировка диагноза хронического гастрита включает:
Цели лечения хронического гастрита
Показания для госпитализации пациента с хроническим гастритом
Лечение пациента с хроническим гастритом
Пациенты с хеликобактерным атрофическим гастритом умеренной или тяжелой степени, гастритом с метаплазией или дисплазией, аутоиммунным атрофическим гастритом и особыми формами гастрита относятся к группе диспансерного наблюдения Д(III) и подлежат диспансерному наблюдению у врача-терапевта участкового (врача общей практики) постоянно.
Объем и частота обследования при диспансерном наблюдении составляют:
Критериями эффективности лечения и диспансерного наблюдения пациента являются: исчезновение инфекции Нр, уменьшение воспалительных изменений слизистой оболочки желудка, отсутствие прогрессирования атрофии, метаплазии и дисплазии, отсутствие анемии при аутоиммунном атрофическом гастрите.
Практическое значение и перспектива применения в гастроэнтерологии классификации атрофического гастрита «OLGA»
Медицинский институт Северо-Кавказской государственной гуманитарно-технологической академии, г. Черкесск
В настоящее время получила широкое распространение международная классификация гастрита «OLGA» (Operative Link on Gastritis Assessment) предложенная группой авторов во главе с M. Rugge. Эта классификация позволяет наиболее точно оценить гистологическую картину желудка. При оценке морфологических признаков гастрита учитывают степени тяжести атрофии слизистой оболочки желудка, и топографию атрофии [15]. Среди населения трёх континентов (Чили, Германии, Индии, Италии, Кореи, Китая и Таиланда) исследовали распространённость HP-ассоциированного атрофического гастрита. Разделяли по степеням тяжести атрофии, а также по стадиям атрофического гастрита в соответствии с классификацией «OLGA». Третья и четвёртая стадии атрофического гастрита была наиболее распространена в Китае и Корее, что сильно коррелировало с высокой заболеваемостью раком желудка в этих странах. В Индии при высокой распространённости инфекции Helicobacter pylori тяжёлая атрофия слизистой оболочки встречались реже, чем в Китае и Корее. Это сочеталось с меньшей распространённостью третьей и четвёртой стадии атрофического гастрита и рака желудка.
Классификация гастрита «OLGA» позволяет идентифицировать подгруппу пациентов более высокого риска [14]. Атрофический гастрит (развивающийся, главным образом, в результате длительной геликобактерной инфекции) является главным фактором риска для (кишечного типа). Развитие рака желудка и степень/топография атрофических изменений значительно коррелируют со степенью риска рака. Настоящий формат гистологической оценки гастрита, не в состоянии установить непосредственную связь между фенотипом гастрита и риском малигнизации. Основываясь на современных знаниях биологии гастрита и включая опыт, полученный во всем мире, применяя Сиднейскую Систему больше 15 лет, международная группа патологов «OLGA» предложила систему стадий прогрессивного увеличения риска желудочного рака от самого низкого (стадия 0) к самому высокому (стадия IV) [13]. При этом стадия гастрита от 0 до IV возрастала с возрастом [12]. Для точного прогноза развития рака желудка в рамках классификации «OLGA» необходима комплексная оценка инфицированности Helicobacter pylori, атрофии слизистой оболочки желудка кишечной метаплазии [10,11]. Ramírez-Mendoza P, Angeles-Angeles A, Aguirre-García J et al. указывают на последовательную связь каскада Корреа и стадий развития атрофического гастрита в рамках системы «OLGA» [9].
Имеются мнения, что новая классификация гастритов «OLGA» обладает значительными преимуществами перед традиционной Сиднейской системой, так как даёт возможность прогнозировать риск развития рака желудка [7,8]. Capelle LG, de Vries AC, Haringsma J et all. считают, что модификация системы «OLGA» в виде «OLGIM», в которой приоритет авторы отдают кишечной метаплазии, нежели атрофии, более точно отражаем риск развития рака желудка [6]. Pasechnikov VD, Balabekov AV, Churkov SZ. показали в своих исследованиях, что при Helicobacter pylori-ассоциированном атрофическом гастрите регенераторные процессы возрастают пропорционально стадии желудочной атрофии, при этом подразумевается увеличение риска предраковых изменений [5]. Из восьми тканевых маркеров (BRCA1, HSP90, STAT1, FHIT, EGFR, p73, p53, p16INK4a) p73 возрастал пропорционально прогрессированию атрофического гастрита и наивысшим был при раннем раке желудка [4]. Van Noord D, Biermann K, Moons LM et all. рассматривают возможность гистологической оценки, в рамках классификации OLGA, ишемической гастропатии основываясь на сопоставлениях с данными ангиографии [3]. Характерной чертой новой классификации OLGA является то, что по мере перехода от стадии атрофического гастрит 0 до стадии 4, риск рака желудка значительно возрастает, распространённость более тяжёлых стадий значительно меньше, чем лёгких [1,2].
Цель данного исследования представляет собой попытку оценить степень риска развития рака желудка в рамках классификации атрофического гастрита «OLGA»
Материал и методы исследования
Результаты исследования и их обсуждение
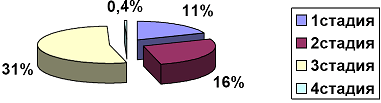
Таблица 1. Структура пациентов с гастритом по градации OLGA
Рис 1. Распределение стадий атрофического гастрита по OLGA.
Подобный подход значительно упрощает возможность выделить группу высокого риска развития рака желудка. Всех пациентов с атрофическим гастритом третьей стадии, исходя из высокого риска развития рака желудка, необходимо мониторировать эндоскопически – не реже чем раз в году проводить им ЭГДС. Это позволит выявить своевременно ранний рак желудка и вылечить таких пациентов. Пациенты с атрофическим гастритом четвёртой стадии (0,4%) подлежат эндоскопическому мониторингу каждые полгода. Что касается распределения стадий атрофического гастрита в разных возрастных группах, то эта статистика представлена далее.
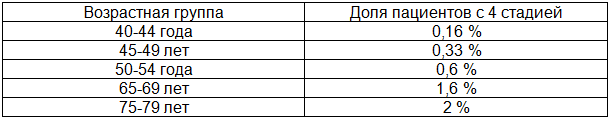
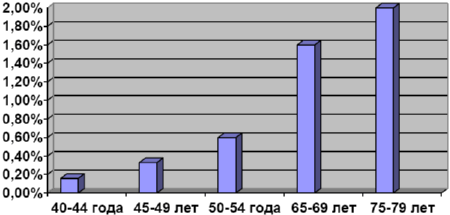
Таблица 2. Возрастание количества пациентов с 4 стадией атрофического гастрита с увеличением возраста
Рис 2. Рост числа пациентов с 4 стадией атрофического гастрита в зависимости от возраста.
Коэффициент корреляции среди мужчин равен 0,9942, среди женщин равен 0,9749. Сравнивали с заболеваемостью раком желудка в России. По данным Е.М. Аксель, М.И. Давыдова, Т.И. Ушаковой (Современная онкология, 2001), среди мужчин в возрасте 40-44 года на 100000 населения заболеваемость раком желудка составила 15 человек в год, в возрасте 45-49 лет – 25 человек в год, 50-54 года– 50 человек в год, 55-59 лет – 100 человек в год, 60-64 года – 150 человек в год, 65-69 лет – 200 человек в год, 70-74 года – 250 человек в год и 75-79 лет – 280 человек в год. Среди женщин в возрасте 40-44 года на 100000 населения заболеваемость раком желудка составила 7 человек в год, в возрасте 45-49 лет – 15 человек в год, 50-54 года– 20 человек в год, 55-59 лет – 30 человек в год, 60-64 года – 40 человек в год, 65-69 лет – 70 человек в год, 70-74 года – 100 человек в год и 75-79 лет – 120 человек в год.
Что касается групп пациентов со второй и первой стадией атрофического гастрита, то по мере увеличения возраста пациентов с атрофическим гастритом нет одновременного увеличения доли пациентов с атрофическим гастритом, как первой, так и второй стадией.
Выводы
Согласно классификации атрофического гастрита «OLGA» пациенты с выявленной четвёртой стадией атрофического гастрита имеют очень высокий риск развития рака желудка и поэтому подлежат обязательному эндоскопическому мониторингу на предмет выявления раннего рака желудка не реже чем каждые полгода.
Пациентов с выявленной третьей стадией атрофического гастрита, в соответствии с этой классификацией, невозможно дифференцировать по степени риска развития рака желудка, так как высокий риск развития рака желудка в одном из отделов желудка нивелируется более низким риском в другом отделе желудка.
Группы пациентов с выявленными первой и второй стадией атрофического гастрита, согласно классификации «OLGA», также невозможно точно дифференцировать по степени риска развития рака желудка, так как суммарный риск в обоих отделах желудка не отражает истинный риск развития рака желудка.
Определение риска развития рака желудка для конкретного пациента с атрофическим гастритом (предраком желудка) следует проводить по риску того отдела желудка, где риск наибольший.
Хронический атрофический гастрит: что пишет патологоанатом, что должен понять и сделать клиницист
Владимир Трофимович Ивашкин, академик РАМН, доктор медицинских наук:
– Пришло время для выступления Алексея Владимировича Кононова из Омска.
Алексей Владимирович Кононов, профессор:
– Дорогие коллеги, мы сегодня поговорим с вами о взаимоотношениях специалистов в таком сложном деле, как канцерпревенция и курации пациентов с предраковыми состояниями и предраковыми изменениями. Центральной проблемой канцерпревенции стоит проблема атрофии слизистой оболочки, которая является феноменом, располагающимся между собственно воспалительными изменениями слизистой оболочки желудка и предраковыми изменениями, которые вот Сергей Владимирович Кашин блестяще демонстрировал и называл дисплазией эпителия. Мне больше нравится термин «неоплазия», который подчеркивает необратимость этих процессов даже в виде низкой степени градации неоплазии. Таким образом, и у патологоанатома, и у клинициста встает один вопрос – это идентификация, детекция атрофии слизистой оболочки желудка и интерпретация этого заключения.
Что делать, когда термин «атрофия», «атрофический гастрит» появляется в патологоанатомическом заключении? На сегодняшний день как будто бы проблем с этим нет. Существует основной классификационный вариант для оценки атрофии слизистой оболочки – это модифицированная сиднейская система, где в визуально-аналоговой шкале эти состояния ранжированы на уровни: нет атрофии, слабая, умеренная, выраженная, как в теле, так и в антральном отделе желудка. Но проблема состоит вот в чем. Проблема состоит в том, что для точной идентификации атрофии даже по модифицированной сиднейской системе необходим не один фрагмент слизистой оболочки, не два фрагмента, а 5 фрагментов, взятых по протоколу: по большой и малой кривизне тела желудка, в области угла желудка и по большой и малой кривизне в антральном отделе желудка. Больше того, когда в 2008 году мы получили новую классификацию хронического гастрита, где атрофия и воспаления оцениваются как интегральные понятия на уровне целого органа, то это взятие биоптата из 5 точек является просто необходимой процедурой, без которой система, которая получила название OLGIM, просто не работает.
Вот это визуально-аналоговая шкала, отечественный вариант ее. По уровню абсцисс и ординат пиктограммы изменения слизистой оболочки – слабая, выраженная, умеренная атрофия в теле, в антральном отделе, а на перекрестии стадия, выраженность на уровне целого органа атрофических изменений. Точно так же построена шкала для оценки воспалительных изменений, которые называются степенью гастрита, там тоже пиктограммы. Смотрите, вот это воспалительный инфильтрат, причем здесь интегрально и нейтрофильные лейкоциты, и мононуклеары, которые, по сути, собой представляют воспалительный ответ слизистой оболочки, и мукозальный иммунитет одновременно. Проблема состоит в том, что появилось новое понимание атрофии слизистой оболочки. Это не просто уменьшение объема желез в теле и антральном отделе, но и замена их метаплазированным эпителием. Это так называемая метапластическая атрофия, и вот ее место в каскаде Пелайо Корреа. Причем сам, кстати, Пелайо Корреа очень положительно относится к этому термину и идентификации кишечной метаплазии с оценкой вместе с атрофией слизистой оболочки. Проблема возникает в другом. Иногда воспалительный инфильтрат настолько раздвигает желудочные железы, что возникает феномен так называемой неопределенной атрофии.
Вот давайте полечим больного, воспалительный инфильтрат рассосется частично в результате апоптоза воспалительных клеток, частично в результате миграции по лимфатическим сосудам, межтканевым щелям и так далее, а потом мы посмотрим. Но если выраженная кишечная метаплазия, то она никуда не исчезнет. Эксперты Маастрихт-4 считают, что метаплазия не подвергается обратному развитию, поэтому вот понимание кишечной метаплазии приобрело некоторое такое мистическое направление. Вдобавок она еще разработана по типам – полная, неполная метаплазия, тонкокишечная, толстокишечная, тип IIA, IIВ и так далее. Все это приводит к тому, что появляются мысли: а не является ли собственно кишечная метаплазия прекурсором, предшественником рака желудка кишечного типа? Ну, по этому поводу написаны горы статей и сломаны многочисленные копья, на сегодняшний день все упирается в Кохрановский обзор от сентября прошлого года. Доказательных, совершенно выстроенных по критериям медицины, основанной на доказательствах, исследований в отношении того, что кишечная метаплазия предрак, нет, поэтому давайте прислушаемся к личному мнению Дэвида Грэхема, который высказывается, как всегда, четко, ясно и совершенно понятно: кишечная метаплазия на сегодняшний день – это надежный показатель атрофии слизистой оболочки. Есть кишечная метаплазия – значит, есть атрофия слизистой оболочки.
Кстати говоря, вот наши прибалтийские коллеги опубликовали в январском номере этого года «Вирховского архива» – уважаемый, авторитетнейший патологоанатомический журнал Европы – такую статью, где они сравнили кишечную метаплазию, взятую в качестве детекции атрофии, и систему OLGIM. Оказалось, что критерий согласия экспертов выше там, где в качестве маркера атрофии применяли кишечную метаплазию. Правда, деликатно замечают наши коллеги, есть стадии атрофического гастрита, когда только кишечной метаплазии для детекции собственно атрофии недостаточно. Что еще пишут про кишечную метаплазию и атрофию? Оказывается, мы можем очень тесно сотрудничать с врачами эндоскопической диагностики. Мы можем говорить об уровне выраженности атрофических изменений, определяя стадию, а врачи эндоскопической диагностики определяют площадь очагов кишечной метаплазии, как это блестяще показал сегодня Сергей Владимирович, и вот это сочетание дает более точный прогноз канцерогенеза у конкретного пациента. Неопластические изменения, собственно, опухолевые уже изменения, когда эпителиальная клетка встала на опухолевый путь. Началось все с падуанских вопросов почти 20 лет назад, все это закончилось хорошо известной вам, уважаемые коллеги, Венской классификацией неоплазии пищеварительного тракта, которая построена, наверное, как образец для всех последующих патологоанатомических и параклинических классификаций.
Вот здесь вот слева обозначены изменения, которые находит врач эндоскопической диагностики и патологоанатом в своем заключении, а справа написано, что должен делать клиницист с пациентом. Определены дефиниции, что такое неоплазия, что такое неоплазия низкой степени, что такое неоплазия высокой степени. Мы можем просто посмотреть, пока я говорю, следующие слайды. Пожалуйста, следующий, еще следующий слайд. Неопределенная неоплазия. Вот так же, как неопределенная атрофия, так и неопределенная неоплазия – то ли это изменения регенеративные, то ли это уже действительно опухолевый процесс. А вот здесь интересная работа, которая опубликована в прошлом году в американском журнале «Клинические патологии», которая нас призывает интегрировать два этих представления – атрофию слизистой оболочки и неопластические изменения. Вот когда мы сумеем интегрировать оба этих понятия в своих заключениях, мы сможем дать точный прогноз. Я хотел бы подчеркнуть, что опухолевые изменения клеток слизистой оболочки желудка возникают не в воздухе, они возникают на фоне и в сочетании с атрофическими изменениями слизистой оболочки вообще.
Какие возможны утешения? Только ли наблюдать? Только ли брать биопсии и ставить диагноз? Сегодня мы знаем новые молекулярные клеточные мишени, открывшиеся сравнительно недавно для хорошо известного препарата на основе ионов висмута. Ну, во-первых, антиоксидантное свойство висмута. Свободные радикалы нейтрофильных лейкоцитов, возникающие при кислородном взрыве в них, нарушают ДНК стволовых клеток слизистой оболочки желудка до уровня двунитевых разрывов. Эти двунитевые разрывы подвергаются репарации, но при этом возникают мутации, накопление которых может закончиться канцерогенезом. Таким образом, препараты висмута в условиях воспалительной инфильтрации слизистой оболочки защищают ДНК, предотвращают процесс маргинализации. Это вторичная профилактика. Опять же, ионный эффект висмута великолепно продемонстрирован в попытке создания нового препарата, где висмут будет в составе растворимого соединения, и ионная активность его будет повышаться.
2 года назад Нобелевскую премию получили молекулярные биологи за изучение серпантинных рецепторов и G-белков, которые являются регуляторными путями клетки. Оказывается, в них вмешивается висмут и запускает в стволовых клетках пролиферативный стимул, и проводя эрадикацию с помощью солей висмута мы попутно решаем и вторую задачу – мы мобилизируем и стимулируем местные стволовые клетки в слизистой оболочке желудка, и если не устраняем атрофию, то по крайней мере препятствуем ее обратному развитию. Что еще появилось нового в отношении ионов висмута как фармакопрепаратов? Появились следующие результаты. Это работа, которая известна пока еще только в препринте, январский номер, она еще не вышла. О чем говорит препринт? Культура ткани и ионы висмута. Оказывается, ионы висмута обладают меньшей степенью повреждения бактериальной клетки Helicobacter рylori, нежели висмут металлический, который нанесен в виде монослоя, атомарный висмут, на носители, которые взаимодействуют с бактериальной клеткой. Нанотехнологии и антибактериальный эффект препаратов висмута – это новое.
Давайте обсудим клинический пример. Пациенту 55 лет, с диспептическими жалобами, выполнена эндоскопическая биопсия слизистой оболочки желудка. Что получил патологоанатом и что он написал? «Два фрагмента слизистой оболочки – тело и антральный отдел». Я хочу обратить ваше внимание – два фрагмента. Дальше патологоанатом по классификационной схеме, модифицированной сиднейской системе описывает ситуацию. Все очень правильно, в каждом кусочке, и он определяет изменения в теле и антральном отделе желудка. Что должен делать клиницист, получив такое заключение? Ну, прежде всего, принять, что верифицирован Helicobacter-ассоциированный атрофический гастрит. Очень хорошо. Затем он должен отметить про себя, что идентифицировать стадию по системе OLGA и. соответственно, риск рака желудка невозможно. О чем еще должен подумать клиницист? Он должен подумать, что, конечно, риск рака желудка есть, особенно если это атрофия у пациента старше 50 лет, но риск не определен. Затем он должен выполнить наверняка эрадикационную терапию, а вот уже когда он будет выполнять контрольное эндоскопическое исследование через 4 недели после окончания эрадикационной терапии, то тут необходимо, просто необходимо взять 5 биоптатов из совершенно точно по протоколу указанных точек и определить стадию атрофии по системе OLGA. Вот так это все выглядит в идеале, а вот так это выглядит в только что рассматриваемом примере, причем это обычная практика.
Давайте посмотрим, как это выглядит вообще на популяционном уровне. Вот посмотрите, 20 тысяч гастробиоптатов от 9 тысяч пациентов, и только 4% исследований могут быть оценены с позиции определения риска рака желудка 3-й, 4-й стадии по классификации OLGA. Давайте посмотрим, что в Америке происходит. Роберт Максимилиан Гента, известный патологоанатом-гастроэнтеролог, эксперт ВОЗ по опухолям пищеварительного тракта, проделал точно такое же исследование, что проделали мы, только в 20 раз больше, там было 400 тысяч биоптатов. Но он получил тот же самый процент: только 4% пригодны для оценки риска рака желудка по современной классификации. Второй клинический пример. У пациента 45 лет при эндоскопическом исследовании верифицирован видимый участок изменений в виде площадки 0,5х0,7 см, из которого взят биоптат. Что пишет патологоанатом? Один биоптат. Патологоанатом пишет: «Морфологические признаки очаговой эпителиальной дисплазии/неоплазии, – ну, «дисплазия» и «неплазия», как мы с вами договорились, это термины-синонимы, – низкой степени (тубулярная аденома с неоплазией низкой степени)».
О чем должен думать клиницист? Не сговариваясь с Сергеем Владимировичем, мы обсудили эту ситуацию, поэтому я могу только прокомментировать. Ну, прежде всего, принять наличие у пациента предопухолевого состояния или даже предопухолевого заболевания. Затем необходимо отметить, что степень риска развития рака желудка определить невозможно. Во-первых, один фрагмент. Взятый рядышком фрагмент может показать дисплазию/неоплазию высокой степени, а еще третий может показать инвазивную карциному. Значит, весь объем образования должен быть представлен достаточно репрезентативно при повторных биопсиях, если нет возможности выполнить мукозальную резекцию так, как это написано в Европейских рекомендациях по предраковым состояниям. Ну, и, наконец, что делать врачу-гастроэнтерологу или терапевту в данной ситуации? Он должен, по крайней мере, заказать повторное исследование для того, чтобы взять биоптаты из визуально измененного участка, а также обязательно 5 биоптатов по системе OLGA для того, чтобы точно определить риск рака желудка у пациента.
Что же должен в ответ вот на эти замечания, которые сделал патологоанатом, выполнить клиницист? Как он должен интерпретировать эту ситуацию? Ну, прежде всего, констатировать успешную эрадикацию, но на этом отнюдь не успокоиться. Он должен отметить, что уровень атрофических изменений остался прежним – что, в общем, не удивительно – и это уровень, который говорит о риске рака желудка, в 5-6 раз большем, чем в популяции. Обратить особое внимание на инфильтрацию нейтрофильными лейкоцитами, то есть активность воспаления. Это скрытая угроза повреждения ДНК стволовых клеток, особенно атрофически измененной слизистой оболочки, опасность канцерогенных мутаций. А что же сделать с пациентом? А обратиться к рекомендациям Российской гастроэнтерологической ассоциации. И я хочу закончить теми же рекомендациями, которые уже цитировал глубокоуважаемый Сергей Владимирович. При хроническом гастрите, в том числе атрофическом, после окончания эрадикационной терапии возможно продолжение лечения препаратом висмута от 4 до 8 недель для обеспечения защиты слизистой оболочки желудка. Благодарю вас, уважаемые коллеги!