Биомедицинских клеточных продуктов что относится
Биомедицинских клеточных продуктов что относится
1 января 2017 года вступил в силу федеральный закон о биомедицинских клеточных продуктах (БМКП), регулирующий отношения, возникающие на всех этапах жизненного цикла БМКП, в том числе и на этапе регистрации данного вида продукта на территории Российской Федерации.
Статьи:
Что такое БМКП?
Согласно ФЗ №180 к биомедицинским клеточным продуктом (БМКП) относятся следующие комплексы:
Клеточная линия – ключевой компонент биомедицинского клеточного продукта. Согласно тому же закону, клеточной линией является стандартизованная популяция клеток одного типа с воспроизводимым клеточным составом, которую получают путем изъятия из организма биологического материала с последующим культивированием клеток вне организма.
Примером БМКП является Эквивалент дермальный, который представляет собой эпидермальные клетки в фибриновом или коллагеновом геле. Данный БМКП используется для восстановления кожного покрова после ожогов, трофических язв и других поражений кожи.
Дендритно-клеточные вакцины, получаемые из мононуклеарных клеток крови, также являются БМКП. Их применение является перспективным при лечении онкологических заболеваний.
Виды БМКП
При регистрации БМКП важно указывать его тип в документе под названием Спецификация, который создается после прохождения этапа доклинических исследований. Все БМКП можно разделить на три типа:
Регистрация БМКП и пострегистрационный контроль.
Биомедицинские клеточные продукты регистрируются в Министерстве здравоохранения Российской Федерации. Срок регистрации составляет 150 р.д., не включая проведение клинических исследований. Регистрационное удостоверение выдается на 5 лет и продлевается каждые 5 лет.
Регистрации подлежат следующие БМКП:
После регистрации в Минздраве в отношении БМКП может осуществляться их производство, реализация, применение, хранение, транспортировка, ввоз в РФ, вывоз из РФ, а также уничтожение.
Государственный контроль за деятельностью в сфере обращения БМКП осуществляет Росздравнадзор. К полномочиям Росздравнадзора в отношении БМКП также относятся:
Таким образом, федеральный закон № 180 «О биомедицинских клеточных продуктах» является подтверждением того факта, что БМКП являются качественно новым продуктом и имеют особенности как в сфере обращения, так и при регистрации.
Ссылка на сайт Росздравнадзора – здесь
©Beawire — Окт 2018 с изменениями от Июня 2019
Биомедицинские клеточные продукты: перспективы развития в РФ
Биомедицинский клеточный продукт (БМПК) — комплекс, состоящий из клеточной линии (клеточных линий) и вспомогательных веществ либо из клеточной линии (клеточных линий) и вспомогательных веществ в сочетании с прошедшими государственную регистрацию лекарственными препаратами для медицинского применения (далее — лекарственные препараты) и (или) медицинскими изделиями. Проще говоря, Биомедицинский клеточный продукт — это продукт, в составе которого находятся выращенные клетки человека. Биомедицинские клеточные продукты делятся на несколько видов: аутологичные (полученные из собственных клеток пациента), аллогенные (полученные из клеток другого человека) и комбинированные (полученные от нескольких людей). Благодаря аутологичным продуктам разрабатываются БМКП, которые применяются при терапии заболеваний опорно-двигательного аппарата (например, для восстановления повреждений хрящевой поверхности сустава), офтальмологии, онкологических и других заболеваний.
По данным FDA регистрацию прошли уже 17 БМКП. В базе данных Европейского медицинского агентства по оценке лекарственных средств можно найти информацию о 16 БМКП При этом лишь четыре препарата зарегистрированы и в США, и в Евросоюзе. Данные БМКП предназначены для лечения онкологических заболеваний.
На территории России Федеральный закон N 180-ФЗ «О биомедицинских клеточных продуктах» был принят в 2016 году. В этой статье мы рассмотрим особенности проведения клинических исследований биомедицинских клеточных продуктов (БМКП), а также оценим перспективы развития БМКП в России.
Проведение клинических исследований БМКП.
Клинические исследования биомедицинских клеточных продуктов проводятся в медицинских организациях, аккредитованных Министерством здравоохранения Российской Федерации. Требования к медицинской организации для получения аккредитации на проведение клинических исследований биомедицинских клеточных продуктов:
Как и при проведении клинических исследований лекарственных препаратов, в случае выявления опасности для жизни и здоровья пациентов в процессе проведения клинического исследования биомедицинского клеточного продукта, руководитель медицинской организации в праве приостановить исследования. Решение о прекращении такого исследования принимается уполномоченным федеральным органом на основании сообщения в письменной форме руководителя медицинской организации, в которой проводится клиническое исследование биомедицинского клеточного продукта.
Отчет о результатах клинического исследования биомедицинского клеточного продукта составляется организатором проведения клинического исследования биомедицинского клеточного продукта, и представляется в уполномоченный федеральный орган исполнительной власти, выдавший разрешение на проведение этого исследования, в срок, не превышающий трех месяцев со дня его завершения.
Согласно Приложению к приказу Министерства здравоохранения Российской Федерации от 31 мая 2017 г. N 279н, реестр выданных разрешений на проведение клинических исследований биомедицинских клеточных продуктов должен содержать следующую информацию:
1) номер реестровой записи и дата включения в реестр сведений о выданном разрешении на проведение клинического исследования биомедицинского клеточного продукта;
2) дата и номер разрешения на проведение клинического исследования биомедицинского клеточного продукта;
3) наименование и адрес места нахождения организации, осуществляющей организацию проведения клинического исследования биомедицинского клеточного продукта;
4) наименование юридического лица, привлеченного организацией, указанной в подпункте 3 настоящего пункта, к организации проведения клинического исследования биомедицинского клеточного продукта (при наличии);
5) наименование биомедицинского клеточного продукта;
6) наименование протокола клинического исследования биомедицинского клеточного продукта;
7) цель клинического исследования биомедицинского клеточного продукта;
8) сроки проведения клинического исследования биомедицинского клеточного продукта;
9) количество пациентов, принимающих участие в клиническом исследовании биомедицинского клеточного продукта;
10) перечень медицинских организаций, в которых предполагается проведение клинического исследования биомедицинского клеточного продукта, с указанием адресов места нахождения и мест осуществления деятельности;
11) текущее состояние клинического исследования биомедицинского клеточного продукта (проводится, завершено, приостановлено, прекращено).
На сегодняшний день реестр выданных разрешений на проведение клинических исследований биомедицинских клеточных продуктов отсутствует на сайте Минздрава РФ в свободном доступе.
Список медицинских организаций, аккредитованных на проведение клинических исследований БМКП, находится на сайте Государственного реестра лекарственных средств https://grls.rosminzdrav.ru/.
Процедура вывода БМКП на российский рынок достаточно трудоёмкая, длительная, и требует серьезных финансовых затрат. Согласно оценкам экспертов, проведение доклинических и клинических испытаний БМКП может длиться 9-11 лет. Также остаётся открытым кадровый вопрос. В связи с этим, фармацевтические компании и научно-исследовательские центры проводят обучающие курсы, направленные на повышение уровня профессионализма в данной области.
Развитие биомедицинских клеточных продуктов в РФ
В 2020 году Росздравнадзором была выдана первая в России лицензия на производство биомедицинских клеточных продуктов. Единственная производственная площадка, получившая лицензию на производство биомедицинских клеточных продуктов в России – АО «Генериум». В рамках действующей лицензии АО «Генериум» планирует вести разработки и осуществлять производство ряда уникальных аутологичных, аллогенных и комбинированных БМКП, а также средств персонализированной терапии и диагностики, в том числе, направленных на борьбу с пандемией коронавирусной инфекции (COVID-19).
Подводя итог, можно отметить, что Россия всё еще на начальном этапе разработки биомедицинских клеточных продуктов. Необходимо продолжать совершенствовать нормативно-правовую базу, обеспечивать качественную подготовку специалистов на всех этапах работы, создать ассоциацию производителей БМКП, подготовить необходимую инфраструктуру. Кроме того, полезным будет и обращение к зарубежному опыту разработки и внедрения БМКП, ведь на мировом рынке существует уже около 30 зарегистрированных препаратов на основе клеточных технологий.
Генные и клеточные лекарства: сложное регулирование для сложных продуктов
Генные и клеточные лекарства: сложное регулирование для сложных продуктов
Как и в случае прочих лекарств, разработка генной и клеточной терапий строго регулируется. В связи с новизной и сложностью объектов в этой области много интересных особенностей.
Автор
Редакторы
Во второй статье нашего спецпроекта мы расскажем об особенностях регулирования генных и клеточных продуктов, о трудностях, с которыми сталкиваются разработчики в связи с невообразимой сложностью этих лекарств и о способах, которыми обеспечивается качество в процессе их разработки и производства.
Генная и клеточная терапии
Спецпроект о генной и клеточной терапиях, тернистом пути их развития, первых успехах и надеждах, а также о сложностях регулирования, производства и изучения этих новейших методов лечения.
Партнер спецпроекта — Департамент разработки генотерапевтических препаратов одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
В первой статье спецпроекта о генной и клеточной терапиях («Генная терапия: познакомьтесь с лекарствами будущего» [1]) рассказывается о генной терапии: ее истории, первых успехах и самых современных разработках. В этой статье мы поговорим о том, как регулируется эта область разработки и производства лекарств с точки зрения научных стандартов и критериев, как различия между более традиционными лекарственными средствами и передовыми генными и клеточными терапиями приводят к разнице в подходах к обеспечению контроля качества при их производстве.
Попытки использования генетических и клеточных технологий в медицинских целях для лечения или профилактики заболеваний насчитывают не одно десятилетие и стали предприниматься параллельно с созданием технологии получения рекомбинантных белков. В частности, первые указания FDA (U.S. Food and Drug Administration), делающие попытку упорядочить подходы к разработке таких продуктов и сформулировать критерии для выведения их на рынок, были приняты еще в далеком 1991 г. Вместе с тем первый препарат для клеточной терапии был одобрен в США только в 2010-м (аутологичная клеточная иммунотерапия бессимптомного или минимально симптомного метастатического гормон-резистентного рака предстательной железы — сипулейцел-T), а первый генотерапевтический препарат вышел на рынок США и вовсе в 2015 г. с целью местной терапии нерезектабельных кожных, подкожных и узловатых очагов у пациентов с меланомой, рецидивирующей после радикальной хирургии.
Вот и получается, что, несмотря на достаточно длительную историю разработки этих технологий, конкретная медицинская практика и ее первые плоды появились совсем недавно, а потому генные и клеточные терапии — всё еще очень новое лечение. Такой «неторопливый» старт показывает, что пока наших знаний и умений недостаточно для уверенного создания терапевтических продуктов, лечащих за счет модификации генетического аппарата или восполнения утраченных клеток. Сегодня вклад в медицину этой группы лекарств весьма скромен. Число одобренных продуктов не превышает нескольких десятков, а сами они предназначены для лечения, как правило, редких заболеваний. Но темп разработок растет, и многие заболевания уже находятся «на очереди» у генных и клеточных технологий, а потому нет основания не верить, что в итоге прилагаемые усилия увенчаются успехом.
Недостаточно разработать и протестировать эффективные и безопасные лекарственные препараты генной и клеточной терапий. Разработчикам также нужно организовать их производство и обеспечить всесторонний контроль качества технологических процессов. При этом надо максимально стандартизировать все процедуры, чтобы все производимые серии препаратов были идентичны по своим характеристикам.
Выработкой требований к лекарственным препаратам и критериев их оценки занимается регуляторная наука. Это целый комплекс научных дисциплин, которые имеют отношение к оценке качества, безопасности и эффективности препаратов и создают основу для принятия регуляторных решений на протяжении всего жизненного цикла лекарства. Регуляторная наука охватывает фундаментальные и прикладные медицинские и социальные науки, а также вносит вклад в разработку регуляторных стандартов и инструментов.
В связи с тем, что регуляция лекарств наиболее развита на территориях ICH (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, Международного совета по гармонизации технических требований к лекарствам для медицинского применения, поддерживающего систему руководств по научно обоснованной разработке лекарств), в первую очередь в США и ЕС, далее мы рассматриваем правила регулирования на основе того, как они изложены в руководствах ICH, а российских особенностей коснемся в последнем разделе.
Жизненный цикл лекарства совокупность всех фаз жизни препарата от начальной разработки до воплощения и окончательного вывода с рынка.
Принадлежность к биопрепаратам
Как «Биомолекула» уже писала раньше, историю новых лекарственных разработок удобно рассматривать как идущие друг за другом три поколения лекарств. Первое — низкомолекулярные лекарства, второе — биопрепараты, а третье — передовая терапия, в первую очередь генная и клеточная.
С регуляторной точки зрения генные и клеточные терапии — это лекарства, получаемые из биологических источников [2–4]. И те, и другие — макромолекулярные сущности с чрезвычайно сложными характеристиками, которые невозможно описать и установить полностью. Они производятся биологическими системами (включая организм человека в случае клеточных препаратов), что вносит большую вариабельность в результат процесса производства (об этой особенности биопрепаратов говорилось в материале «Биомолекулы» «Контроль качества биотехнологических продуктов» [5]). В этом ключе в отношении биопрепаратов еще на заре биотехнологической эры возникло понимание, метко описанное высказыванием, что процесс — есть продукт (process is the biologic) [6]. Другими словами, специалисты осознали, что характеристики получаемого биопрепарата (то есть его качество), определяющие профиль его безопасности и эффективности, неотделимы от условий и параметров его производства. Важное следствие: чтобы получить качественный продукт, необходимо строго контролировать параметры производства, потому что их вариабельность, скорее всего, приведет к отклонению в их эффективности и безопасности [7]. Этот факт имел и продолжает иметь конкретный практический аспект: если параметры процесса производства сильно влияют на качество получаемого продукта, то контроль параметров производства вносит существенный вклад в общий профиль качества, а вариабельность таких условий может приводить к получению продукта с другими характеристиками, а по сути, нового продукта.
Эти особенности биопрепаратов определяют [6], [8], [9]:
В то время как для лекарств, содержащих низкомолекулярные действующие вещества, качество нередко можно обеспечить с помощью выборочных испытаний конечного продукта, для биопрепаратов это невозможно. Поэтому определение биопрепарата в Европейском [3] и в Евразийском экономическом [4] союзах выглядит так:
Биопрепарат лекарство, действующее вещество которого вырабатывается биологическим источником или выделяется из него, требующее в целях установления его характеристик и определения его качества комбинации физико-химических и биологических испытаний вместе с испытаниями процесса производства и его контроля.
Биопрепараты делятся на:
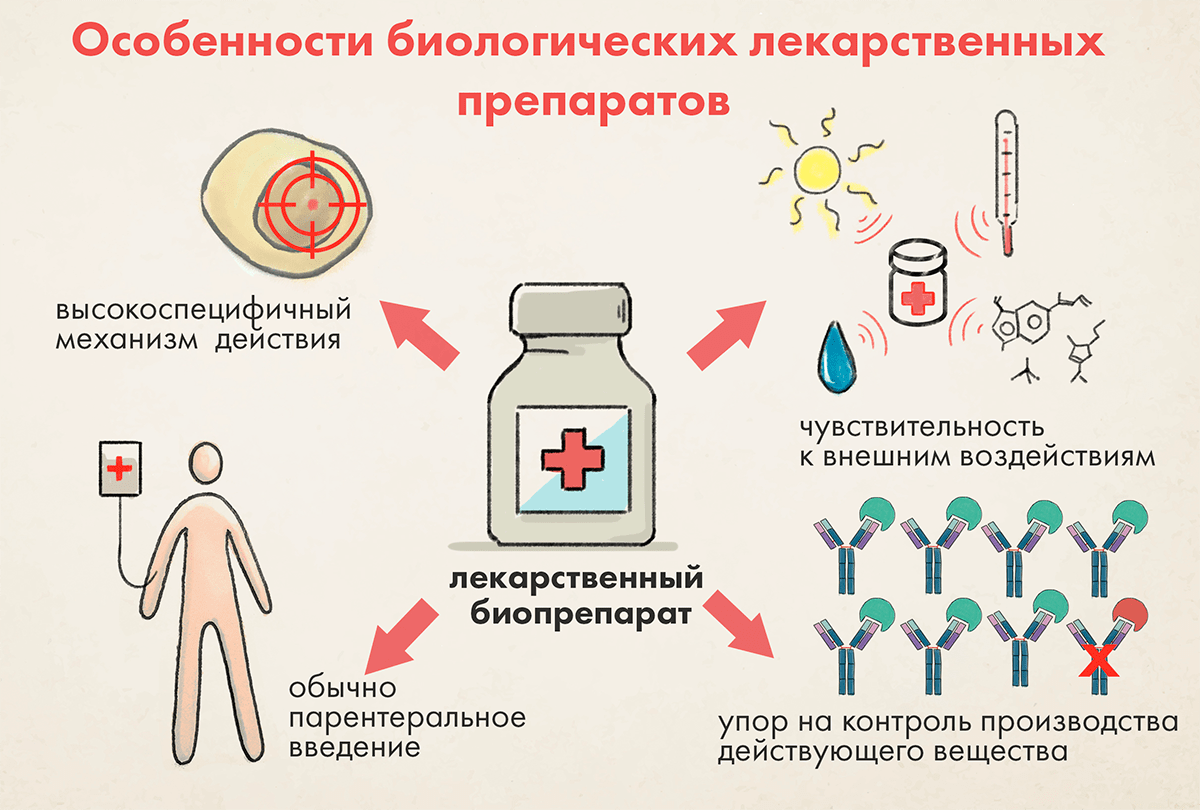
Рисунок 1. Основные особенности биопрепаратов, отличающие их от низкомолекулярных лекарств
Всесторонний контроль качества не ограничивается тестированием качества биопрепарата по окончании всего процесса производства, а состоит из следующих аспектов (рис. 1):
Из таблицы видно, насколько биопроцессы сложнее процессов химического синтеза низкомолекулярных веществ. Более того, чем более сложную организацию имеет производимое биологическое вещество, тем труднее будет создать, поддерживать и контролировать этот процесс. А генная и клеточная терапии — это на сегодняшний день и есть самые сложные в производстве биологические препараты.
Хотя у биологических лекарственных препаратов есть общие черты, отличающие их от низкомолекулярных веществ, они представляют собой достаточно неоднородную группу. Разные биопрепараты могут существенно различаться между собой как по характеристикам безопасности и эффективности, так и с точки зрения производства и контроля качества.
Рассматриваемые нами препараты передовой терапии хотя и объединены в общую категорию, также сильно отличаются друг от друга, пересекаясь только в случае терапевтических генетически модифицированных клеток (например, CAR-T [12]; свежий пример одобренного FDA препарата CAR-T — препарат для лечения мантийноклеточной лимфомы брексукаптагена аутолейцел, Tecartus), которым присущи особенности как генотерапевтических конструкций, так и клеточных препаратов. Тем не менее важно рассмотреть отличия передовых терапий от наиболее обширной и развитой группы биопрепаратов — рекомбинантных терапевтических белков. В таблице 2 приведены важные различия в производстве рекомбинантных белков и препаратов передовой терапии, которые приводят к соответствующим рискам для пациента, а также определяют стратегию контроля для их минимизации. Кроме того, особенности производства и контроля также влияют на затраты и тем самым на доступность лекарств для здравоохранения.
| Рекомбинантные белки | Генотерапевтики | Клеточные препараты | |
|---|---|---|---|
| Разработка препарата | Генная инженерия | Генная инженерия | Человеческий материал (иногда в сочетании с генной инженерией) |
| Физическая доступность исходных материалов | Высокая | Высокая | Низкая в случае аутологичных препаратов |
| Источник | Система банков клеток | Система или системы банков клеток (экспрессирующая конструкция, пакующие клетки) | Сами клетки человека (аутологичные препараты) или банк клеток (аллогенные) |
| Клональность | Да | Да | Может быть в случае аллогенных препаратов |
| Возможность установления физико-химических и биологических характеристик | Очень высокая | Умеренная | Сильно ограниченная |
| Очистка | Высокая | Средняя | Почти отсутствует |
| Удаление / инактивация вирусов | Да | Ограниченно | Нет |
| Микробиологические риски | Ничтожны | В случае вирусных векторов — из самого вектора. Есть риск того, что при производстве аденовирусного препарата останутся не инактивированные вирусные частицы | Высокие |
| Выпускающий контроль до введения пациенту | Полный | Полный | Неполный (например, мы не в состоянии, провести формальные микробиологические тесты для CAR-T) |
| Хранение | Длительное | Длительное | Хранение клеток в жидком азоте практически не ограничено по времени, но лимитируется регуляторикой, однако не все клетки хранятся таким образом, для некоторых хранение сверхкороткое или невозможно |
| Трудоемкость и сложность процесса в расчете на дозу | + | ++ | +++, особенно для аутологичных препаратов |
| Основной риск примесей | Иммуногенность | Иммуногенность, вирулентность | Туморогенность, эктопическое биораспределение |
Препараты на основе клеток
Терапевтические продукты на основе клеток достаточно разнообразны:
В нашей статье мы не будем рассматривать ксеногенные материалы и трансплантацию органов и остановимся только на продуктах человеческого происхождения. В качестве лекарственных препаратов регулируются только те клетки человека, которые подвергаются существенным манипуляциям для наделения их полезными свойствами (например, генетической модификации, обработке факторами роста и т. д.) или наращивания биомассы [3], [13]. Регулирование в качестве лекарственных препаратов — самое строгое среди всех потребительских товаров и предполагает выполнение обширных требований, направленных на обеспечение не только их безопасности для пациентов, но и обладание ими заявляемых терапевтических свойств (эффективности) [14].
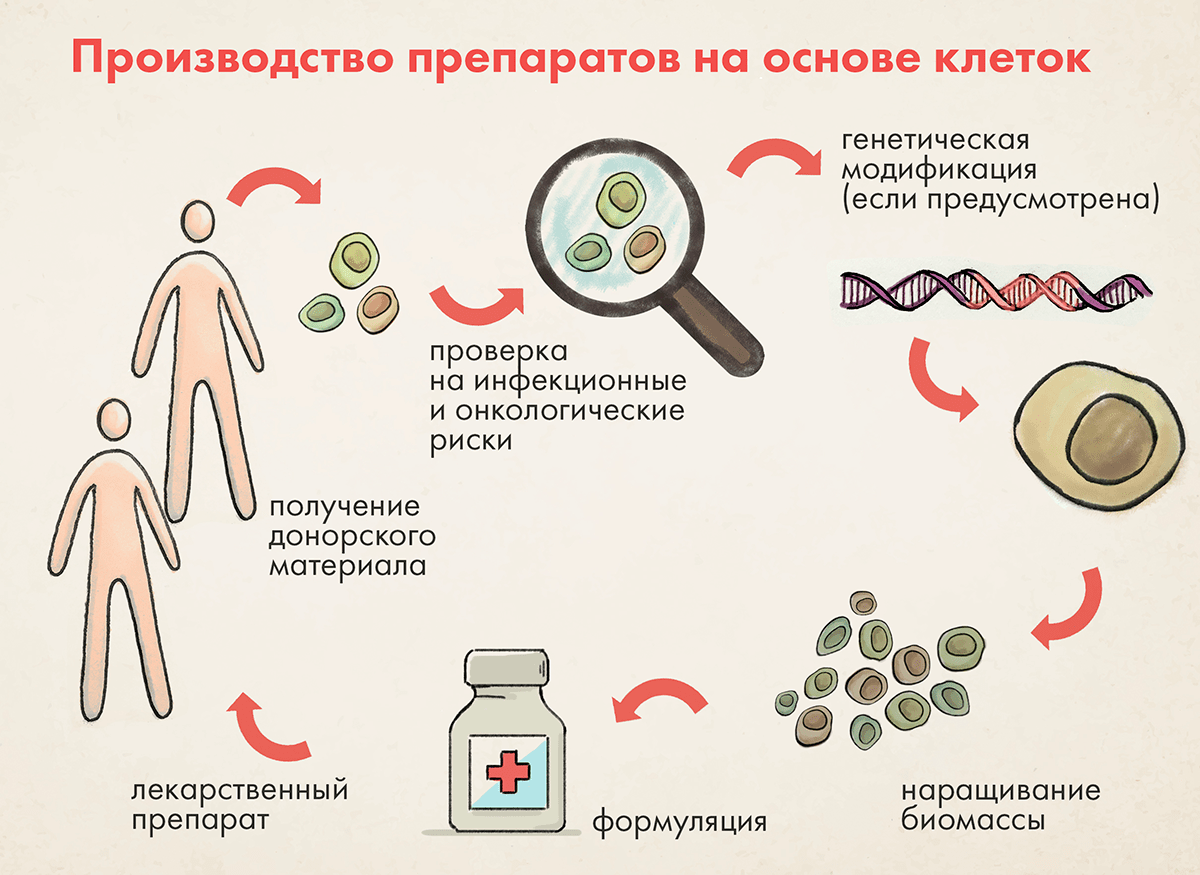
Отправная точка производства клеточных препаратов — клетки человека (рис. 2). Их получают от живых или посмертных доноров.
Рисунок 2. Схематическое представление стадий получения клеточных лекарственных препаратов. Источником клеток является человек. Взятые из источника клетки оцениваются на предмет рисков, подвергаются различным модификациям, дозируются и вводятся либо донору клеток, либо другим реципиентам.
Живые клетки человека могут быть опасны, поэтому в ходе фармацевтической разработки необходимо решать следующие проблемы или минимизировать связанные с ними риски [15–19]:
Будучи живыми, клетки очень восприимчивы к любым неблагоприятным воздействиям в процессе производства. Производство клеточного препарата — это комплекс манипуляций с исходным донорским материалом для придания ему желаемых новых биологических свойств или для его наращивания, чтобы получить достаточную дозу. Примеры манипуляций: обработка факторами роста, факторами дифференцировки, наращивание, генетическая модификация. Все эти процессы требуют для своего проведения строго контролируемых условий, по четко составленному, выверенному и отработанному плану, чтобы минимизировать любые отклонения.
Невозможность всесторонне охарактеризовать продукт производства означает, что он фактически определяется условиями и параметрами производства (процесс есть продукт). Следовательно, любые вариации процесса производства могут приводить к получению клеток с ранее неизвестными характеристиками, в том числе токсичными или неэффективными. Невозможность аналитически охарактеризовать клетки вынуждает сильно полагаться на результаты доклинических и клинических исследований.
Некоторые клеточные препараты могут требовать соблюдения труднодостижимых условий. Например, лекарственный препарат Kymriah (тисагенлеклейцел) должен храниться при температуре −120 °C или менее, тогда как лекарственный препарат Provenge (сипулейцел-T) мог храниться всего 18 часов при температуре 2–8 °C, а Strimvelis вообще хранится только 6 часов при температуре 15–30 °C [25]. Примечательна судьба лекарственного препарата Provenge. В 2015 г. он был выведен с рынка из-за коммерческой невыгодности проекта в связи с очень дорогим производством и сложной цепью поставок. Компания Dendreon построила три крупных производственных комплекса в США, при этом стоимость расходных материалов составляла около 70% в структуре выручки при цене 93 тыс. долл. за курс лечения. Вкупе с переоцененным спросом это привело к коммерческому провалу проекта и выведению его с рынка [17].
Кроме того, децентрализация производства требует наличие высококвалифицированного персонала в достаточном количестве в том месте, где будет осуществляться деятельность, что также может накладывать ограничения на реализуемость проекта. Эти ограничения особенно значимы при попытке организации производства клеточных препаратов в больничных условиях, где создание GMP-окружения требует дополнительных крупных вложений.
Все вышеперечисленные технологические ограничения в совокупности с относительно скромными достижениями в области регенеративной медицины с использованием клеточных лекарственных препаратов (то есть препаратов, содержащих модифицированные клетки) сильно тормозят развитие клеточных технологий, хотя спрос на эти препараты очень высок и продолжает быть сильно неудовлетворенным. Вместе с решением вопросов эффективности и безопасности клеточных препаратов отрасли предстоит решить проблемы их серийного выпуска: желательно, чтобы можно было использовать стандартизированные банки аллогенных клеток для универсального применения у разных пациентов вне зависимости от иммунологической совместимости или с возможностью индивидуализации. Такие банки должны быть охарактеризованы и максимально свободны от микробных контаминантов, а условия хранения и транспортировки не должны накладывать сильных ограничений на цепи поставок.
Генные терапии
Воздействие генной терапии по определению направлено на генетический аппарат клеток человека с терапевтической или профилактической целями. Европейское и американское законодательства рассматривают генотерапевтические препараты в качестве биологических [2], [3]. Тем самым антисмысловые олигонуклеотиды (-ерсены) [26] и препараты для РНК-интерференции (-сираны), получаемые при помощи химического синтеза, к генотерапевтическим не относятся. Классификационные подходы, содержащиеся в европейском законодательстве, перешли в законодательство ЕАЭС и выражены в части IV (раздел 17) приложения №1 к Правилам регистрации и экспертизы лекарственных средств для медицинского применения в Евразийском экономическом союзе [4].
С точки зрения того, в каких именно условиях происходит генетическая модификация, генные терапии принято разделять на препараты для модификации in vivo и препараты для модификации ex vivo. Первые — это неклеточные препараты, включающие препараты «голой» ДНК, препараты на основе невирусных векторов (например липосом), препараты на основе вирусных векторов или вирусоподобных частиц и препараты генетически модифицированных микроорганизмов (в первую очередь, бактерий). Они вводятся в организм человека с целью генетической модификации генетического материала клеток-мишеней.
При модификации ex vivo у пациента отбирают клетки, генетически модифицируют их и возвращают в организм (самого пациента-донора или других реципиентов). Помимо особенностей, присущих всем генотерапевтическим препаратам, для лекарственных препаратов на основе генетически модифицированных клеток характерны все те особенности, которые рассмотрены в отношении клеточных препаратов.
Проблемы производства и контроля качества генотерапевтических препаратов лежат в нескольких плоскостях и вызваны следующими факторами [18], [27–29]:
При этом использование таких технологий доставки само по себе поднимает вопрос обеспечения их безопасности. Первые провалы применения генных терапий были связаны именно с иммуногенностью аденовирусных векторов-носителей: история Джесси Гелсингера [1] еще долго будет нависать над разработчиками этих препаратов.
Несмотря на сегодняшние достижения, всё равно не удается добиться ни полной специфичности в отношении клеток-мишеней, ни эффективной генетической модификации всех пораженных клеток. Недостаточная эффективность доставки терапевтического трансгена в целевые клетки особенно характерна для «защищенных» органов, таких как головной мозг.
Вследствие иммуногенности к вирусным векторам возможность их повторного использования ограничена, поэтому большинство генотерапевтических препаратов предназначено для однократного введения [27]. Если требуется неоднократное введение, необходимо продумать создание альтернативных систем доставки, что, по сути, предполагает создание нового лекарственного препарата с необходимостью полной характеристики его безопасности, эффективности, контроля производства и контроля качества.
В остальном получение и контроль качества генотерапевтических препаратов очень похожи на получение рекомбинантных белков [27]. Процесс получения предусматривает использование одного или нескольких процессов культивирования. Если используются невирусные методы доставки, то достаточно произвести только последовательность ДНК, как правило, с помощью E. coli. В случае же вирусных векторов необходимо также произвести вирусоподобные частицы или полноценные вирусные векторы. Это достигается использованием так называемых пакующих клеточных линий. Если вирусный вектор нуждается в помощнике, то может потребоваться производство вируса-помощника на клеточной линии, предназначенной для этого.
Если генотерапевтическим лекарственным препаратом являются генетически модифицированные (ГМ) клетки (например, CAR-T, ГМ-макрофаги [30], ГМ-NK-клетки [31]), то учитываются как особенности клеточных препаратов, так и бесклеточных генотерапевтических.
Ввиду сложности процессов производства, очень ограниченных возможностей по очистке от всевозможных примесей (в том числе, к примеру, не подвергшихся генетической модификации клеток, клеток других типов, присутствующих в образце) и инактивации микробных контаминантов, единственным действенным инструментом контроля качества препарата является правильно спланированный, всесторонне охарактеризованный процесс, который подвергся полноценной валидации. Валидация процесса производства предполагает подтверждение того, что итогом процесса производства станет лекарственный препарат требуемого качества. Для этого процесс повторяют много раз и всесторонне устанавливают характеристики входных материалов, промежуточных продуктов производства и конечного препарата. В итоге нужно подтвердить, что выбранные параметры процесса производства в должной мере отвечают цели, сформулированной во время разработки препарата [27].
Пример производства генной терапии
Разберем на примере генотерапевтического препарата Luxturna (воретигена непарвовек), зарегистрированного FDA в 2017 году для лечения одного из видов наследственной дистрофии сетчатки, как устроен процесс производства препарата и какие требования предъявляет к нему FDA. О самом препарате можно прочесть в предыдущей статье нашего цикла
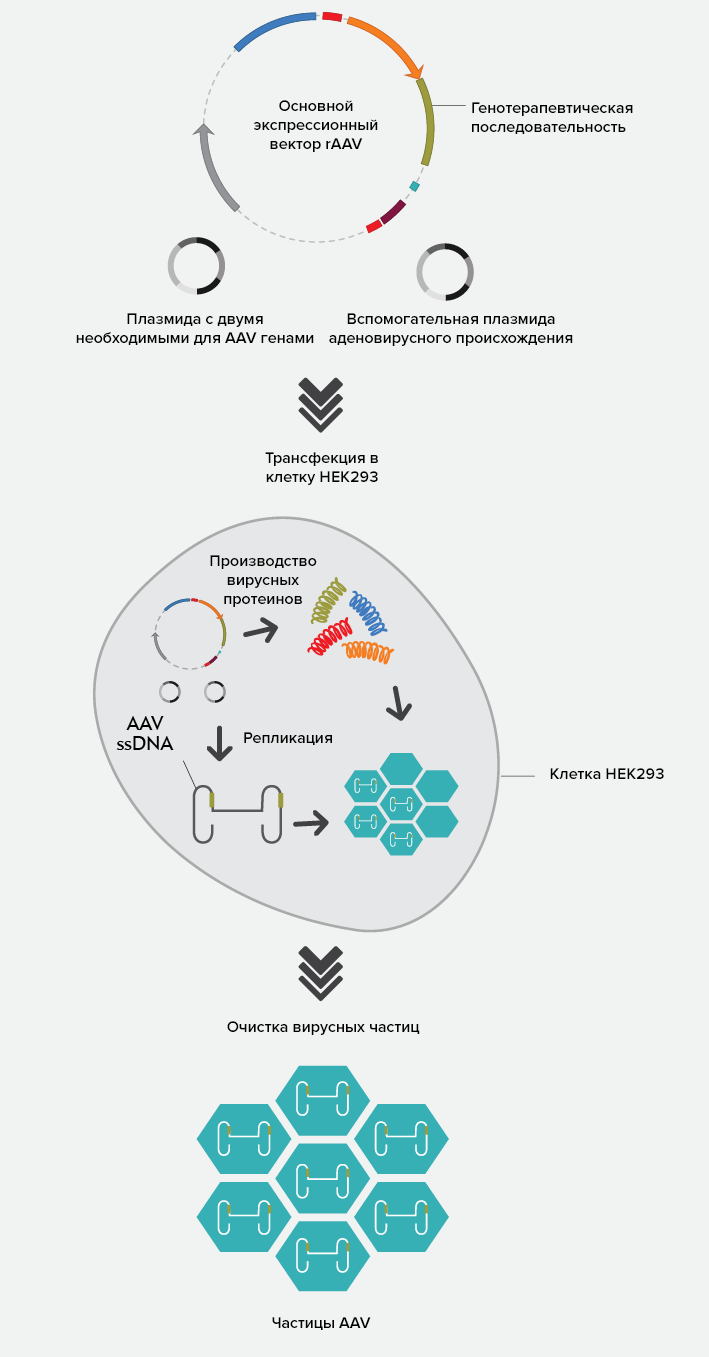
Для получения лекарственного вещества — рекомбинантного аденоассоциированного вируса, содержащего терапевтический ген, — используются клетки почки человеческого эмбриона HEK293. Клетки клеточной линии HEK293 осуществляют биосинтез как терапевтического гена, так и компонентов системы доставки — вирусного вектора. Для этого их трансдуцируют тремя плазмидами, содержащими:
Такой подход позволяет избежать использования живого вируса-помощника в процессе производства, что очень важно, ведь обычные методы удаления и инактивации вирусов невозможно применить к продукту на основе вирусного вектора.
Рисунок 3. Схема производства частиц AAV с терапевтическим геном
После культивирования в реакторе клетки собирают, подвергают фильтрации и катионообменной хроматографии. Затем препарат центрифугируют в градиенте плотности и еще раз фильтруют.
В публичном экспертном отчете FDA подробно описаны шаги производственного процесса, исходные материалы (банк клеток, плазмиды), приведены их спецификации и методы контроля. Характерно, что и до, и после подачи заявления на одобрение для продажи (в США она в случае биологических продуктов называется заявлением на лицензирование биопрепарата — biologics license application, BLA) FDA принимала очень активное участие в процессе, запрашивая у компании Spark множество уточнений и заставляя доделывать недостающие аспекты производства. Так, оказалось, что у компании были проблемы с обеспечением постоянства содержания одного из вспомогательных веществ в финальном продукте, однако после замечания FDA проблема была устранена.
Для всех стадий процесса были идентифицированы критичные параметры, критичные методы внутрипроизводственного контроля и диапазоны приемлемых значений. Затем была проведена валидация производственного процесса на одной серии продукта, произведенной в промышленном масштабе.
Продукт для клинических исследований производился на базе Филадельфийского детского госпиталя, а для коммерческого производства — на мощностях частной фирмы. Компания Spark провела исследования сопоставимости продуктов, полученных с помощью разных процессов производства, для доказательства того, что смена места производства не сказалась негативным образом на характеристиках безопасности и эффективности.
Директор компании в интервью рассказал, что досье для подачи BLA заняло 60 000 страниц, причем бóльшая часть объема была посвящена именно производству и методам его контроля. Компания разработала 41 испытание для оценки конечного продукта. Через два года после одобрения компания смогла перейти на биореакторы объемом 400 литров: это было непросто, так как нужно было научиться выращивать клетки в объеме, а не только в пристеночном слое. Теперь открылись возможности для масштабного производства генной терапии, что необходимо для более распространенных заболеваний.
Проблемы регулирования
Несмотря на то что идеи использования клеточных и генных препаратов в терапевтических целях не новы и насчитывают несколько десятилетий, более-менее систематическое их применение началось относительно недавно, и им еще только предстоит войти в основной арсенал используемых медицинских технологий.
Регуляторные требования, которые должны приниматься во время разработки, производства и контроля качества генотерапевтических и клеточных препаратов, учитывают различные особенности передовых терапий, риски и тяжесть их последствий. В частности, помимо упомянутого выше многоуровневого контроля микробиологических рисков, в отношении генотерапевтических препаратов действует отдельная отрасль законодательства в области генетически модифицированных организмов. Для оценки его соблюдения в Евросоюзе, к примеру, сформирована и действует отдельная система регулирования, отличная от системы регулирования лекарств [32–35]. Удовлетворение этих требований дополнительно осложняет разработку и производство генотерапевтических препаратов [36].
Беспрецедентными являются и меры контроля за препаратами передовой терапии после их введения пациенту. В ЕС наблюдение за такими пациентами должно длиться по меньшей мере 30 лет. Кроме того, должна быть обеспечена полная прослеживаемость от исходных материалов (например донорских клеток), до индивидуальных доз и далее до конкретных пациентов, и в обратном направлении, чтобы можно было однозначно идентифицировать «виновные» дозы и исходные материалы, если у пациента что-то пойдет не так, даже, к примеру, 25 лет спустя.
Регуляторные стандарты безопасности и эффективности препаратов передовой терапии, часть из которых воплощается в требованиях к производству и контролю качества, а также нередко индивидуальный характер разработок, делает их очень дорогими. Тем самым исследователи находятся под постоянным финансовым прессом из-за ограниченности ресурсов. С другой стороны, это вынуждает искать более экономичные методы разработки и миниатюризации производства, а также максимального приближения производственных мощностей к пациенту с целью экономии на транспортировке и хранении.
С экономическими аспектами тесно связана возможность воспроизведения препаратов для передовой терапии, которую целесообразно рассматривать с разных позиций, в том числе с точки зрения технической реализуемости, регуляторной реализуемости, экономической целесообразности, интеллектуальных прав и т. д. В целом движущая сила разработки воспроизведенных препаратов — возможность ценовой конкуренции с инновационным препаратом за счет экономии на разработке. Экономия на разработке исходит из ненужности повторения обширных доклинических и клинических исследований, которые были проведены разработчиком оригинального препарата, при условии того, что материальный носитель лекарственного препарата воспроизведен во всех критичных аспектах.
На сегодняшний день проблема воспроизведения клеточных препаратов и сложных генотерапевтических препаратов на основе вирусных векторов — задача труднореализуемая. Она требует приобретения образцов оригинального препарата, обратную инженерию его состава и структуры и дальнейшие масштабные лабораторные испытания для оценки успешности воспроизведения, прежде чем прототип будет готов к доклиническим и клиническим исследованиям. Уже на этом этапе разработчик столкнется со сложностями, поскольку образцы оригинального препарата могут быть запредельно дорогими, а в ряде случаев изготавливаться по индивидуальному заказу. Что касается трудностей воспроизведения таких сложных материальных объектов как вирусные векторы или живые клетки человека, следует отметить, что на сегодняшний день не воспроизводятся даже «простые» ферменты или факторы свертывания крови, которые, будучи сложнее моноклональных антител, тем не менее, гораздо проще по строению препаратов передовой терапии.
К техническим сложностям, которые сами по себе решаемы в долгосрочной перспективе, добавляются сложности научно-регуляторного характера. Нынешние препараты передовой терапии, как правило, предназначены для лечения редких заболеваний. Чтобы статистически подтвердить эквивалентность воспроизводимого препарата инновационному, в случае биопрепаратов, как правило, требуется выполнить сравнительные клинические исследования. Выборка для подтверждения эквивалентной эффективности может быть очень большой, достигая сотен человек, что для орфанных заболеваний может быть достаточно проблематично. Кроме того, обеспечение пациентов оригинальным препаратом тоже внесет большую лепту в стоимость исследования. В этом ключе гораздо дешевле и быстрее может оказаться разработка аналога с некоторыми второстепенными отличиями от оригинала, нежели полное воспроизведение [37–39]. Например, клиническая программа разработки аналогов рекомбинантных ферментов для лечения орфанных заболеваний или факторов свертывания крови обычно достаточно сжатая, требует всего несколько десятков пациентов и может даже не требовать сопутствующего сравнения с оригинальным препаратом. В этой связи гораздо важнее может быть воспроизведение терапевтического результата, а не самого лекарственного препарата.
Проблемы регулирования и производства генных и клеточных продуктов в России
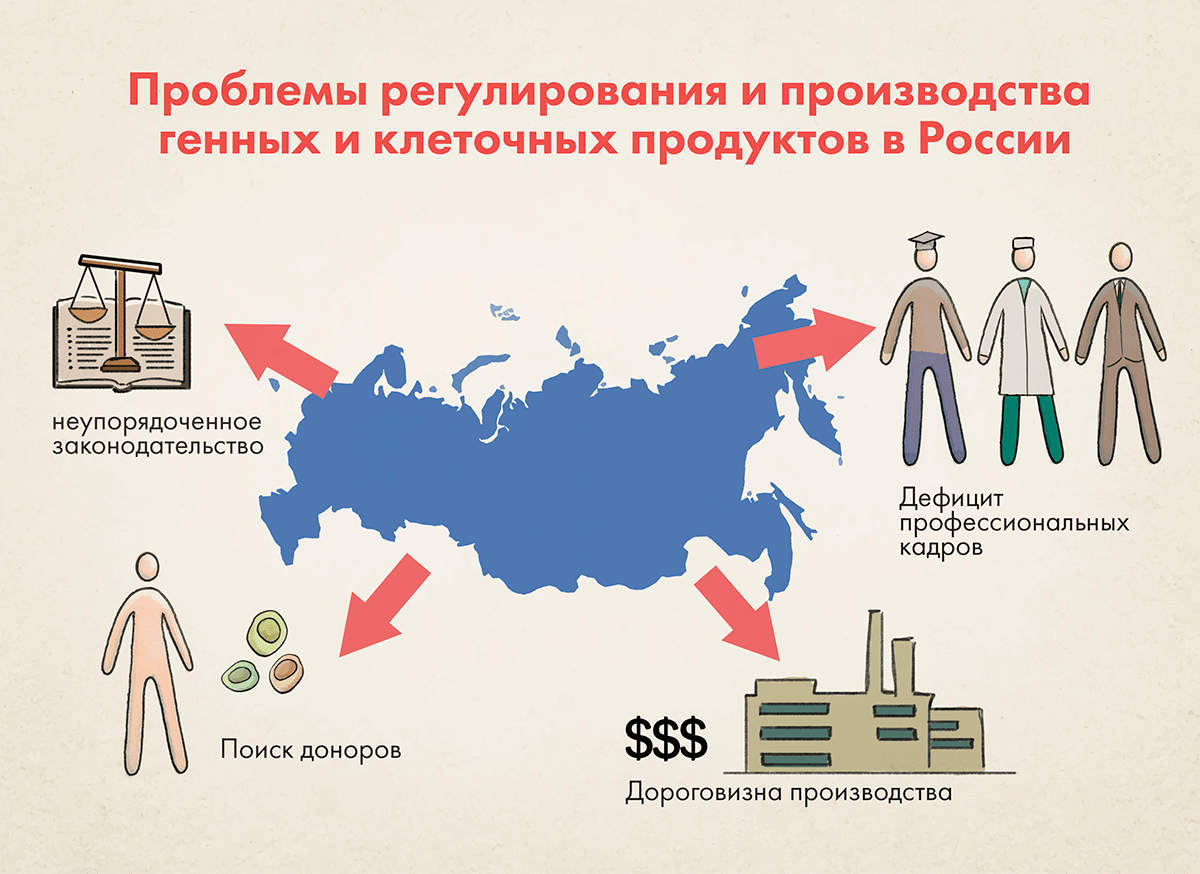
Проблемы регулирования и производства генных и клеточных продуктов в России (рис. 4) обусловлены как общим отставанием в развитии фармацевтической отрасли и подходов к ее регулированию от ведущих зарубежных юрисдикций, так и специфичными проблемами, присущими именно этой области разработки, производства, изучения и регулирования терапевтических продуктов. Здесь мы остановимся только на специфичных проблемах.
Рисунок 4. Схематическое представление основных проблем, затрудняющих вывод клеточных препаратов на рынок в России
Основная проблема, трудно устранимая в кратко- и среднесрочной перспективе, — дефицит кадров. Эта сфера остро нуждается в биотехнологических и биохимических инженерах, специалистах в области биомедицинского анализа и визуализации, генетиках, фармацевтических микробиологах, специалистах в областях системной и вычислительной биологии, механики жидкостей, микрофлюидики и вычислительной динамики жидкостей. В нашей стране таких специалистов очень мало, а вузовские программы сильно отстают от ведущих мировых программ.
Следующим ограничением является дороговизна создания и поддержания производственных мощностей для производства клеточных препаратов, в которых должны соблюдаться строжайшие требования к асептическому производству, постоянству окружающих условий, разделению потоков производимых препаратов, специальным методам очистки и т. д. В случае индивидуализированных препаратов, например таких, как CAR-T, порой, весь производственный цикл осуществляется ради получения одной дозы для одного пациента. Точно так же выполняемый во время производства и по его завершении комплекс аналитических испытаний для оценки качества препарата на различных стадиях его получения реализуется для одной дозы или относительно небольшого их числа.
Не решены проблемы в области донорства и заготовки клеток, оценки и минимизации рисков при использовании генетически модифицированных организмов. Для ряда разрабатываемых препаратов в стране отсутствуют высокотехнологичные лаборатории, оснащение которых позволяло бы проводить широкий спектр испытаний на рецепторах, отдельных клетках, тканях и крупных животных (например, собаках, минипигах, нечеловекообразных приматах и др.), которые бы отвечали международным требованиям по обеспечению достоверности научных данных и гуманному обращению с животными.
Наконец, локальное законодательство в области генных и клеточных препаратов неупорядоченное и противоречивое. Отсутствует единое восприятие и отношение к ним как к подгруппе лекарственных препаратов, требующих дополнительных методов обеспечения безопасности, эффективности и качества. Основная проблема сегодняшней регуляторики этой сферы — отсутствие гармонизации с зарубежными подходами, требованиями и даже определениями. В частности, не выработаны частные критерии, предъявляемые к условиям и параметрам производства, оцениваемым показателям качества, целям, разновидностям и объему доклинических и клинических исследований в зависимости от вида разрабатываемого препарата, его терапевтического назначения и рисков для пациентов. Отсутствие специальных критериев для препаратов генной и клеточной терапий усложняет проведение исследований в полном объеме. Вместе с тем регуляторные проблемы — наименее сложные (их можно решить несколькими приказами Минздрава, тогда как, например, проблему недостатка кадров решить гораздо сложнее), поскольку сейчас ничто не мешает разработчикам ориентироваться на зарубежные требования, которые, пусть и обширны, но упорядочены и помогают сориентироваться в сложном процессе изысканий, разработки и проведения испытаний и исследований.
Мнение эксперта
Интервью Павла Гершовича «Биомолекуле»
Рисунок 5. Павел Гершович
Павел Гершович — директор Департамента разработки генотерапевтических препаратов компании BIOCAD, кандидат биологических наук, и.о. директора Научно-образовательного центра технологии рекомбинантных белков СПХФУ.
В компании BIOCAD Павел курирует работу по созданию генной терапии для лечения гемофилии, спинальной мышечной атрофии и других тяжелых наследственных заболеваний.
«Биомолекула»: Какова, по вашему опыту, трудоемкость процесса производства клеточных или генотерапевтических препаратов в расчете на дозу в сравнении с биотехнологическими белками?
Павел Гершович: Трудоемкость производства генотерапевтических и клеточных препаратов сильно варьирует в зависимости от природы генетического вектора и расчетной дозы препарата для введения пациенту. В сравнении с рекомбинантными белками, в том числе антителами, в среднем трудоемкость процесса пока остается значительно выше. Увеличение количества стадий производства неминуемо влечет за собой дополнительные трудозатраты. Это обусловлено тем, что для производства генотерапевтических лекарственных препаратов, или БМКП (биомедицинских клеточных продуктов — термин из российского законодательства; прим. ред.), используются генетические векторы различной природы, являющиеся полупродуктами финального биотехнологического процесса.
«БМ»: Рассматриваете ли вы децентрализацию производства как один из подходов для удешевления производства за счет приближения лекарства к пациенту?
ПГ: Децентрализация производства актуальна далеко не для всех генно-клеточных видов терапии. Такой подход может сильно упростить производство и клиническое применение большинства типов аутологичной передовой терапии, таких как БМКП для регенеративной медицины и CAR-T-терапии онкологических заболеваний. В системе производства, где пациент является единственным донором исходного материала и реципиентом конечного продукта, масштаб производства не имеет решающего значения. Если биомедицинская технология работает «у постели больного», это существенно сокращает затраты на производство и выводит доступность терапии на новый уровень. К сожалению, в нашей стране законодательство пока не позволяет в полной мере реализовать такую концепцию, что практически лишает шансов на выздоровление многих тяжело больных пациентов.
«БМ»: Какие регуляторные изменения компания хотела бы видеть в России?
ПГ: Гармонизация регуляторных требований по отношению ко всем видам препаратов передовой терапии на текущий момент является основой задачей. Мы имеем возможность анализировать и использовать накопленный опыт зарубежных коллег, чтобы создать все условия для роста и развития этой инновационной области фармацевтики в нашей стране.
«БМ»: Насколько российские практики производства, контроля качества отличаются от зарубежных? Насколько «Биокад» опирается на зарубежный опыт?
ПГ: «Биокад» неукоснительно соблюдает все требования регулятора, действующие на территории России. При этом мы придерживаемся стандартов качества, принятых на так называемых высоко регулируемых рынках. Производство любых типов лекарственных препаратов — это не статический процесс, а постоянное движение к совершенствованию технологических решений и системы контроля качества продукта, за которым стоит ежедневный кропотливый труд сотен специалистов.
Материал предоставлен партнёром — Департаментом разработки генотерапевтических препаратов компании BIOCAD
Заключение
Генные и клеточные терапии вносят пока незначительный общий вклад в арсенал терапевтических средств, уступая как низкомолекулярным лекарствам, так и рекомбинантным белкам. Однако эта область фармакологии активно развивается, следуя за научным прогрессом как в дисциплинах, лежащих в ее основе, так и в области производства и индивидуализации этих продуктов. Зарубежные регуляторы активно поддерживают развивающуюся отрасль, обобщая и формализуя свои рекомендации в виде научных и регуляторных руководств, направленных на систематизацию стратегии разработки, но с учетом индивидуальных особенностей новых препаратов, а также активно предлагают научные консультации, чтобы помочь компаниям выбрать наиболее оправданные пути продвижения вперед. Также у FDA и EMA есть специальных статусы для генотерапевтических и клеточных продуктов — например RMAT (Regenerative Medicine Advanced Therapy) у FDA, которые позволяют ускорить разработку продуктов и облегчить взаимодействие с агентствами.
В России некоторое улучшение регуляторной ситуации в области разработки лекарств ожидается с переходом на законодательство Евразийского экономического союза, которое во многих аспектах повторяет законодательство Евросоюза. В частности, есть надежда, что клеточная терапия будет регламентироваться не по закону 180-ФЗ, как «биомедицинские клеточные продукты», а как лекарства.
В будущем с точки зрения производства и контроля качества события будут развиваться в двух в определенной мере противоположных направлениях. Будут прорабатываться методы крупномасштабного производства препаратов, предназначенных для лечения распространенных заболеваний. Параллельно будут развиваться подходы индивидуализированного производства для получения препаратов под нужды конкретных пациентов.
В следующей статье цикла мы расскажем подробнее о клеточных терапиях, в первую очередь, конечно, о Т-клетках с химерным антигенным рецептором (CAR-T).