Бдс полиповидной формы что это значит
Полипы желудка
Тел.: 8-800-25-03-03-2
(бесплатно для звонков из регионов России)
Санкт-Петербург, наб. реки Фонтанки, д. 154
Тел.: +7 (812) 676-25-25
Санкт-Петербург, В.О., Кадетская линия, д. 13-15
Тел.: +7 (812) 676-25-25
Санкт-Петербург, ул. Циолковского, д.3
Тел.: +7 (812) 676-25-10
Дальнейшее отношение к выявленному во время видеоэзофагогастродуоденоскопии (ВГДС) полипу зависит от его гистологической верификации, этиологии (причины возникновения), естественной истории (развитие в динамике). После оценки полученных данных решается вопрос о необходимости лечения в данном клиническом случае или о проведении динамического наблюдения.
Классификация полипов желудка
Наиболее рациональным является классифицирование полипов по клиническим, морфологическим и гистологическим признакам. Чаще всего полипы имеют бессимптомное течение. Однако, осложненный вариант может проявляться кровотечением (признаки анемии, кровь в стуле), непроходимостью (тошнота, рвота), гастритоподобным течением (боли в верхних отделах живота) и малигнизацией (снижение массы тела и др. симптомы онкологического заболевания).
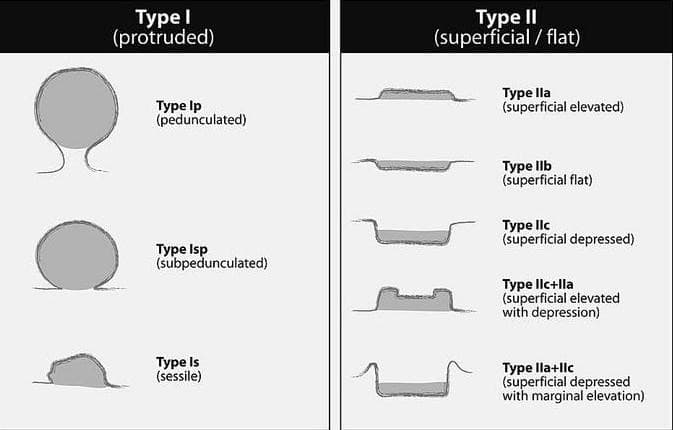
По морфологическим критериям полипы разделяют на солитарные (одиночные) и множественные, мелкие и крупные, мягкие и плотные. Учитывая, что видеогастроскопия является «золотым» стандартом в диагностике данной патологии, во всем мире признанной является Парижская классификация эпителиальных новообразований, согласно которой выделяют выступающие (0-Ip – на узкой ножке, 0-Isp – на зауженном основании, 0-Is – сидячие) и поверхностные (0-IIa – приподнятые, 0-IIb – поверхностные плоские, 0-IIc – слегка углубленные, смешанные варианты).
Ключевым моментом при выполнении эндоскопического исследования является не только правильная интерпретация найденного образования, но и возможность забора материала с последующим гистологическим подтверждением, что главным образом влияет на дальнейшую тактику лечения. В связи с этим представлены четыре группы полипов с их подробными характеристиками.
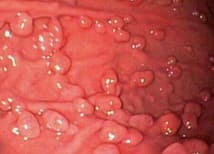
При хромоскопии и узкоспектральной эндоскопии (NBI) поверхность представлена рисунком по типу «пчелиных сот» с густой сосудистой архитектоникой. Изначально фундальные полипы связывали с гамартомами (образованиями, представляющими тканевую аномалию развития), однако, в большом числе исследований подтверждено, что механизмы, подавляющие секрецию соляной кислоты ингибиторами протонной помпы (ИПП), могут также участвовать в патогенезе развития фундальных полипов желудка.
Гистологически фундальные полипы представлены дилятированными (расширенными) кислотопродуцирующими железами, покрытыми плоскими париетальными и слизистыми клетками без признаков дисплазии. Выявление характерных полипов желудка у пациентов, принимающих ИПП, с большой долей вероятности диагностируют как полипы фундальных желез. При первичном осмотре один или более представленных полипов после взятия биопсии подвергают морфологической оценке для подтверждения диагноза. Большие полипы (более 10 мм), эрозированные, расположенные нетипично, например, в антральном отделе желудка, должны быть подвергнуты более агрессивной тактике ведения – эндоскопической полипэктомии.
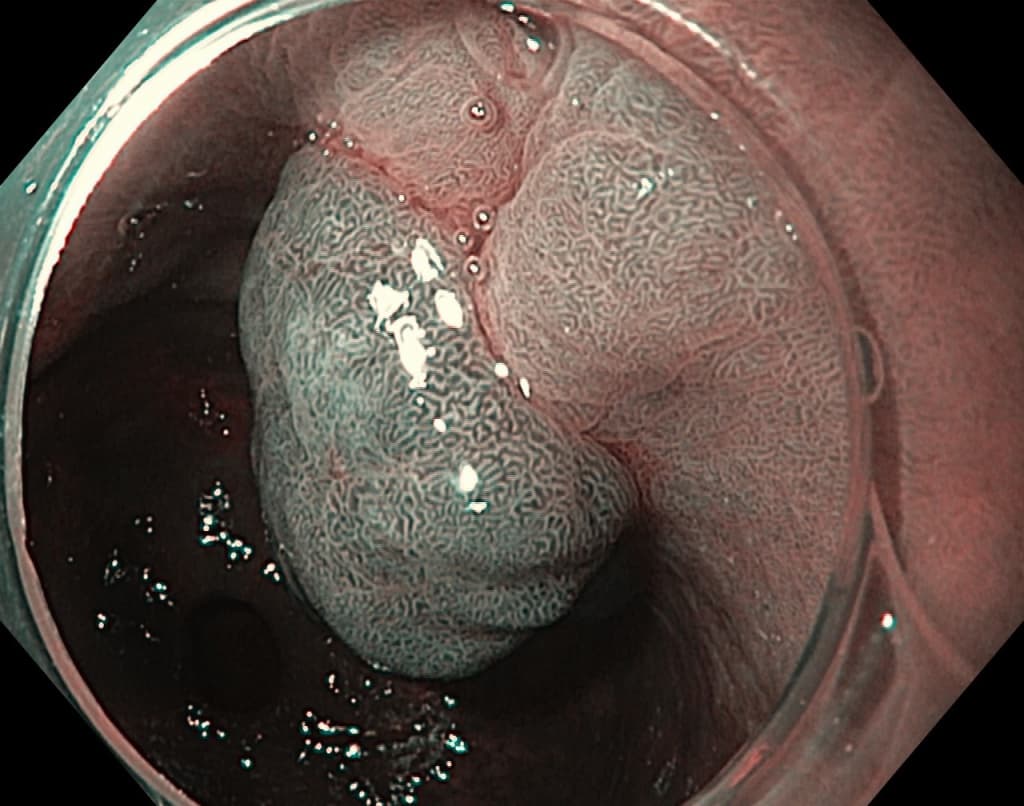
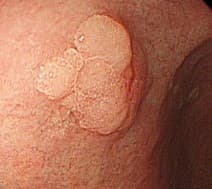
Эндоскопически они представлены солитарным одиночным образованием дольчатой формы с бархатистой поверхностью. Хотя они могут быть найдены в любом отделе, наиболее часто локализуются в антральном отделе желудка.
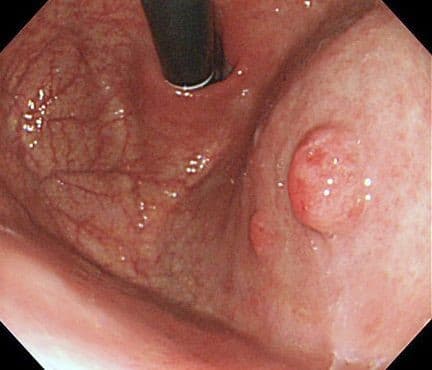
Лечение полипов желудка
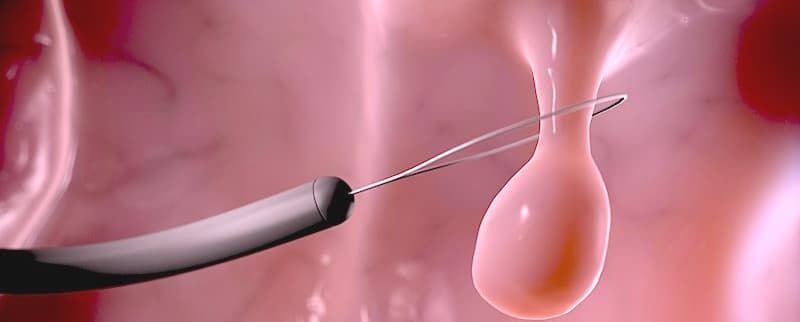
Как говорилось ранее, все аденоматозные и крупные полипы более 10 мм должны быть подвергнуты удалению. Каким же образом выполняется эндоскопическая полипэктомия или резекция слизистой?
Крупные экзофитные (выступающие) полипы на широком основании или плоские образования, которые невозможно удалить эндопетлей, подвергаются технически более сложному варианту эндоскопического удаления – диссекции в подслизистом слое. Данный вид операции направлен на радикальное удаление образования единым блоком: после создания «гидростатической подушки» выполняется циркулярный разрез вокруг образования специальными инструментами, после чего рассекаются соединительнотканные сплетения подслизистого слоя с полной ликвидацией патологического очага.
По современным представлениям, наиболее рациональным является наблюдение за пациентами после проведенной полипэктомии через 1 год. При этом оценивается состояние слизистой оболочки на предмет появления новых образований или рецидива на месте ранее выполненной операции. Если же после резекции образований гистологический ответ подтверждает наличие дисплазии высокой степени или же раннего рака, то контрольная гастроскопия должна проводиться в интервале: 1,5 мес.- 3 мес.- 6 мес. – 1 год и в последующем каждый год.
Профилактика полипов желудка
Целью профилактики является выявление образований желудка на ранних этапах развития. Рекомендуется выполнение эндоскопического исследования лицам старше 45 лет в качестве скрининга даже при отсутствии клинической симптоматики, так как заболевание проявляет себя лишь на поздней стадии, когда уже требуется хирургическое лечение. Следуя принципам онкологической настороженности, пациентам с отягощенным наследственным анамнезом, то есть при наличии онкологических заболеваний со стороны ЖКТ у ближайших родственников, требуется незамедлительный профилактический осмотр желудка и толстой кишки.
Как получить услугу в Клинике
В нашей Клинике проводятся все виды эндоскопических исследований на высококачественном оборудовании как под местной анестезией, так и под наркозом. Все выявленные патологические образования подвергаются гистологической верификации. Также проводится забор материала на наличие инфекции H.pylori и для определения стадии и степени выраженности воспалительных и атрофических изменений слизистой оболочки желудка (класс.OLGA), что свидетельствует, как говорилось ранее, о риске развития онкологического процесса.
Что касается оперативного эндоскопического лечения, то в клинике возможно его выполнение в амбулаторных и стационарных условиях. Решение принимает лечащий врач, опираясь на размеры патологических очагов, их количество, результаты гистологии и сопутствующую патологию.
Рак большого дуоденального сосочка
Рак большого дуоденального сосочка – злокачественная опухоль фатерова сосочка, расположенного в области двенадцатиперстной кишки. Характерен медленный рост и позднее метастазирование при раннем появлении механической желтухи. Наблюдаются боли, периодическое повышение температуры тела, увеличение печени и желчного пузыря. На поздних стадиях возможны кровотечения. Диагноз устанавливают с учетом симптоматики, данных рентгенографии, фиброгастродуоденоскопии и результатов биопсии. Лечение оперативное: гастропанкреатодуоденальная резекция, папиллэктомия, дуоденэктомия, паллиативные вмешательства.
Общие сведения
Рак большого дуоденального сосочка – злокачественная неоплазия большого дуоденального (фатерова) соска, локализующегося в нисходящей части двенадцатиперстной кишки и представляющего собой соустье главного панкреатического протока и общего желчного протока. Составляет 40% от общего количества онкологических поражений пилородуоденальной зоны, 5% от общего числа неоплазий ЖКТ и 1-2% от общего количества раков различных локализаций. Рак большого дуоденального сосочка является третьей по распространенности причиной возникновения механической желтухи. Обычно поражает пожилых пациентов, средний возраст больных составляет 54 года. Очень редко выявляется у детей. Женщины страдают реже мужчин. Лечение осуществляют специалисты в сфере онкологии, гастроэнтерологии и абдоминальной хирургии.
Причины рака фатерова сосочка
Причины возникновения опухоли точно не выяснены. Специалисты отмечают, что определенное значение имеет наследственная предрасположенность – заболевание нередко диагностируется в семьях, члены которой страдают семейным полипозом. Кроме того, у некоторых пациентов выявляется генетическая мутация K-ras. Установлено, что неоплазия может развиться в результате малигнизации аденомы фатерова соска. В список факторов риска также включают хронический панкреатит и заболевания гепатобилиарной системы.
Источником рака большого дуоденального сосочка являются трансформировавшиеся клетки эпителия слизистой двенадцатиперстной кишки, панкреатического протока либо общего желчного протока. Для новообразования характерен медленный экзофитный рост. По внешнему виду неоплазия напоминает папиллому, разрастание грибовидной формы или в виде соцветья цветной капусты. Реже выявляются эндофитные формы. При экзофитных формах рака большого дуоденального сосочка желтуха чаще ремиттирующая, при эндофитных – постоянная. Диаметр узла при его хирургическом удалении в среднем составляет 3 мм.
При микроскопическом исследовании выявляются клеточные скопления и отдельно лежащие эндокринные клетки веретенообразной, треугольной и цилиндрической формы. Число эндокринных клеток уменьшается по мере снижения уровня дифференцировки неоплазии. Обычно рак большого дуоденального сосочка прорастает общий желчный проток, возможно также поражение поджелудочной железы и стенки двенадцатиперстной кишки, лимфогенное и отдаленное метастазирование. Лимфогенные метастазы обнаруживаются у 21-51% больных. Отдаленные вторичные очаги выявляются достаточно редко. Обычно поражается печень, реже – кости, головной мозг, легкие и надпочечники.
Рак большого дуоденального сосочка может полностью обтурировать просвет желчного протока, реже выявляется стеноз. Даже при частичном сдавлении из-за отечности слизистой возникают грубые расстройства оттока желчи, становящиеся причиной развития механической желтухи. Появляется билиарная гипертензия, сопровождающаяся дилатацией желчевыводящих путей и протоков поджелудочной железы. Кишечная непроходимость развивается очень редко. При распространении процесса возможно прорастание стенки кишечника и распад неоплазии с развитием внутреннего кровотечения.
Симптомы рака фатерова сосочка
Первым проявлением болезни часто становится механическая желтуха, возникшая на фоне соматического благополучия. Вначале желтуха обычно перемежающаяся, нормализация биохимических показателей крови обусловлена уменьшением отека в области стенозированного желчного протока. При прогрессировании рака большого дуоденального сосочка желтуха становится более стойкой, изменение цвета кожи выявляется после интенсивных болей, сопровождающихся ознобами и проливными потами. Пациенты жалуются на выраженный зуд. Интермиттирующий характер желтухи на поздних стадиях (выявляется в 51% случаев) обусловлен распадом рака большого дуоденального сосочка, сопровождающегося временным восстановлением проходимости желчного протока.
При пальпации определяется гепатомегалия. У 60% пациентов под нижним краем печени прощупывается увеличенный желчный пузырь (симптом Курвуазье). При продолжительной обтурации желчевыводящих путей возникают цирроз печени и хронический панкреатит. При инвазии рака большого дуоденального сосочка в стенку кишечника и последующем распаде опухоли возможны кровотечения (острые массивные либо повторяющиеся незначительные) с развитием анемии. При региональном метастазировании отмечается изменение болевого синдрома.
Характерной особенностью рака большого дуоденального сосочка является ранняя потеря веса. Причиной похудания становятся стеноз либо обструкция панкреатических протоков, из-за которых в ЖКТ перестают поступать ферменты, необходимые для расщепления белков и жиров. Нарушение проходимости общего желчного протока еще больше усугубляет расстройства всасывания жиров и ухудшает всасываемость витаминов. Снижение веса и авитаминоз становятся причиной адинамии.
У больных раком большого дуоденального сосочка часто наблюдаются поносы, сопровождающиеся вздутием и болями в животе. Каловые массы зловонные, глинисто-серые. В запущенных случаях может выявляться жировой кал. При появлении регионарных метастазов отмечается изменение характера болевого синдрома. На поздних стадиях определяются истощение и расстройства функций органов, пораженных отдаленными метастазами.
Диагностика рака фатерова сосочка
Постановка диагноза сопряжена с существенными затруднениями из-за неспецифичности симптоматики. В процессе диагностики онколог ориентируется на жалобы, данные объективного осмотра, рентгенографии, чреспеченочной или внутривенной холангиографии, дуоденального зондирования, фиброгастродуоденоскопии и других исследований. При желтухе определяется высокий уровень билирубина с преобладанием прямой фракции, стеркобилин в кале отсутствует. На поздних стадиях рака большого дуоденального сосочка выявляется анемия.
Достаточно достоверным исследованием является дуоденальное зондирование, при проведении которого часто удается обнаружить кровь в дуоденальном содержимом. Иногда в ходе этого исследования выявляются клетки неоплазии и ферменты поджелудочной железы. Рентгенографическими признаками рака большого дуоденального сосочка являются неровность контуров либо дефект наполнения в зоне внутренней стенки двенадцатиперстной кишки, а также отсутствие проходимости либо деформация желчного протока в зоне, приближенной к фатеровому соску.
При проведении фиброгастродуоденоскопии обнаруживают опухолевидное образование и выполняют эндоскопическую биопсию подозрительного участка. В некоторых случаях диагноз рака большого дуоденального сосочка не удается установить при помощи стандартных методик, для уточнения характера патологии приходится проводить лапаротомию, рассекать фатеров сосок, осуществлять забор ткани, а затем принимать решение об объеме операции на основании данных срочного гистологического исследования. Дифференциальный диагноз осуществляют с гепатитом, раком головки поджелудочной железы и раком желчных путей.
Лечение рака фатерова сосочка
Основным способом лечения данной патологии является оперативное вмешательство, которое, в зависимости от распространенности процесса, может быть радикальным либо паллиативным. Группа паллиативных операций включает в себя около десяти различных вариантов анастомозов, позволяющих восстановить отток желчи в пищеварительный тракт либо (реже) предотвратить сдавление двенадцатиперстной кишки растущим раком большого дуоденального сосочка.
Радикальная операция является тяжелым и сложным вмешательством, поэтому проводится только после тщательного отбора пациентов в соответствии со стандартами, включающими в себя допустимую степень истощения, уровень белков в крови, определенные показатели пульса и жизненной емкости легких и т. д. Больным раком большого дуоденального сосочка проводят гастропанкреатодуоденальную резекцию. При наличии противопоказаний к радикальному вмешательству выполняют условно радикальные операции: папиллэктомию, дуоденэктомию либо экономную панкреатодуоденальную резекцию. Радиотерапия и химиопрепараты при раке большого дуоденального сосочка малоэффективны.
Эндоскопическая диагностика и лечение опухолей большого дуоденального сосочка
А. С. Балалыкин, Оноприев А. В., Муцуров Х. С., Катрич А. Н., Вербовский А. Н.
Москва, Краснодар
Актуальность
В настоящее время число воспалительных и опухолевых заболеваний поджелудочной железы, желчного протока и большого дуоденального сосочка (БДС), вызывающих непроходимость внепеченочных желчных протоков, продолжает увеличиваться и удельный вес рака БДС среди опухолей билиопанкреатодуоденальной зоны составляет 10,1–18,3 % (Русаков В. И. с соавт., 1986; Frosali D. et al., 1990).
Чрезвычайная злокачественность рака панкреато-биллиарной области и его поздняя диагностика приводят к тому, что хирургическое лечение больных сопровождается высоким операционным риском и невозможностью выполнения радикальных операций. Их частота составляет только 4–27 %, послеоперационная летальность достигает 8–22 %, а пятилетняя выживаемость — всего 4–6 % [М. В. Данилов соавт., 1995; А. А. Мовчун с соавт., 1994; В. А. Кубышкин с соавт., 2003].
Благодаря ранним клиническим проявлениям (механическая желтуха) опухоли БДС диагностируются на более ранней стадии, чем опухоли другой локализации. Существующие инструментальные методы исследования (эндоскопические, лучевые, лапароскопические) далеко не всегда позволяют сформулировать наиболее рациональную тактику и вид лечения, и главное, имеют существенные ограничения в оценке стадии болезни.
К 80-м годам прошлого столетия был разработан принципиально новый диагностический прибор — эхо-эндоскоп, соединивший в себе возможности гибковолоконной эндоскопии и ультразвукового исследования.
Отличительной особенностью и неоспоримым преимуществом метода перед другими является то, что ультразвуковой датчик под контролем зрения размещается в непосредственной близости от зоны исследования, что позволяет повысить разрешающую способность ультразвукового сканирования. Учитывая короткую дистанцию исследования, и доказанную корреляцию между получаемым ультразвуковым изображением и анатомическим строением стенки полых органов желудочно-кишечного тракта (ЖКТ), эндо-УЗИ позволяет произвести послойную структурную оценку БДС, окружающих его органов и тканей, сосудистых и протоковых образований в зоне исследования. Полученные данные позволяют установить диагноз и обосновать план лечения.
Материалы и методы исследования. Нами проанализированы результаты лечения 39 пациентов с подозрением на злокачественные новообразования диагностированные при обследовании 421 больных в 2004–2009 гг. в возрасте 35–77 лет.
Нами применен следующий инструментальный диагностический алгоритм: ТАУЗИ, фиброгастродуоденоскопия (ФГДС), эндо-УЗИ, эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ), фистулография, компьютерная томография (КТ) — по показаниям.
Несомненным преимуществом ТАУЗИ перед другими методами исследования является отсутствие противопоказаний и возможность использовать его в качестве экспресс-диагностического метода.
Перед ФГДС ставились следующие задачи: оценить проходимость верхнего отдела ЖКТ, выявить специфические изменения слизистой желудка и ДПК, характерные для сопутствующих заболеваний желудка и ДПК, определить доступность и состояние БДС и периампулярной области, оценить технические возможности проведения лечебных эндоскопических мероприятий на БДС.
Эндоскопическое ультразвуковое исследование.
Мы использовали видеоэндоскопический комплекс, EVIS EUS EXERA, «Olympus», Япония, включающий: видеоэндоскопический центр CV-160, осветитель CLV-160, ультразвуковой эндоскопический центр UM-60, радиальный ультразвуковой гастровидеоскоп GF-UM 160.
Подготовка больных к эндо-УЗИ панкреатобилиарной системы не отличается от таковой при обычной эндоскопии.
Проведению эндо-УЗИ обязательно должно предшествовать эндоскопическое или рентгенологическое исследование пищевода или желудка (для исключения стенозов, дивертикулов), поскольку введение эхоэндоскопа производится практически без визуального контроля.
Стандартные позиции проведения эндоскопического ультразвукового исследования различных органов были предложены M. Sivak (1982 г), и W. Strohm и M. Classen (1982) и утверждены Международной конференцией по эндоскопической эхографии (Стокгольм). В последствии методика была дополнена K. Inui et al. (2004).
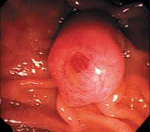
Большой дуоденальный сосочек — осмотренный в поперечном сечении, представляется как дополнительное округлое (овальное) многослойное образование стенки нисходящего отдела ДПК. При идентификации структур БДС определяются поочередно мышечный слой ДПК (слой сниженной эхогенности), подслизистый слой ДПК (слой повышенной эхогенности), мышечный аппарат сфинктера (тонкий гипоэхогенный слой) и внутренний гиперэхогенный слой, соответствующий слизистому и подслизистому слою ампулы сосочка.
Для исследования БДС в продольном направлении необходимо смещение УЗ-датчика в проксимальном направлении, путем подтягивая эндоскопа. Основными ориентирами являются протоковые структуры; в этом случае ультразвуковая картина меняется индивидуально: соответственно анатомическим взаимоотношениям терминальных отделов желчного и панкреатического протоков, относительно друг друга и стенки ДПК.
Увеличение БДС в размерах более 1 см, выявление в просвете сосочка дополнительных образований, исходящих из его стенок, изменение эхографических характеристик многослойной структуры данного анатомического образования интерпретируется как патологическое изменение БДС.
Ультразвуковая семиотика заболеваний БДС. Эндоскопическими ультразвуковыми диагностическими критериями опухоли БДС являются: нарушение нормальной многослойной эхоструктуры БДС, солидное образование в проекции БДС, сниженная или смешанная эхо-генность образования, нечеткие контуры образования.
Опухоль может иметь экзофитную (в просвет ДПК) и эндофитную или инвертированную (в просвет дистальных отделов протоков) формы роста. На начальных стадиях роста и небольших размерах образования и при отсутствии инфильтративного роста надежных дифференциально-диагностических критериев карциномы и аденомы, не существует.
Эндоскопическими ультразвуковыми диагностическими критериями карциномы сосочка являются: распространение гипоэхогенных тканевых масс на мышечный слой стенки ДПК, в просвет холедоха и ГПП или на стенки протоков, в паренхиму поджелудочной железы, и/или обнаружение рядом с БДС лимфатических узлов подозрительных на их метастатическое поражение (Панцырев Ю. М. и соавт. 2002). Это- важные дифференциально-диагностические признаки, т. к. обнаружение хотя бы одного из них определяет тактику лечения и ставит под сомнение радикальность эндоскопической резекции опухоли. Недооценка указанных фактов приводит к неудовлетворительным результатам эндоскопических методов лечения.
Наиболее важными лимфатическими коллекторами, требующими детальной оценки для точного определения лимфогенного метастазирования опухоли БДС в процессе выполнения эндосонографии, являются лимфоузлы печеночно-двенадцатиперстной связки, задние поджелудочно-двенадцатиперстные лимфоузлы и верхнебрыжеечные лимфоузлы.
Так как опухоли БДС, которые инфильтрировали поджелудочную железу или периампулярную область, невозможно отличить от первичных панкреатических карцином, большинство авторов описывают их как «опухоли БДС» или «периампулярные раки». Так как оба типа в одинаковой степени склонны к метастазированию, нет необходимости в их дооперационной дифференцировке их локализации. Дооперационное определение стадии ампулярной карциномы базируется на основании Международной классификации по факторам TNM принятой европейской организацией «Union International Control Cancer».
Результаты
После комплексного применения диагностических методик у 36 из 421 обследованных пациента был установлен предварительный диагноз опухоли БДС, причем у 34 пациентов была заподозрена злокачественная природа процесса в стадии Т1 — у 7 (20,6 %), Т2 — у 16 (47 %), в стадии Т3 — у 11 (32,4 %) пациентов.
Нами была проанализирована диагностическая ценность инструментальных методов в диагностике опухолей БДС и установлено, что эндо-УЗИ имеет более высокую чувствительность, специфичность и диагностическую эффективность.
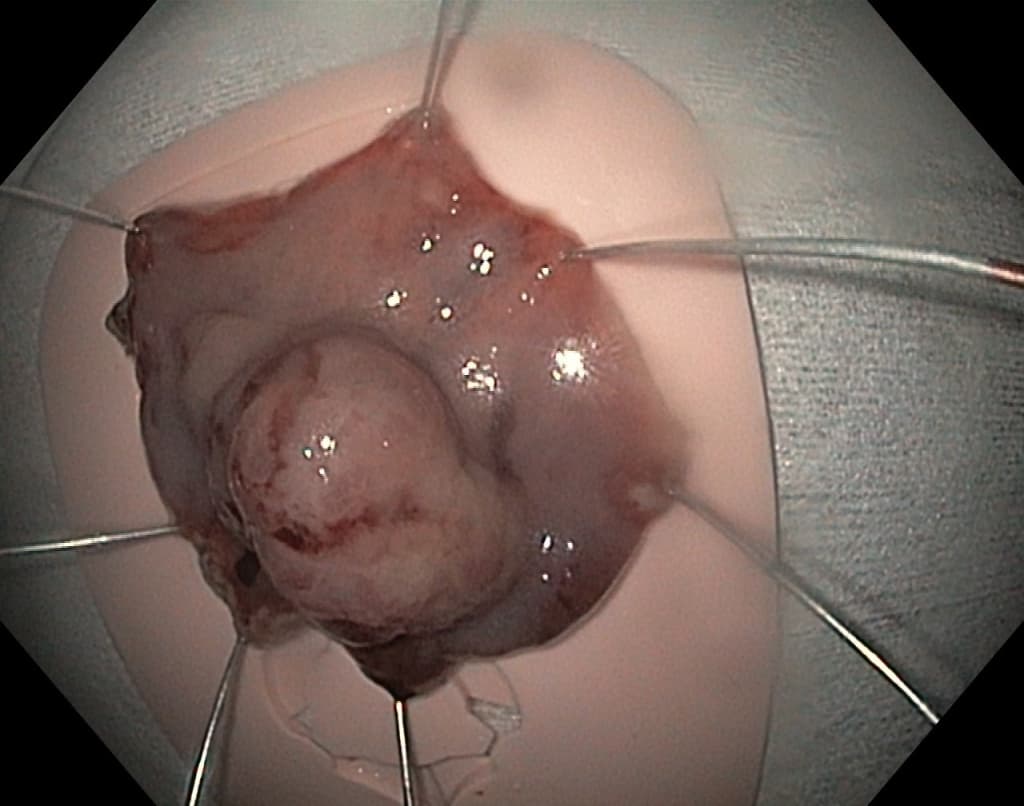
Показания к эндоскопическим методам лечения были выставлены у 7 пациентов. После применения комплекса диагностических методик, по макроскопической картине выявленные неоплазии были разделены на экзофитную и эндофитную (инвертированную) форму опухоли БДС. Размеры выявленных образований колебались в пределах от 8 до 32 мм. Морфологическая характеристика опухолей распределилась следующим образом: высокодифференцированная аденокарцинома, аденома с дисплазией III ст., аденома с дисплазией II ст.
Возможность выполнения эндоскопической эксцизии опухолей БДС (Балалыкин А. С. и соавт. 2008, Катрич А. Н. и соавт., 2008) обосновывалась данными эндо-УЗИ (тип роста образования, наличие измененных лимфатических узлов, состояние мышечного слоя стенки ДПК, терминальных отделов желчного и панкреатического протока). Всем пациентам был применен последовательный комплекс эндохирургических вмешательств, включавший атипичную «послойную» ЭПТ с помощью торцевого папиллотома, дополненная канюляционной ЭПТ у 6 больных, петельную электроэксцизию опухоли, электро — или аргоноплазменную деструкцию, а также вмешательства, направленные на обеспечение адекватного пассажа желчи и панкреатического сока (стент, НБД). Всем пациентам в послеоперационном периоде выполнялось желудочное и дуоденальное зондирование, проводился курс консервативной терапии. Контрольные обследования выполнялись в сроках от 3 до 6 месяцев.
Успех и безопасность эндоскопического вмешательства определяется правильным набрасыванием петли и рациональным сочетанием режимов резания и коагуляции, поэтому в зависимости от формы роста опухоли менялись технические аспекты выполнения данного этапа операции. В случае эндофитной формы роста опухоли после выполнения атипичной «послойной» ЭПТ, с помощью торцевого папиллотома выполнялись «полулунные» окаймляющие разрезы слизистой оболочки в пределах здоровых тканей, в 3 случаях дополненные введением с помощью инъектора, раствора в подслизистый слой, для создания «подушки» под тканью опухоли. С нашей точки зрения эти приемы обеспечивают:
1) адекватное набрасывание эндоскопической петли на опухоль;
2) снижают риск «сползания» петли;
3)резекцию «in block». С целью профилактики кровотечения и повышения абластичности операции выполнялась электро или аргоноплазменная деструкция зоны новообразования БДС. Обеспечение свободного пассажа желчи и панкреатического сока достигалось за счет выполнения билиопанкреатического стентирования.
Осложнениями оперативных вмешательств являлись: интраоперационное кровотечение, остановленное эндоскопически, микроперфорация ДПК, которая была излечена консервативно.
В одном случае, через 3 месяца после выполнения операции, при контрольном эндо-УЗИ, был выявлен продолжающийся рост опухоли. Пациенту была выполнена панкреатодуоденальная резекция.
Выводы
1. Методика эндоскопического ультразвукового исследования является наиболее эффективным методом диагностики заболеваний БДС, стадии злокачественного процесса и позволяет планировать объем и вид лечения больных. 2. Успех, радикальность и безопасность эндоскопической папиллэктомии определяется комплексностью эндоскопических методик и четким соблюдением этапности их выполнения. Включение в лечебный алгоритм стентирования протоков обеспечивает свободный пассаж желчи и панкреатического сока, и позволяет избежать послеоперационных осложнений.