Бактисубтил или бактистатин что эффективнее
Современные подходы к рациональной терапии бактериальных диарей
Статья посвящена современным особенностям течения бактериальных кишечных инфекций у госпитализированных детей в возрасте 6–18 лет, проанализирована эффективность Бактистатина в терапии инвазивных кишечных инфекций.
The article is devoted to modern characteristics of the clinical course of intestinal bacterial infections in inpatient children at the age of 6–18 years, the efficiency of bactistatin in the therapy of invasive intestinal infections was analysed.
Актуальность проблемы острых кишечных инфекций (ОКИ) обусловлена высокой заболеваемостью детского населения, значительными экономическими потерями; отсутствием согласованных подходов к терапии; риском формирования хронических гастроэнтерологических заболеваний [1, 2].
В клинике кишечных инфекций ФГБУ НИИ ДИ ФМБА России, г. Санкт-Петербург было проведено открытое сравнительное контролируемое одноцентровое исследование эффективности и безопасности Бактистатина (биологически активная добавка), назначаемого с целью этиопатогенетического лечения бактериальных ОКИ у детей в возрасте от 6 до 18 лет. Бактистатин содержит стерилизованную культуральную жидкость Bacillus subtilis — в количестве 200 мг, цеолит — 195 мг, гидролизат соевой муки — 100 мг, стеарат кальция/аэросил — 5 мг [3–5]. Эффективность использования данного средства была оценена в сравнении с эффективностью препарата Хилак форте.
Целью настоящего исследования было изучить эффективность Бактистатина в лечении детей, больных ОКИ бактериальной этиологии, и его влияние на микробиоценоз кишечника.
Материалы и методы исследования
В открытое сравнительное контролируемое исследование были включены 50 пациентов в возрасте от 6 до 18 лет со среднетяжелой формой ОКИ бактериальной этиологии. Дети были госпитализированы с 1-го по 4-й день болезни, большинство — в первые двое суток — 70% случаев (35 пациентов). Причинами необходимости в стационарном лечении для поступивших на 1–2 сутки служили фебрильная температура — 78% случаев (39 пациентов), многократная рвота — 32% случаев (16 пациентов) и появление крови в стуле — 18% случаев (9 пациентов). Госпитализированные на более поздних сроках дети имели основную жалобу на продолжительную диарею, сохранение лихорадки — 76% случаев (38 пациентов) и гемоколита — 10% случаев (5 пациентов). Средний возраст пациентов, включенных в исследование, составил 9,6 ± 0,7 года. Различий по полу выявлено не было: мальчики и девочки составили 52% (26 пациентов) и 48% (24 пациента) соответственно.
Первая группа (n = 25) получала Бактистатин по 1 капсуле 2 раза в день в течение 7-ми дней в острый период заболевания на фоне базисной терапии.
Пациенты группы сравнения (n = 25) получали на фоне базисной терапии препарат Хилак форте в возрастной дозе в течение 7 дней. Базисная терапия включала оральную регидратацию или инфузионную терапию, диетотерапию, по показаниям назначались антимикробные препараты [6, 7]. Энтеросорбенты не назначались.
Частота встречаемости клинических симптомов ОКИ (общеинфекционных и поражения желудочно-кишечного тракта) была одинаковой в группах больных, получавших Бактистатин, и в группе сравнения. Сравниваемые группы были репрезентативными по полу, возрасту, срокам поступления и проводимой базисной терапии, исходные показатели периферической крови также существенно не отличались.
Оценка клинического течения инвазивных диарей проводилась в соответствии с принципом определения типа, тяжести, течения инфекционного процесса (Н. В. Воротынцева, 2001; А. В. Горелов, Д. В. Усенко, Л. Н. Милютина, 2005) [6]. Основными критериями клинического выздоровления служили нормализация характера стула и отсутствие субъективных жалоб, лабораторными критериями выздоровления являлись нормализация клинико-биохимических показателей и прекращение бактериовыделения при однократном контрольном исследовании кала [6–8].
Всем пациентам проводилось стандартное лабораторное обследование, включавшее клинический анализ крови, клинический анализ мочи, биохимическое исследование крови, копроцитограмму. По показаниям выполнялось ультрасонографическое исследование органов брюшной полости и мочевыделительной системы.
Этиологическая расшифровка диареи включала, кроме микробиологического метода (бактериологический посев фекалий на плотные питательные среды для выделения чистой культуры возбудителя), полимеразную цепную реакцию (ПЦР) фекалий для выявления РНК/ДНК возбудителей. Тестирование собранных образцов фекалий выполняли с использованием реагентов АмплиСенс® Rotavirus/ Norovirus/Astrovirus-FL или АмплиСенс® ОКИ скрин-FL, методом ПЦР с гибридизационно-флуоресцентной детекцией производства «Интерлабсервис» (Москва).
Сывороточные противошигеллезные и противосальмонеллезные антитела определяли унифицированным методом в реакции непрямой гемагглютинации (РНГА) с помощью эритроцитарного шигеллезного диагностикума производства «Биопрепарат» (НИИ вакцин и сывороток, Санкт-Петербург).
Оценка качественного и количественного состава аэробной и анаэробной микрофлоры толстого кишечника проводилась по методу В. Н. Красноголовец (1989).
Статистическая обработка полученных данных проводилась с использованием пакета программ Excel и Statistica 5. Для оценки достоверности различий количественных признаков использовался параметрический t-тест Стьюдента. Различия считали достоверными при p ≤ 0,05.
Результаты и обсуждение
Этиология диареи была установлена у 72% обследованных (36 пациентов) (табл. 1), среди расшифрованных диарей преобладали сальмонеллез (32% случаев) и кампилобактериоз (18% случаев), сравниваемые группы были сопоставимы по этиологической структуре больных.
У всех пациентов, независимо от этиологии, заболевание протекало по типу инвазивной диареи, что позволило анализировать нам клиническую картину заболевания, не разделяя больных в зависимости от выделенного этиологического агента.
Острое начало заболевания с появлением лихорадки и диареи в первые сутки заболевания отмечалось у большинства больных (96% случаев). У остальных детей регистрировалось постепенное начало болезни, при этом у 2% больных к кишечной дисфункции на 2–3 день присоединялось повышение температуры, а у 2% детей сначала отмечалась лихорадка, а к третьему дню развертывалась типичная картина инвазивной ОКИ.
Температурная реакция отмечена у 100% больных детей с инвазивными диареями, ее длительность достигала 3,61 ± 0,65 дня. Максимальное повышение температуры составило 39,2 ± 0,19 °C, причем гипертермия свыше 40 °C отмечалась у 24% больных. Длительность лихорадки свыше 38,5 °C в среднем отмечалась в течение 1,41 ± 0,14 дня. У всех больных ведущим был интоксикационный синдром, сохранявшийся на фоне терапии в течение 2,18 ± 0,31 дня, который характеризовался вялостью, слабостью, адинамией (1,88 ± 0,21 дня), отказом от еды (2,53 ± 0,54 дня). Повторные рвоты были отмечены у 34%, однако их длительность не превышала двух суток (1,65 ± 0,31 дня), по мере снижения интоксикации рвоты купировались.
Кроме интоксикационного синдрома тяжесть инвазивной диареи определялась глубиной поражения желудочно-кишечного тракта: колитный синдром имел место у 100% детей (50 пациентов), при этом гастроэнтероколит выявлялся в 38% случаев (19 пациентов), энтероколит — в 62% случаев, у 18% (9 пациентов) развивался гемоколит. Изменение характера стула обнаруживалось уже в 1-е сутки болезни у 96% больных (48 человек), максимальная кратность стула достигала 9,56 ± 1,07 раза. Частота дефекации 10 и более раз в сутки отмечена у 56% детей (28 пациентов), дефекация менее 5 раз в сутки отмечалась у 12% пациентов (6 человек). Гемоколит сохранялся на протяжении 1,67 ± 0,37 дня лечения, полная нормализация характера стула происходила к 6,18 ± 1,01 дня.
Болевой абдоминальный синдром присутствовал у 80% больных (40 человек), причем боли были умеренной интенсивности и носили разлитой характер. У 44% (22 пациента) детей боли локализовались в левой подвздошной области. Вздутие, урчание и болезненность при пальпации живота отмечались у 76% (38 пациентов) детей. Для обследованных детей было характерно развитие синдрома дистального колита в 32% случаев (16 пациентов) длительностью 2,48 ± 0,22 дня. Сигмовидная кишка пальпировалась в виде плотноэластичного тяжа, но в 18% случаях (9 пациентов) она была резко спазмированной, тенезмы отмечались у 6% детей (3 пациента).
Картина периферического анализа крови характеризовалась умеренным лейкоцитозом, нейтрофилезом с палочкоядерным сдвигом и увеличенной скорости оседания эритроцитов (СОЭ). Копроцитологические изменения в острую фазу инвазивных диарей характеризовались проявлениями ферментативной недостаточности в 84% случаев (42 пациента), появлением слизи (100% случаев), значительного количества лейкоцитов (84%), эритроцитов (24%). У 12% детей (6 пациентов) при микроскопическом исследовании лейкоциты и эритроциты покрывали все поля зрения.
При инвазивных диареях в острый период заболевания (1–5 дни болезни) у 94,59% детей были выявлены дисбиотические изменения в микробиоте толстой кишки. Дисбактериоз I степени отмечался у 29,73% обследованных, II степени — у 51,35%, III степени — у 18,92% больных.
Антимикробная терапия назначалась в соответствии с принципами этиотропной терапии инвазивных ОКИ у детей. Стартовыми антимикробными препаратами являлись цефотаксим, нифуроксазид, препаратами резерва — цефтриаксон, амикацин, рифаксимин. По срокам назначения антимикробной терапии дети были разделены на две группы: получавшие терапию с 1–2 дня пребывания в стационаре и получавшие этиотропную терапию с 3–5 дня госпитализации (табл. 3).
Эффективность при бактериальных ОКИ у детей
Частота встречаемости клинических симптомов ОКИ (общеинфекционных и поражения желудочно-кишечного тракта) была одинаковой в группах больных, получавших Бактистатин, и в группе сравнения.
Изучение клинического течения инвазивных диарей у обследованных детей показало, что включение в комплексную терапию Бактистатина способствовало сокращению продолжительности основных проявлений заболевания (табл. 4). Так, в группе пациентов, получавших Бактистатин, отмечалось достоверное уменьшение длительности лихорадочного периода, раньше купировались боли в животе и диарейный синдром, по сравнению с детьми группы сравнения.
Наиболее значимым эффектом применения Бактистатина при инвазивных ОКИ было сокращение частоты назначения антимикробной терапии в группе пациентов, лечившихся Бактистатином, до 48% против 76% в группе сравнения (р 0,05). В группе детей, получавших Бактистатин, негладкого течения заболевания не наблюдалось, в то время как в группе сравнения негладкое течение (обострение) отмечено у 16% детей (р
ФГБУ НИИ ДИ ФМБА, Санкт-Петербург
Бактисубтил или бактистатин что эффективнее
Воспалительные заболевания кишечника (ВЗК) – группа хронических заболеваний желудочно-кишечного тракта, включающая болезнь Крона (БК) и язвенный колит (ЯК). Этиология обеих разновидностей ВЗК неизвестна, хотя были определены несколько факторов в качестве значимых в их развитии. Среди них важное место занимает микрофлора кишечника, роль которой в последние годы пересмотрена. Деликатные симбиотические отношения между микрофлорой кишечника и «хозяином» при ВЗК меняются [5].
В последние годы проведено большое количество исследований для оценки роли пре- и пробиотиков в модуляции кишечной микрофлоры при разных состояниях (более частое определение — «микробиота»), которая включает в себя бактерии, грибки, бактериофаги и вирусы и действует как «орган» синергически с «хозяином», создавая самостоятельную сложную экосистему [3].
Большинство обычных методов лечения ВЗК направлено на модулирование иммунной системы. Для терапии этих заболеваний используются соединения 5-аминосалициловой кислоты, кортикостероиды, азатиоприн/6-меркаптопурин, метотрексат, циклоспорин, антитела к фактору некроза опухоли и другая биологическая терапия [6].
Полагая, что микрофлора играет определенную роль в патогенезе ВЗК, ряд воздействий может быть направлен на модуляцию микробиоты кишечника. Этот эффект достигают несколькими путями: антибиотикотерапией, назначением про- и пребиотиков, изменением характера диеты и др. [2, 4]. Полагают, что пробиотики, содержащие жизнеспособные организмы, могут оказать положительное воздействие на кишечную микробиоту и течение заболевания. Результаты последних исследований показали, что актуальным является использование не просто пробиотиков на основе живых микроорганизмов, а метабиотиков — препаратов на основе продуктов метаболизма или структурных компонентов пробиотических микроорганизмов [1].
Одним из ярких примеров метабиотиков является Бактистатин – комбинированный препарат на основе метаболитов Bacillus subtilis., цеолита и гидролизата соевой муки. Bacillus subtilis — грамположительная, спорообразующая аэробная почвенная бактерия. Первоначально была описана в 1835 г. как Vibrio subtilis, в 1872 г. была переименована в Bacillus subtilis. Название «сенная палочка» вид получил из-за того, что накопительные культуры этого микроорганизма получают из сенного экстракта. Является продуцентом некоторых полипептидных антибиотиков, а также ферментов (амилазы, протеазы). Пробиотический компонент — стерилизованная высушенная культуральная жидкость природной бактерии Bacillussubtilis – содержит комплекс биологически активных метаболитов (лизоцим, бактериоцины, каталазы и др.). Пробиотический компонент в составе Бактистатина обеспечивает восстановление нормальной микрофлоры кишечника, угнетает патогенные и условно-патогенные микроорганизмы, не влияя при этом на полезную микрофлору кишечника, обладает иммуномодулирующим действием за счет стимуляции синтеза интерферона и активации защитных клеток – макрофагов, способствует полноценному пищеварению. Природный сорбент цеолит сорбирует и выводит шлаки, токсины и аллергены, не вступая при этом во взаимодействие с витаминами, аминокислотами, белками и другими полезными веществами, оставляя их в желудочно-кишечном тракте, уменьшает различные виды интоксикации, в том числе при печеночной и почечной недостаточности, бактериальных пищевых отравлениях, способствует нормализации всех видов обмена веществ: жирового, белкового и углеводного, является источником широкого спектра необходимых микроэлементов, улучшает процессы пищеварения, нормализует перистальтику кишечника, уменьшает вздутие и спазмы, повышает иммунитет, улучшает функцию печеночных клеток, стимулирует регенеративные процессы. Цеолит обеспечивает дозированное высвобождение, адресную доставку на всем протяжении кишечника и пролонгированное действие компонентов Бактистатина благодаря постепенному высвобождению фиксированных на цеолите активных компонентов комплекса. Пребиотический компонент — гидролизат соевой муки, который обеспечивает максимально благоприятные условия для роста нормальной микрофлоры кишечника и восстановления микробного пейзажа организма и является естественным источником полноценного белка и аминокислот.
Нами изучена его эффективность в комплексной терапии 30 больных ЯК различной тяжести с синдромом кишечного дисбактериоза. Группу сравнения составили 10 больных с билиарнозависимым хроническим панкреатитом. Средний возраст пациентов с ЯК составил 37,4±5 лет, из них мужчин 18, женщин 12. Возраст пациентов в группе сравнения составил 40,3±4 года (соотношение мужчин и женщин 2:1).
Критерии оценки эффективности БАДА «Бактистатин»:
Оценка переносимости и безопасности БАДА «Бактистатин» проводилась на основании регистрации побочных эффектов, отмеченных в регистрационных картах и дневниках наблюдений, а также по результатам общего и биохимического исследования крови.
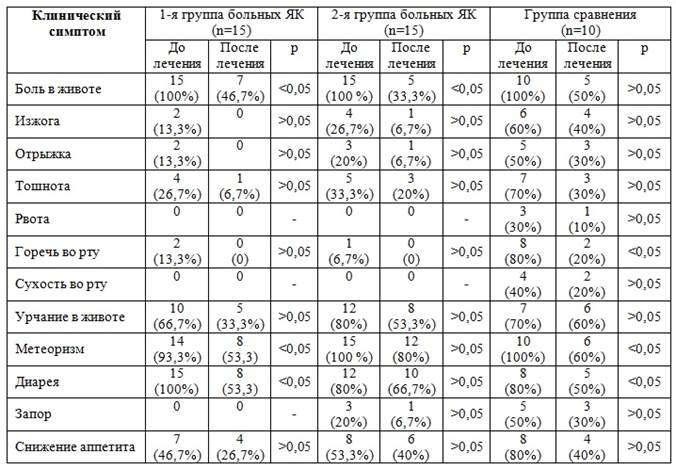
Больные с ЯК были выделены в 2 группы. 1-я группа (15 пациентов) получали базисную терапию (салофальк, преднизолон, азатиоприн) в сочетании с Бактистатином по 1 капсуле 2 раза в сутки – 3 недели. 2-я группа больных ЯК получала только базисную терапию. В группе сравнения больные получали заместительную ферментную терапию (мезим-форте, креон, микразим, спазмолитики, антисекреторные препараты в рекомендованных дозах + Бактистатин по 1 капсуле 2 раза в сутки) — 3-я группа пациентов. Лабораторно-инструментальные исследования проводили до и после применения Бактистатина, в среднем через 3 недели.
С целью изучения влияния Бактистатина на микрофлору кишечника у исследуемых пациентов мы распределили больных по степени выраженности дисбиоза, используя классификацию дисбактериоза по В.Н. Красноголовец (табл. 2). Согласно нашим данным у всех исследуемых пациентов был выявлен дисбиоз преимущественно 1-й, 2-й и 3-й степени. В 1-й и 3-й группах пациентов на фоне приема Бактистатина отмечено значительное снижение степени выраженности дисбактериоза или его полное исчезновение (при 1-й степени в сравнении со 2-й группой).
Динамика клинических симптомов у больных до и после комплексной 3-недельной терапии Бактистатином
ПРИМЕЧАНИЕ. Здесь и далее: в числителе указаны абсолютное значение и процент встречаемости симптома до проведения терапии Бактистатином, в знаменателе — после проведения терапии Бактистатином
Распределение исследуемых больных по степени выраженности дисбактериоза
Как выбрать пробиотики для кишечника: список препаратов
Правильное, сбалансированное содержание белков, жиров и углеводов является ключом к здоровью на долгие годы. Продукты не способны в полной мере обеспечить организм человека всем необходимым. Есть целый перечень лекарств, которые помогают держать себя в хорошей форме и не болеть от легкого дуновения ветра.
Предлагаем список лучших пробиотиков. Перед началом терапии рекомендуется проконсультироваться с врачом, чтобы исключить наличие противопоказаний и правильно рассчитать дозировку.
Полезные свойства
Пробиотики – живые микроорганизмы, которые могут принести пользу человеку. В большинстве случаев это бактерии, но могут быть и другие представители микробов (например, дрожжи). Пробиотики несут пользу для кишечника, нормализуя микрофлору и устраняя дисбактериоз.
Нормы и различные вариации
Пробиотики колонизируют кишечник полезными бактериями, противодействуют патогенной (вредной) флоре, вызывающей запор или диарею, повышают иммунитет.
Основную массу бактерий – пробиотиков можно разделить на 2 вида: лакто- и бифидобактерии. В каждом из них существует значительное количество подвидов. Они оказывают то или иное благотворное влияние на организм человека.
Отклонения от нормы
Чем отличаются пробиотики от пребиотиков?
Могут ли навредить пробиотики?
Пробиотики практически не имеют противопоказания. Не рекомендуется принимать при онкологических заболеваниях, поражении лимфатический и кровеносной системы, ВИЧ. С осторожностью рекомендуется принимать в период беременности и лактации. Маленьким детям допустимо давать только те препараты, которые не имеют возрастных ограничений.
Как выбрать пробиотики для кишечника?
Лучшие пробиотики для восстановления кишечника может посоветовать только врач. Должны быть учтены основные критерии: возраст пациента, состояние организма, характер дисфункций, противопоказания и пр. Самолечение может не дать должного результата и привести к развитию проблем со здоровьем.
В список препаратов включены лучшие пробиотики для восстановления микрофлоры кишечника. Рейтинг основан на эффективности, безопасности и соотношении цена-качество.
№1 – «Нормофлорин-Д» (Бифилюкс, Россия)
Биологически активная добавка разработана на основе лактобактерий и их метаболитов. Используется в комплексном лечении язвы двенадцатиперстной кишки и желудка, при ожирении и метаболическом синдроме. Назначается после антибактериальной терапии для восстановления нарушенного микробиоценоза.
Производитель: Бифилюкс, Россия
№2 – «Бифиформ» (Ferrosan, Дания)
Противодиарейный препарат регулирует равновесие микрофлоры кишечника. Содержит Bifidobacterium longum и Enterococcus faecium. МИБП-эубиотик назначается при непереносимости лактозы, для восстановления микрофлоры кишечника и для лечения хеликобактерной инфекции в составе комплексной терапии.
Производитель: Ferrosan [Ферросан], Дания
№3 – «Линекс» (Lek d. d., Словения)
Находится в первых рядах списка пробиотиков для кишечника. Основные активные компоненты этого препарата стимулируют изменение рН путем брожения лактозы. Это тормозит развитие патогенных и условно-патогенных микроорганизмов и создает благоприятные условия для пищеварительных ферментов.
Активные вещества, входящие в «Линекс» устойчивы к антибиотикам. Они оказывают влияние не только на нижние отделы кишечника, но и на верхние (этими свойствами обладают далеко не все пробиотики). Многокомпонентное средство, пригодно практически для всех пациентов, включая детей (даже тех, кто находится на искусственном питании).
Производитель: Lek d. d. [Лек д.д.], Словения
№4 – «Хилак Форте» (Merckle, Германия)
Комбинированный препарат для нормализации кислотности желудка в соответствии с физиологической нормой. Биологически восстанавливает микрофлору кишечника. Таким образом, создает неблагоприятную среду для жизнедеятельности патогенных и условно-патогенных бактерий.
Производитель: Merckle [Меркле], Германия
№5 – «Линекс Форте» (Sandoz, Словения)
Пробиотик регулирует равновесие микрофлоры кишечника. Разработан на основе молочнокислых живых бактерий, которые представляют собой составляющие естественной микрофлору. Широко используется при дисбактериоза, запорах и хеликобактериозе у детей и взрослых.
Производитель: Sandoz [Сандоз], Словения
№6 – «Бифидумбактерин» (Ланафарм, Россия)
Лучший пробиотик для восстановления микрофлоры, который устойчив ко многим лекарственным средствам и антибиотикам. «Бифидумбактерин» является антагонистом достаточно широкого спектра болезнетворных и условно болезнетворных микроорганизмов. Выпускается в форме ректальных суппозиториев и капсул.
Эффективность препарата обусловлена сильной концентрацией бифидобактерий. Быстро нормализует микрофлору кишечника, которая, будучи естественной, накапливает токсические вещества (как поступающие в организм извне, так и находящиеся в нем) и разлагает их на нетоксичные компоненты. Нельзя давать детям, страдающим непереносимостью молочных продуктов.
Производитель: Ланафарм, Россия
№7 – «Бак-Сет Форте» (Probiotics International, Великобритания)
Мульти-пробиотик нового поколения, который включает в состав 14 видов пробиотических живых бактерий. Они дополняют действие друг друга, устраняя проблемы с пищеварением у детей от 3-х летнего возраста и у взрослых. Усовершенствованная микрокапсулированная технология способствует сохранению полезных свойств бактерий на протяжении всего срока хранения препарата.
Производитель: Probiotics International [Пробиотикс Интернейшенал], Великобритания
№8 – «Бифиформ Баланс» (Pfizer, Россия)
Один из лучших пробиотиков для восстановления микрофлоры кишечника. разработан на основе лакто- и бифидобактерий. Биологически активная добавка к пище назначается для лечения дисбактериоза различной этиологии и поддерживает микрофлору кишечника. Способствует коррекции функциональных нарушений желудочно-кишечного тракта.
Производитель: Pfizer [Пфайзер], Россия
№9 – «Флорин Форте» (Партнер, Россия)
Лакто- и бифидобактерии, входящие в состав, принимают участие в процессах синтеза аскорбиновой кислоты, калия, витаминов группы В. В результате повышается устойчивость к агрессивным воздействиям окружающей среды. Также действующие компоненты участвуют в обменных процессах желчных кислот и пигментов. В их присутствии происходит синтез веществ, оказывающих антибактериальное действие. Также препарат повышает иммунную-реактивность человеческого организма.
Производитель: Партнер, Россия
№10 – «Бактериофаг» (Микроген НПО, Россия)
Стафилококковый раствор входит в список лучших пробиотиков для кишечника для взрослых и детей. Используется преимущественно в составе комплексной терапии с антибактериальными препаратами и другими лекарственными средствами.
Производитель: Микроген НПО, Россия
№11 – «Секстафаг» (Микроген НПО, Россия)
Завершает список препаратов пробиотиков для кишечника. Иммунобиологический препарат специфически лизирует бактерии стрептококков и стафилококков, протеи, кишечной и синегнойной палочки. Назначается при энтеральных и гнойно-воспалительных заболеваниях. При необходимости может быть использован в составе комплексной терапии.
Производитель: Микроген НПО, Россия
Пробиотические средства нормализуют процессы пищеварения, активируя перистальтику кишечника и восстанавливая микрофлору. Препараты способствуют синтезу полиаминов, укрепляют клеточный цитоскелет и регенерируют кишечный эпителий, повышая защитные функции организма. Они не только уменьшают газообразование, н и тормозят рост вредоносных микроорганизмов.
Какие пробиотики принимать в том или ином случае может посоветовать врач. Специалист отталкивается от показаний и общего состояния организма пациента, исключая развитие передозировки или побочных реакций.
.gif)