Бад дгэа для чего
Современный взгляд на проблему возрастного андрогенного дефицита у мужчин
Традиционно считается, что мужчины являются сильным полом
Традиционно считается, что мужчины являются сильным полом. Однако факты доказывают обратное: в современном мире мужчины уступают женщинам не только по качеству жизни, но и ее продолжительности (в России разница в продолжительности жизни мужчин и женщин драматична и составляет 13 лет!). У мужчин значительно выше распространенность онкологических и сердечно-сосудистых заболеваний. Потребление алкоголя и курение в России значительно выше, чем на Западе, что ведет к раннему возникновению эректильной дисфункции, негативно влияющей на качество жизни как пары в целом, так и женщины.
Таким образом, факты демонстрируют некоторую слабость мужчин. Можно ли как-то влиять на их слабые стороны? Можно ли изменить качество жизни мужчины и увеличить ее продолжительность? За последние 10 лет произошла настоящая «тестостероновая революция», мы уже не задаем вопрос, является ли возрастной андрогенный дефицит мифом или реальностью, поскольку наличие возрастного андрогенного дефицита является научно доказанным фактом. Более того, сегодня мы знаем, что содержание тестостерона определяет функционирование практически всех органов мужского организма. Тестостерон является своего рода протективным гормоном в отношении развития целого ряда возраст-ассоциированных заболеваний. Продолжительность жизни у мужчин с низким уровнем тестостерона ниже, по сравнению с мужчинами с нормальным уровнем тестостерона. Еще в 1983 году Дильман В. М. писал, что «одним из обязательных условий профилактики рака является поддержание гормонально-метаболических показателей на уровне, которого организм достигает в возрасте 20–25 лет…». Сегодня мечты ученых прошлого века осуществимы, поскольку у нас есть для этого эффективные и безопасные препараты, но они, к сожалению, практически не используются.
Несмотря на то, что соматические заболевания ведут к андрогенному дефициту, усугубляющему их течение, определение тестостерона не стало рутинной практикой. Восполнение андрогенного дефицита повышает эффективность лечения эректильной дисфункции ингибиторами фосфодиэстеразы 5 типа (ФДЭ-5), нарушений мочеиспускания 5 альфа-адреноблокаторами, сахарного диабета сахаропонижающими препаратами, способствует снижению веса — основного компонента метаболического синдрома.
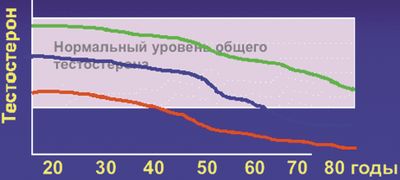
Возрастное снижение секреции тестостерона у мужчин начинается с 30 лет, причем скорость снижения свободного тестостерона превышает скорость снижения общего тестостерона (за счет усиления с возрастом синтеза глобулина, связывающего половые стероиды (ГСПС)). Ежегодно у пациентов 30–40 лет снижение тестостерона составляет около 0,7–1,0% от общего тестостерона и 1,2–1,4% от его свободной его фракции. В литературе данный синдром получил множество названий: «андропауза», «мужской климакс», мужская менопауза. В настоящее время вышеперечисленные термины признаны неточными и практически не используются. В прямом смысле климакса (пер. с греч. — ступень, лестница) у мужчин с возрастом не наблюдается. Однако происходит постепенное угасание половых и гормональных функций, хотя полного их выключения не наблюдается до глубокой старости.
В современной литературе используются следующие термины:
ВАД представляет собой клинический и биохимический синдром, связанный со старением. Характеризуется типичными симптомами хронической недостаточности системного действия тестостерона и проявляется нарушением функции различных органов и систем, а также снижает качество жизни (Nieschlag E., Swerdloff R. et al., 2005).
Сроки наступления и распространенность ВАД. Сроки наступления клинически значимого ВАД индивидуальны и зависят от уровня тестостерона на пике его секреции в 20–30 лет: чем выше его содержание, тем позже наступит его снижение, выходящее за нормативные показатели (рис. 1).
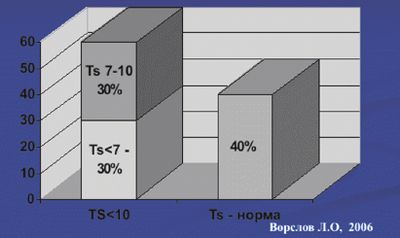
Любое хроническое соматическое заболевание негативно влияет на секрецию тестостерона, приводя к ускорению наступления андрогенного дефицита, в связи с чем распространенность андрогенного дефицита при хронических соматических заболеваниях крайне высока. По нашим данным распространенность ВАД при сахарном диабете 2-го типа составляет 68% (рис. 2), а при ИБС — 60% (рис. 3).
Уровень ГСПС, наоборот, повышается при старении, поэтому содержание свободной фракции тестостерона дополнительно снижается. У мужчин без соматических заболеваний распространенность ВАД увеличивается с возрастом и составляет в среднем 30% в популяции мужчин старше 50 лет (табл. 1).
Сочетанные с ВАД возрастные изменения секреции других гормонов. Процесс старения происходит практически во всех органах эндокринной системы, захватывает в том числе надпочечники. Изменения, происходящие в них с возрастом, получили название адренопаузы. Этот термин описывает снижение уровня дегидроэпиандростерона (ДГЭА) и ДГЭА-сульфата в надпочечниках, в то время как секреция кортикотропина долгое время остается неизменной. Недостаток ДГЭА приводит к снижению настроения, либидо, ослаблению потенции, остеопении, уменьшению массы и силы мышц, нарушению иммунитета, появлению инсулинорезистентности.
В процессе старения уменьшается выработка второго важного анаболического гормона — гормона роста (соматопауза). По данным ряда авторов, наблюдается возрастное снижение уровня мелатонина (меланопауза). С дефицитом этого гормона связывают нарушение равновесия в системе «сон–бодрствование».
Хотя старение не приводит к полному гормональному дефициту, возможно медицинское вмешательство в процессы андро-, сомато-, мелано- и адренопаузы с целью отсрочить некоторые проявления процесса старения (Лоран О. Б., Сегал А. С., 1999).
Клиническая картина ВАД представлена в табл. 2. На фото дан клинический пример ВАД. Обращает внимание увеличение количества жировой ткани (абдоминальное ожирение), уменьшение мышечной массы, дряблость кожи, уменьшение роста волос на туловище, конечностях, лобке.
Диагностика ВАД
Этапы диагностики ВАД
Категории пациентов, имеющих повышенный риск ВАД, у которых проведение гормонального скрининга абсолютно необходимо:
Категории пациентов, имеющих повышенный риск развития ВАД, у которых проведение гормонального скрининга желательно:
Постановка диагноза. Общепринято, что для подтверждения ВАД исследуют уровень общего тестостерона и ГСПС. Забор крови должен проводиться утром между 7.00 и 11.00 ч. Если уровень общего тестостерона выше 12 нмоль/л (3,46 нг/мл), при наличии клинической картины андрогенного дефицита, то необходимо подсчитать уровень свободного тестостерона по формуле. Если уровень общего тестостерона ниже 12 нмоль/л (200 пмоль/л), необходимо определить ТТГ, пролактин, провести оценку функции печени и почек, состояния углеводного и липидного обменов для исключения индуцированного гипогонадизма другими заболеваниями. ВАД должен быть диагнозом исключения, т. е. устанавливается только после исключения всех возможных причин гипогонадизма, включая медикаментозно-индуцированный гипогонадизм (рис. 4).
Роль ВАД в развитии ожирения и метаболического синдрома (МС) у мужчин. Как было установлено в ряде исследований, одним из определяющих факторов развития ожирения, инсулинорезистентности и МС у мужчин является дефицит половых гормонов и, в частности, тестостерона. Так, Simon D. et al. в TELECOM-Study при обследовании 1292 мужчин выявили четкую отрицательную взаимосвязь между уровнем тестостерона и уровнем инсулина (Simon D.). Chen R. Y. et al. показали, что уровень общего тестостерона у мужчин с МС значимо ниже, чем у здоровых. При этом выявлена обратная корреляция между концентрацией тестостерона и окружностью талии, а также уровнем холестерина липопротеидов низкой плотности. В то же время в данном исследовании не было выявлено причинной взаимосвязи между низким уровнем тестостерона и развитием сахарного диабета 2-го типа (Chen R. Y.). Однако проведенное ранее широкомасштабное исследование Massachusetts Male Aging Study свидетельствует о тесной корреляции между низким уровнем свободного тестостерона и риском развития инсулинорезистентности и сахарного диабета 2-го типа (Stellato R. K.).
Таким образом, низкий уровень тестостерона у мужчин следует рассматривать как один из компонентов МС наряду с инсулинорезистентностью, гиперинсулинемией, ожирением, дислипидемией, артериальной гипертензией, нарушением толерантности к глюкозе и нарушениями в свертывающей системе крови.
Лечение ВАД
Заместительная терапия андрогенами имеет уже 60-летнюю историю, благодаря Thomas H. B., Hill R. T., которые в 1940 году впервые успешно применили Тестостерона пропионат для лечения андрогенной недостаточности у мужчин. Долгое время показаниями для применения оставались классические формы гипогонадизма, а именно врожденный или приобретенный гипогонадизм (в основном опухолевого или травматического характера). В последнее время показания значительно расширились и все большую популярность и распространенность терапия андрогенами приобретает в лечении ВАД.
Терапия ВАД направлена на восполнение андрогенного дефицита. Камнем преткновения широкого назначения терапии препаратами тестостерона до сих пор является безопасность в отношении предстательной железы. Долгое время считалось, что андрогены являются стимуляторами онкогенеза в предстательной железе. Однако исследования последних лет опровергают это мнение, основанное на единичных наблюдениях повышения уровня кислой фосфатазы у больных с раком предстательной железы на фоне применения препаратов тестостерона, проведенных в прошлом столетии. Сегодня доказано, что андрогенотерапия не только безопасна в отношении предстательной железы, но и, более того, гипогонадизм рассматривается как фактор, ассоциированный с более тяжелым и агрессивным течением рака предстательной железы. Исследования последних лет, проведенные в Европе и США, показали, что частота развития рака простаты на фоне андрогенотерапии не превышает частоту выявления рака простаты в популяции мужчин, не получающих терапию препаратами тестостерона (Morgentaller A., 2006), а низкий уровень тестостерона ассоциирован с более агрессивными формами рака предстательной железы.
В настоящее время имеется широкий выбор препаратов для восполнения андрогенного дефицита (табл. 3). У мужчин с сохраненной секреторной способностью клеток Лейдига можно использовать как терапию экзогенными препаратами, так и стимулирующую терапию гонадотропином хорионическим. Стимулирующая терапия должна быть методом выбора у пациентов, планирующих иметь детей, поскольку экзогенные препараты, особенно инъекционные формы, оказывают негативное действие на сперматогенез.
У мужчин с повышением уровня ЛГ, являющегося маркером поражения клеток Лейдига, необходимо проведение постоянной терапии андрогенами, причем дозу препарата следует подбирать именно под контролем ЛГ, который при правильно подобранной дозе должен находиться в пределах нормальных показателей.
В настоящее время существует достаточно широкий спектр препаратов тестостерона для проведения андрогенотерапии, включающий в себя пероральные формы, масляные растворы для внутримышечных инъекций, а также трансдермальные гели и пластыри. Поскольку все препараты тестостерона обладают своими преимуществами и недостатками, при выборе метода гормональной терапии необходимо руководствоваться принципами эффективности, безопасности и удобства применения. Как правило, при начале терапии андрогенами при ВАД, препаратами выбора являются неинвазивные формы — трансдермальные гели, которые на российском рынке представлены препаратом «Андрогель».
Тестостерон в виде геля всасывается с поверхности кожи и поступает в кровоток, при этом постоянная концентрация в плазме наблюдается в течение 24 часов. Единственный его недостаток заключается в наличии возможности контакта геля с кожей партнерши.
При выраженном андрогенном дефиците, сопровождаемом повышением уровня ЛГ, лучше использовать препараты тестостерона длительного действия.
Ранее в нашей стране были зарегистрировано 2 андрогенных препарата с относительно длительным действием — Сустанон-250 и Омнадрен 250, инъекции которых необходимо делать 2–3 раза в месяц. Эти препараты являются смесью четырех эфиров тестостерона — тестостерона капроната, изокапроната, пропионата и фенилпропионата, которые характеризуются разной фармакокинетикой. Тестостерона пропионат начинает действовать быстро, однако к концу первого дня действие его практически прекращается, фенилпропионат и изокапронат начинают действовать примерно через сутки, действие продолжается до двух недель, а самый длительно действующий — капронат, его действие может продолжаться до 3–4 недель. Существенным недостатком этих препаратов являются колебания концентрации тестостерона в крови от супра- до субфизиологических, что ощущается рядом больных. Кроме того, супрафизиологические подъемы содержания тестостерона в некоторых случаях ведут к повышению гематокрита, что не только требует контроля за состоянием крови, но и в некоторых случаях требует отмены препарата. В 2005 г. для больных с андрогенной недостаточностью стал доступен новый препарат тестостерона с по-настоящему длительным действием — тестостерона ундеканоат (Небидо®) в виде масляного раствора, который во всем мире признан препаратом выбора для проведения длительной заместительной гормональной терапии гипогонадизма любого генеза и, в том числе, ВАД. Небидо® не только длительно поддерживает тестостерон сыворотки крови на физиологическом уровне, что позволяет надежно и эффективно ликвидировать и предотвращать симптомы недостаточности тестостерона, но и значительно лучше переносится пациентами, по сравнению с указанными ранее известными внутримышечными препаратами, поскольку после инъекции Небидо® уровень тестостерона в течение 12 недель поддерживается в физиологических пределах, без резких повышений и снижений. Пациентам требуется всего 4–5 инъекций в год. Однако, учитывая достаточно большой объем масляного раствора препарата — 4 мл, необходимость медленного внутримышечного введения препарата, мы рекомендуем введение препарата под контролем врача, для избежания возможного возникновения абсцессов.
Побочные эффекты андрогенотерапии
Терапия андрогенами при ВАД является заместительной терапией, т. е. происходит нормализация содержания тестостерона, поэтому при правильно подобранной дозе, т. е. при дозе, при которой уровень тестостерона находится в нормальных физиологических пределах и никаких побочных эффектов от проводимой терапии быть не может.
При превышении дозы возможно развитие побочных эффектов, связанных с передозировкий андрогенов:
ДГЭА (дегидроэпиандростерон)
Дано определение, характеристика изменения концентрации ДГЭА с возрастом. Описаны функции ДГЭА и ДГЭА (С) у молодых и пожилых людей, роль ДГЭА и ДГЭА (С) в механизмах регуляции синтеза белков скелетных мышц, роль терапии посредством ДГЭА и ДГЭА (С) пожилых мужчин и женщин.
ДГЭА (дегидроэпиандростерон)
Определение
Дегидроэпиандростерон (ДГЭА) – гормон со слабой андрогенной активностью. ДГЭА, его транспортная сульфатная форма дегидроэпиандростерон-сульфат (ДГЭА(С)) и антростенедион вырабатываются в коре надпочечников (В.М. Кэттайл, Р.Ф. Арки, 2001). Производство гормона происходит под контролем АКТГ.
Изменение концентрации ДГЭА с возрастом
Уровни ДГЭА достигают пика в юношеском возрасте. После 30 лет секреция ДГЭА и ДГЭА(С) в надпочечниках начинает снижаться (И.А. Тюзиков, С.Ю. Калинченко, 2017). В 70–80 лет значения ДГЭА составляют лишь 10–20% от пикового значения в пубертатном периоде.
Функции
ДГЭА позитивно влияет на плотность костной ткани, массу скелетных мышц, липидный и углеводный обмен (ожирение, инсулинорезистентность, сахарный диабет), кожу, волосы, либидо и сексуальность. Он также отвечает за развитие вторичных половых признаков. У женщин этот гормон контролирует рост волос в подмышечных областях и на лобке.
К настоящему времени в экспериментальных исследованиях установлено, что возрастной дефицит ДГЭА(С) у мужчин и женщин, обычно развивающийся после 30 лет, приводит к развитию саркопении, снижению настроения, либидо, ослаблению потенции, остеопении/остеопорозу, нарушениям иммунитета, раннему проявлению инсулинорезистентности, ожирения и сахарного диабета (И.А. Тюзиков, С.Ю.Калинченко, 2017).
Роль ДГЭА и ДГЭА (С) в механизмах регуляции синтеза белков скелетных мышц
Анаболические эффекты применения ДГЭА клинически доказаны, поэтому он может применяться для ускорения набора массы скелетных мышц.
Следует отметить, что с момента открытия в 1930-х гг. и вплоть до 1990-х гг. надпочечниковые андрогены: ДГЭА и ДГЭА(С) рассматривались у мужчин как слабые андрогены, вклад которых в общий мужской андрогенный фон считался клинически не значимым, поэтому их эффектами практически всегда пренебрегали. В настоящее время установлено, что ДГЭА(С) – это ключевой буферный гормон стрессоустойчивости, так как представляет собой естественный антиглюкокортикоид, противостоящий кортизолу – ключевому гормону стресса, уровень которого резко повышается при любом стрессе, приводя к блокаде синтеза ДГЭА(С) и половых стероидов (И.А. Тюзиков, С.Ю.Калинченко, 2017).
Интракринная регуляция
Еще в конце 80-х гг. XX века канадский профессор Фердинанд Лабри впервые установил способность некоторых клеток периферических тканей к самостоятельному синтезу необходимых им андрогенов (тестостерона) и эстрогенов из ДГЭА(С) непосредственно внутри клеток этих тканей «по требованию», автономно и независимо от половых желез, минуя системный кровоток. Такой механизм гормональной регуляции был им назван интракринным, и он происходит в таких периферических тканях, как кожа, скелетные мышцы, головной мозг, молочная и предстательная железы, вагинальный эпителий.
Так, по данным некоторых авторов, до 35% тестостерона у мужчин потенциально образуется в периферических тканях именно из ДГЭА(С), минуя традиционный тестикулярный путь синтеза. У женщин до 75% эстрогенов (эстроген и прогестерон) и тестостерона до менопаузы и до 100% эстрогенов и тестостерона после менопаузы синтезируются в периферических тканях именно из ДГЭА. Более того, сегодня появляется все больше публикаций, свидетельствующих о важной роли надпочечниковых андрогенов в организме человека, что позволяет рассматривать их еще и как самостоятельные полифункциональные гормоны (И.А. Тюзиков, С.Ю.Калинченко, 2017).
Терапия посредством ДГЭА пожилых мужчин
В этом направлении проведено очень мало исследований. Известно исследование, в котором терапия посредством ДГЭА пожилых мужчин продолжалась 36 недель. Это привело к достоверному уменьшению жировой массы, повышению концентрации общего тестостерона. Однако не было установлено достоверного изменения липидного и углеводного обменов, костного и мышечного метаболизма, сексуальной функции.
Терапия посредством ДГЭА пожилых женщин
Доказано достоверное позитивное влияние терапии посредством ДГЭА на силу скелетных мышц и сексуальную функцию пожилых женщин.
ДГЭА и питание
Орехи, семечки, жирная рыба, авокадо; мясо скота, выращенного на «свободном выгуле» (желательно, на траве); яйца, сливочное и оливковое масло повышают уровень ДГЭА в организме.
О взаимосвязи гормонов и мышечной массы можно прочесть в моей книге «Гормоны и гипертрофия скелетных мышц человека»
Дегидроэпиандростерон: физиологическая роль и возможности применения в качестве медикаментозного средства
Полный текст:
Аннотация
Дегидроэпиандростерон (ДГЭА) — один из важных андрогенов, синтезируемых корой надпочечников из 17-гидроксипрегненолона. В сетчатой зоне коры надпочечников при участии ферментов 17, 20-десмолазы и 17-а-гидроксилазы происходит последовательное превращение холестерина через 17- гидроксипрегненолон (17-ОН-прегненолон) в ДГЭА. Доказано, что надпочечники принимают основное участие в синтезе ДГЭА (70%) и его менее активного метаболита — дегидроэпиандростерона сульфата (ДГЭА-С) (85%). Только 10% ДГЭА синтезируется в половых железах. Имеются данные об образовании ДГЭА в центральной нервной системе, где в астроцитах и нейронах обнаружены ферментные системы (Р450с17), осуществляющие синтез ДГЭА из прегненолона.
Ключевые слова
Для цитирования:
Роживанов P.В., Вакс В.В. Дегидроэпиандростерон: физиологическая роль и возможности применения в качестве медикаментозного средства. Проблемы Эндокринологии. 2005;51(2):46-51. https://doi.org/10.14341/probl200551246-51
For citation:
Rozhivanov P.V., Vaks V.V. Dehydroepiandrosterone: physiological role and possibilities of use as a drug. Problems of Endocrinology. 2005;51(2):46-51. (In Russ.) https://doi.org/10.14341/probl200551246-51
Биология, синтез и метаболизм дегидроэпиандростерона
Дегидроэпиандростерон (ДГЭА) — один из важных андрогенов, синтезируемых корой надпочечников из 17-гидроксипрегненолона. В сетчатой зоне коры надпочечников при участии ферментов 17, 20-десмолазы и 17-а-гидроксилазы происходит последовательное превращение холестерина через 17- гидроксипрегненолон (17-ОН-прегненолон) в ДГЭА. Доказано, что надпочечники принимают основное участие в синтезе ДГЭА (70%) и его менее активного метаболита — дегидроэпиандростерона сульфата (ДГЭА-С) (85%). Только 10% ДГЭА синтезируется в половых железах [22]. Имеются данные об образовании ДГЭА в ЦНС, где в астроцитах и нейронах обнаружены ферментные системы (Р450с17), осуществляющие синтез ДГЭА из прегненолона [53].
ДГЭА-С синтезируется в основном в виде сложного эфира сульфата из сложного эфира сульфата холестерина. ДГЭА-С подвергается гидролизу, тем самым поддерживая постоянный уровень ДГЭА в плазме крови. Основное количество ДГЭА-С ката- болизируется, 10% стероида выводится с мочой и совсем небольшая часть — через кишечник [3]. ДГЭА-С секретируется со скоростью 10—20 мг/сут (35—70 мкмоль/сут) у мужчин и 3,5—10 мг/сут (12—35 мкмоль/сут) у женщин, причем без циркадного ритма. ДГЭА секретируется со скоростью, составляющей соответственно 1/4 и 1/2 от скорости секреции ДГЭА-С у мужчин и женщин. Синтезируемый с более низкой скоростью, чем ДГЭА-С, ДГЭА обладает более коротким периодом полураспада. ДГЭА, как и кортизол, имеет циркадный ритм секреции с максимальным уровнем в утренние часы. В течение менструального цикла значительных изменений его уровня не выявлено [3, 4]. Поскольку метаболический клиренс ДГЭА очень высокий, его концентрация в циркулирующей крови приблизительно в 300 раз ниже уровня ДГЭА-С. ДГЭА и ДГЭА-С не связываются с белком, связывающим половые стероиды, и, следовательно, его концентрация не влияет на уровень этих гормонов. Однако ДГЭА-С связывается с альбумином сыворотки крови [22]. Из-за достаточно высокой концентрации ДГЭА-С в крови, длительного периода его полураспада и высокой стабильности, а также того факта, что его источником в основном являются надпочечники, определение концентрации ДГЭА-С представляет большую диагностическую значимость, чем ДГЭА или 17-кетостероидов.
ДГЭА и ДГЭА-С катаболизируются в андрогены: андростендиол, тестостерон и дигидротестостерон. Вклад надпочечников в синтез андрогенов приближается к 40—45%, в то время как надпочечниками синтезируется лишь 15—25% от общего пула тестостерона. Существует мнение, согласно которому на долю надпочечниковых андрогенов в общей концентрации андрогенов плазмы приходится почти 95% ДГЭА-С, 90% ДГЭА, около 30% андростендиона и только 5% тестостерона [3, 5].
Эмбриональные надпочечники синтезируют существенные количества ДГЭА, но производство этого стероида снижается после рождения. Начало адренархе (между 6-м и 8-м годом) характеризуется повышением биосинтеза ДГЭА, достигающего пика в 3-м десятилетии жизни [32]. В последующие возрастные периоды происходит постепенное снижение синтеза ДГЭА, и к возрасту 80 лет уровни ДГЭА составляют около 10—20% от определяемых в молодом возрасте в отличие от уровня циркулирующего кортизола, секреция которого остается относительно неизменной |49].
Концентрация ДГЭА-С в крови увеличивается только при заболеваниях надпочечников: опухолях, секретирующих андрогены, врожденной дисфункции коры надпочечников с дефицитом 21- гидроксилазы или 11-р-гидроксилазы, АКТГ-зави- симом гиперкортицизме [3, 4].
Регуляция синтеза ДГЭА
Вопрос о регулирующей роли гипофиза в синтезе андрогенов корой надпочечников остается до сих пор недостаточно изученным. Разными исследователями показано, что основным регулирующим фактором синтеза ДГЭА и ДГЭА-С в коре надпочечников, как и других кортикостероидов, является АКТГ, поскольку его введение сопровождается увеличением концентрации как кортизола, так и ДГЭА [1, 22]. При ингибировании продукции АКТГ снижается и уровень ДГЭА. Связывание АКТГ с рецептором инициирует серию последовательных реакций и активирование цАМФ-зависи- мой протеинкиназы, которая в свою очередь приводит к фосфорилированию белков рибосом, активированию синтеза de novo стероидогенных ферментов (холестеринэстеразы, десмолазы и др.), определяющих скорость стероидогенеза [ 1]. В тканях надпочечника под влиянием АКТГ отмечается повышение синтеза ДНК и РНК, увеличиваются размеры клеток, объем ядер, гипертрофируются ядрышко и пластинчатый комплекс, возрастает число липидных клеток в цитоплазме митохондрий, увеличивается гладкая эндоплазматическая сеть, т. е. происходит изменение структур, ответственных за синтез стероидов. По данным Е. Arvat и соавт. [9], процессы синтеза ДГЭА оказались наиболее чувствительными к АКТГ. В то же время диссоциация между уровнем секреции кортизола и ДГЭА, наблюдаемая при разнообразных физиологических (по мере старения человека) и патологических состояниях, свидетельствует о том, что АКТГ не является единственным регулятором секреции ДГЭА. В литературе описано влияние различных факторов на плазменные уровни ДГЭА и ДГЭА-С. Так, травмы, хирургические вмешательства, нервные стрессы, прием пищи и курение увеличивают уровни ДГЭА и ДГЭА-С, а введение инсулина, наоборот, снижает уровни этих гормонов [22]. Таким образом, вопрос о регуляции секреции ДГЭА и ДГЭА-С до сих пор остается дискуссионным.
Физиологическая роль и механизмы действия ДГЭА
Физиологическая роль ДГЭА определена не полностью. ДГЭА является субстратом для синтеза андростендиона и тестостерона, которые в адре- нархе способствуют развитию лобкового и подмышечного оволосения. Однако имеются свидетельства о том, что ДГЭА обладает способностью оказывать влияние на ЦНС, включая улучшение памяти и способности к обучению, снижение депрессии и улучшение настроения [40]. Установлено, что нервная ткань захватывает ДГЭА лучше, чем другие ткани, и поскольку головной мозг характеризуется высокой метаболической активностью, а процессы транскрипции в нем превышают таковые в других тканях, высказывается предположение об участии ДГЭА в процессах транскрипции [20]. Кроме этого, существует возможность синтеза ДГЭА в головном мозге de novo, ввиду чего ДГЭА и другие метаболиты этого стероида были названы нейростероидами, осуществляющими несколько жизненных нейрофизиологических функций, включая регулирование нейронной возбудимости [40, 53]. Так, при пероральном приеме ДГЭА в дозе 500 мг в исследовании, проведенном на здоровых добровольцах, было отмечено существенное увеличение быстрого движения глазных яблок во время сна, принимая во внимание, что все другие характеристики сна остались неизменными. Спектральный анализ отобранных электроэнцефалограмм подтвердил отмеченные изменения [25].
В литературе имеются данные о влиянии ДГЭА на иммунную систему. Показано, что введение ДГЭА увеличивает как цитотоксичность NK-кле- ток in vitro [45], так и их количество [17]. Учитывая увеличение секреции интерлейкина-2 активизированными Т-лимфоцитами, которое было продемонстрировано у мышей, можно высказать предположение о иммуномодулирующем эффекте ДГЭА [20], хотя заместительная терапия ДГЭА у людей не оказала влияния на иммунную реакцию в ответ на вакцинацию против гриппа [19].
В литературе продолжает дискутироваться вопрос о диапазоне предполагаемых действий ДГЭА: влияние на функции ЦНС, сердечно-сосудистую и иммунную системы, антиканцерогенный эффект, снижение массы тела, профилактику остеопороза и т. д. [39].
Многочисленные исследования на животных подтвердили многие из возможных действий ДГЭА. Так, прием ДГЭА давал протективный эффект у лабораторных животных по отношению к раку молочных желез, легких, толстого кишечника, печени, кожи и лимфатической ткани. Заместительная терапия с помощью ДГЭА позволила снизить частоту возникновения рака молочной железы на 73% в опыте на крысах, подвергаемых канцерогенному воздействию [26]. Также в исследованиях на животных ДГЭА оказался способным давать противоположный по отношению к глюкокортикоидам эффект, противодействуя нейротоксичности кортикостерона в гиппокампе [34]. К сожалению, исследования ДГЭА не у приматов имеют ограниченную ценность: у других животных отсутствует повышение уровней ДГЭА-С в адренархе и возрастное снижение циркулирующих уровней этого стероида.
Проведенные исследования позволяют рассматривать несколько механизмов, через которые ДГЭА оказывает свое действие: а) неконкурентное ингибирование глюкозо-6-фосфатдегидрогеназы [20]; б) регуляция деятельности ферментов или биорегуляторных факторов и их рецепторов (например, эноил-СоА-гидратазы, карбомилфосфат- синтетазы, глицерол-3-фосфатдегидрогеназы, Т- клеточный рецептор к IgD, цитокины [20]; в) регуляция экспрессии генов (например, цитохрома Р- 450s, NADPH-цитохром P-450-редуктазы, ацил- СоА-оксидазы) [20]; г) антагонистическое действие к рецептору гамма-аминомасляной кислоты и агонистическое — к NMDA-рецептору в ЦНС [15, 53]. Однако до настоящего времени специфический рецептор ДГЭА не идентифицирован; не определено, действует ли ДГЭА на поверхности клетки или внутриклеточно. Кроме того, ДГЭА модулирует сигналы клеточной MAP-киназы, не зависящие от пострецепторных путей половых стероидов [39]. Эти наблюдения показывают, что ДГЭА может иметь прямое действие, которое отличается от эффектов других стероидов.
Применение ДГЭА с лечебной целью
Большое количество исследований показало постоянное снижение уровней ДГЭА-С с возрастом вследствие уменьшения активности фермента надпочечниковой 17-сс-гидроксилазы или инволюции сетчатой зоны. У лиц обоего пола происходит снижение уровней ДГЭА-С приблизительно на 2% в год [29], но в возрастной группе 50—89 лет абсолютные уровни гормона у женщин ниже, чем у мужчин [37]. Кроме того, перекрестные исследования выявили связь между постоянным возрастным снижением уровня ДГЭА-С и различными неблагоприятными эффектами старения. В исследовании, проведенном Е. Barrett-Connor и соавт. [13], была получена корреляция низкого уровня ДГЭА- С в ЦНС с выраженностью депрессии у пожилых женщин, что не отмечалось у мужчин, а повышение отношения кортизол/ДГЭА коррелировало со снижением мнестических функций у лиц обоего пола [33]. Продемонстрирована положительная корреляция между сниженными уровнями ДГЭА- С в сыворотке крови и низкой минеральной плотностью кости в позвоночнике, бедре и лучевой кости у женщин 45—69 лет [47], но такого эффекта не отмечено у мужчин [28]. Выявлено, что уровни ДГЭА и ДГЭА-С были более низкими у больных сахарным диабетом типа 1, а инсулинотерапия не увеличивала уровни надпочечниковых андрогенов [2].
На сегодняшний день известно, что снижение уровня ДГЭА-С обусловлено процессом старения, поэтому многочисленные исследования стремились продемонстрировать изменения в биохимических, метаболических и нейрофизиологических показателях после назначения ДГЭА-С пожилым пациентам.
При проведении плацебо-контролируемого исследования по изучению фармакокинетики и фармакодинамики ДГЭА в дозах 50 и 25 мг ежедневно у 24 здоровых пожилых мужчин и женщин (67,8 ± 4,3 года) в течение 8 дней [38] были получены следующие результаты: период полураспада ДГЭА в крови составил более 20 ч, как и ДГЭА-С, что объясняется обратной трансформацией перорально принятого ДГЭА в ДГЭА-С. Этот механизм наиболее выражен у женщин и обеспечивает длительную циркуляцию неконъюгированного ДГЭА и его метаболитов. В ходе исследования не отмечено кумуляции стероидов, чрезмерной их конверсии в андрогены или эстрогены при некотором увеличении уровня эстрадиола у женщин. Авторы предполагают, что ежедневный пероральный прием 25—50 мг ДГЭА эффективен и безопасен для пожилых пациентов с низким уровнем ДГЭА-С, в то время как прием 50 мг ДГЭА в молодом возрасте может привести к чрезмерному увеличению концентрации стероида в крови. W. Arlt и соавт. [8] показали, что прием 50 мг ДГЭА у лиц в возрасте 49— 70 лет восстанавливает ДГЭА-С до уровня, характерного для молодого возраста, а прием 100 мг является супрафизиологической дозой. Предполагается, что терапевтической дозировкой является та, при которой уровни ДГЭА и ДГЭА-С соответствуют молодому возрасту. Аналогичные данные были получены Е. Baulieu и соавт. [14].
Кроме перорального применения ДГЭА, изучали транскутанный путь введения препарата, который позволяет избежать эффекта первичной печеночной трансформации ДГЭА [35]. После 2-не- дельного ежедневного транскутанного применения ДГЭА у пациентов в возрасте 60—70 лет плазменные уровни ДГЭА и ДГЭА-С увеличились на 175 и 90% соответственно с возвращением к прежним значениям через 7 дней после прекращения лечения. Сывороточный уровень андростендиона увеличился приблизительно на 80%, в то время как уровни тестостерона и дигидротестостерона в сыворотке остались неизменными.
При рандомизированном двойном слепом пла- цебо-контролируемом исследовании лечебного эффекта 50 мг ДГЭА в течение 6 мес у 13 мужчин и 17 женщин 40—70 лет, помимо восстановления содержания ДГЭА (ДГЭА-С) до уровней, характерных для молодого возраста, отмечено улучшение физического и психологического состояния у 67% мужчин и 81% женщин при отсутствии изменения либидо [42]. Этот эффект был объяснен увеличением уровня инсулиноподобного фактора роста 1 и уменьшением содержания белка, связывающего его, поскольку изменений в уровнях белка, связывающего половые стероиды, эстрогенов или липидов не выявлено. При продлении наблюдения та же самая группа пожилых пациентов (9 мужчин и 10 женщин в возрасте 50—65 лет) при приеме 100 мг ДГЭА в течение 6 мес [43] показала восстановление соотношения кортизол/ДГЭА-С, характерного для лиц молодого возраста, уменьшение массы жировой ткани и повышение мышечной силы у мужчин. При этом отмечено, что уровни циркулирующих андрогенов (андростендиона, тестостерона, дигидротестостерона) повысились до показателей, наблюдающихся в молодом возрасте у женщин, но не у мужчин. Предполагается, что имеются половые особенности ответа на заместительную терапию ДГЭА. Назначение лицам пожилого возраста 100 мг ДГЭА в течение 3 мес в другом исследовании не выявило влияния ДГЭА на телосложение, а также на уровень простатспецифического антигена в сыворотке или состояние мочевыводящих путей [24].
По данным Е. Baulieu и соавт. [14], в ходе рандомизированного плацебо-контролируемого исследования заместительной терапии 50 мг ДГЭА в течение 12 мес у 280 мужчин и женщин 60—79 лет через 6 мес обнаружено повышение выше физиологического уровня у 21% женщин сывороточного тестостерона и глюкоронида андростендиола при отсутствии их изменений у мужчин; у обследованных 60—69 лет отмечено увеличение минеральной плотности кости в шейке бедра, а у лиц 70—79 лет — в лучевой кости, а также снижение только у женщин уровня телопептида коллагена сыворотки. Кроме того, у женщин отмечено увеличение либидо, улучшение половой функции и полового удовлетворения. Как у мужчин, так и у женщин были выявлены изменения кожных покровов: потливость, уменьшение пигментации лица и эпидермальной атрофии, увеличение секреции сальных желез (особенно у женщин старше 70 лет). Изменений сосудистой функции по данным ультрасонографических методов не отмечено.
После менопаузы уровни тестостерона и андростендиона снижаются на 50%, и в дальнейшем отмечается постепенное снижение содержания ДГЭА-С, что способствовало появлению исследований, изучающих эффективность заместительной терапии ДГЭА у женщин в постменопаузе. F. Labrie и соавт. [36] при применении местного лечения кремом, содержащим 10% ДГЭА, у 14 женщин 60— 70-летнего возраста в течение 12 мес отметили увеличение уровней ДГЭА в крови в 10 раз. Наряду с этим они наблюдали увеличение секреции сальных желез и индекса созревания влагалищного эпителия, минеральной костной плотности бедра, уровня остеокальцина в крови и уменьшение уровня щелочной фосфатазы и гидроксипролина мочи. Другие изменения заключались в сокращении на 10% толщины кожной складки, снижении уровня глюкозы в крови и инсулина без негативного влияния на липидный профиль, улучшении самочувствия пациенток [23]. Полученные данные описывают положительное влияние заместительной терапии ДГЭА у женщин в постменопаузе, не сопровождающееся побочными эффектами. Стимулирующее влияние ДГЭА на влагалищный эпителий при отсутствии гиперплазии эндометрия представляет определенный интерес, поскольку отпадает необходимость в заместительной терапии гестагенами. Напротив, назначение 50 мг ДГЭА перорально в пременопаузе (45—55 лет) 60 женщинам, несмотря на двойное повышение уровней ДГЭА-С, оказало меньшее действие [11]; не выявлено влияния на настроение, мнестические функции, качество жизни или либидо.
Циркулирующие уровни ДГЭА-С у больных с надпочечниковой недостаточностью очень низкие по сравнению с пожилыми людьми. Такой дефицит наблюдается как при первичной (болезнь Аддисона), так и при вторичной надпочечниковой недостаточности. В то время как дефицит глюкокортикоидов и минералокортикоидов при надпочечниковой недостаточности представляет угрозу для жизни и требует заместительной терапии соответствующими гормонами, недостаточность синтеза ДГЭА обычно не угрожает жизни. С другой стороны, несмотря на оптимальную терапию препаратами глюко- и минералокортикоидов, пациенты с болезнью Аддисона нередко отмечают постоянную слабость и плохое самочувствие [10], это послужило основанием для исследования эффективности заместительной терапии ДГЭА у больных с различными видами надпочечниковой недостаточности [31]. Так, J. Young и соавт. [52] показали, что назначение 50 мг ДГЭА 10 пациентам с гипопитуитаризмом привело к восстановлению уровней ДГЭА-С, андростендиона и тестостерона до наблюдающихся улиц молодого возраста. W. Arlt и соавт. [6] при исследовании эффективности заместительной терапии ДГЭА у молодых женщин с подавленным дексаметазоном надпочечниковым стероидогенезом также показали, что суточная доза ДГЭА 50 мг оптимальна по сравнению с назначением 100 мг, приводящим к супрафизиологическим концентрациям ДГЭА-С.
Рандомизированное двойное слепое плацебо- контролируемое исследование заместительной терапии 50 мг ДГЭА, проведенное 24 женщинам с надпочечниковой недостаточностью (14 — с первичной, 10 — с вторичной), подтверждает восстановление физиологических уровней ДГЭА (ДГЭА-С) и андростендиона, повышение уровня тестостерона плазмы до нижней границы нормы, уменьшение депрессии, улучшение общего самочувствия и настроения, увеличение полового влечения [7]. У 19 из 24 пациенток отмечены кожные андрогензави- симые побочные эффекты, что было выявлено и другими авторами. Выраженность побочных эффектов не зависела от дозы ДГЭА (50 или 200 мг) [27]. Е. Gurnell и V. Chatterjee [29] в проведенном рандомизированном двойном слепом плацебоко нтролируемом исследовании у мужчин (и = 15) и женщин (п = 24) с болезнью Аддисона после 3 мес применения 50 мг ДГЭА, кроме повышения уровней тестостерона в крови, отметили снижение концентрации белка, связывающего половые стероиды у женщин, в отличие от мужчин. Также в данном исследовании была выявлена тенденция к улучшению качества жизни при обследовании с помощью специальных анкет (General Health Questionnaire). При этом не выявлено влияния на познавательную или половую функции, изменений состава тела или минеральной плотности кости, но заместительная терапия ДГЭА в данном исследовании была кратковременной. Ввиду наличия у мужчин психологических эффектов, не зависящих от изменений уровня тестостерона, было сделано заключение о том, что ДГЭА может действовать непосредственно на ЦНС, а не через увеличение периферического биосинтеза андрогенов.
Сообщения о низких уровнях ДГЭА или ДГЭА-С у пациентов с шизофренией и у лиц со скудными познавательными функциями побудили к клиническим исследованиям, изучившим корреляции сывороточных уровней ДГЭА и ДГЭА-С у пациентов с данной патологией. При оценке изменения памяти, симптомов психической патологии у 17 пациентов с шизофренией и их корреляций с сывороточными уровнями ДГЭА и ДГЭА-С была отмечена отрицательная корреляция уровня ДГЭА и/ или соотношения ДГЭА/кортизол с психопатологическими симптомами [30]. В исследовании, проведенном R. Strous и соавт. [46], 30 пациентов с шизофренией были рандомизированы, при этом они стали получать или препарат ДГЭА, или плацебо в дополнение к регулярному нейролептическому лечению. ДГЭА назначали в дозе 100 мг в течение 6 нед. Результаты показали существенное снижение негативной симптоматики, шизофрении и депрессии и беспокойства у пациентов, получающих ДГЭА. Этот эффект был более выражен у женщин. Увеличение уровней ДГЭА и ДГЭА-С в плазме приводило к уменьшению негативных симптомов, но не депрессии и беспокойства. Неблагоприятных эффектов у участвующих в исследовании пациентов не отмечено.
В литературе часто обсуждается вопрос о влиянии ДГЭА на процессы обмена веществ, в частности на ожирение. При обследовании 80 здоровых лиц A. Tchernof и соавт. [48] показали, что уровни ДГЭА были достоверно ниже у лиц с ожирением, что, возможно, было связано с инсулинорезистент- ностью [42]. G. De Pergola и соавт. [21] выявили обратную связь между уровнем ДГЭА и количеством жировой массы при обследовании женщин с ожирением. Они сообщили, что уровни ДГЭА были обратно пропорционально связаны с индексом массы тела. В нескольких исследованиях предпринимали попытки применения ДГЭА с целью уточнения его влияния на массу тела. D. Villareal и соавт. [50] при пероральном назначении ДГЭА в дозе 50 мг в день пожилым мужчинам и женщинам в течение 6 мес отметили уменьшение жировой массы. Однако в исследовании S. Welle и соавт. [51] при пероральном назначении ДГЭА в дозе 20 мг/кг в день здоровым добровольцам в течение 4 нед снижения жировой массы не отмечено. В целом нет убедительных данных о влиянии экзогенно вводимого ДГЭА на снижение массы тела при ожирении.
Одним из последствий ожирения и инсулиноре- зистентности являются атеросклероз и ишемическая болезнь сердца. В исследовании Е. Barrett- Connor и соавт. изучали корреляции между серологическим уровнем ДГЭА-С и смертностью у 242 пациентов в возрасте 50—79 лет в течение 12 лет. Была показана обратная связь между уровнем ДГЭА-С и ишемической болезнью сердца, смертностью у пожилых мужчин, чего не отмечено у женщин [12]. В поддержку протективного эффекта ДГЭА при ишемической болезни сердца свидетельствуют данные, полученные>. Slowinska-Srzednicka и соавт. [44]. Авторы сравнили уровни ДГЭА-С сыворотки у женщин в пременопаузе с ангиографически доказанной ишемической болезнью сердца и в контрольной группе. Уровни ДГЭА были значительно ниже в основной группе по сравнению с контрольной. L. Mitchell и соавт. [41] выявили аналогичную зависимость и показали, что эффект ДГЭА не зависит от других известных факторов риска ишемической болезни. Однако отсутствуют данные о результатах исследования, в котором положительное влияние экзогенно вводимого ДГЭА на коронарные артерии было бы подтверждено.
Р. Casson и соавт. [17] изучали влияние заместительной терапии ДГЭА на иммунную функцию и обнаружили, что у женщин в постменопаузе при ежедневном пероральном приеме 50 мг в течение 3 нед увеличились количество NK-клеток и цитотоксическая активность одновременно с уменьшением числа Т-хелперов. Учитывая возможную иммуномодулирующую роль ДГЭА, исследовали возможность его использования при лечении иммунодефицитных заболеваний, в частности СПИДа. М. Centurelli и М. Abate обнаружили отрицательную корреляцию концентрации ДГЭА с показателями прогрессии ВИЧ-инфекции [18].
Побочные эффекты заместительной терапии ДГЭА
В литературе имеются данные о некоторых неблагоприятных эффектах (акне, гирсутизм), возникающих при пероральном приеме ДГЭА, а также 1 сообщение [16] о серьезном побочном эффекте — развитии транзиторной желтухи и печеночной дисфункции через 1 нед приема 150 мг ДГЭА. Действительно ли печеночная дисфункция была прямым результатом применения ДГЭА, неизвестно, но предварительно зарегистрированное неблагоприятное влияние пероральных стероидов на функцию печени дает повод для дискуссии. Возможной альтернативой, позволяющей избежать подобных побочных эффектов, является транскутанный путь введения препарата.
Учитывая отсутствие достоверных эпидемиологических и клинических данных относительно безопасности применения ДГЭА, данный препарат не зарегистрирован Управлением по контролю качества пищевых продуктов и медикаментов (FDA) и повсеместно распространен как пищевая добавка.
Заключение
Таким образом, важность и многофункциональность ДГЭА не вызывают сомнений, однако требуются долговременные исследования для окончательного определения значения ДГЭА в организме человека, а также оценки безопасности его длительного использования, поскольку по эпидемиологическим данным заместительная терапия ДГЭА может влиять на сердечно-сосудистую заболеваемость, смертность, хронические когнитивные заболевания или онкологический риск.